心力衰竭物理治疗的新路径
——超声波辐照诱导正性肌力的基础和临床研究*
2018-05-03尹立雪
尹立雪
(四川省医学科学院·四川省人民医院·超声心脏电生理学与生物力学四川省重点实验室,四川 成都 610072)
心力衰竭是临床常见的心血管疾病终末期表现。据卫生部心血管病防治研究中心报告,2008~2009年我国现有心血管疾病患病人数达2.3亿,其中具有明显临床症状的心力衰竭患病人数高达420万[1]。近年来随着中国人口老龄化加剧,心力衰竭作为心血管疾病的终末阶段,患病人数持续增长。2016年国家心脏中心采样调查结果显示, 中国心力衰竭患病率已达到1.3%,现症患者有800万至1千万。中国可能已成为全球最大的心力衰竭患者群的国家。在40岁以上人群,5个人中就有1个(20%)有罹患心衰的风险。但是,目前临床能够采用的心力衰竭强心治疗方法有限,主要包括药物治疗(如:地高辛、多巴酚丁胺、氨力农和米力农等)和非药物治疗(如:CRT和VAD等)。药物治疗方法的正性肌力作用持续时间短,疗效有限,副作用大。终末期心力衰竭患者必须进行电机械矫正、机械辅助或心脏移植治疗,其治疗成本高,风险大。建立一种全新的临床能够常规持续应用的无创性心力衰竭正性肌力治疗方法是心血管病学基础和临床研究所面临的重大挑战。本文就心力衰竭物理治疗的新路径——超声波辐照诱导正性肌力的基础和临床研究现状及进展做一述评。
1 超声波辐照诱导产生心肌肌力改变的基础实验依据
1.1 早在1929年美国生理学家Harvey已经发现应用100kHz频率的超声波辐照两栖类动物的裸露心脏能够诱导出心肌收缩[2]。但由于当时技术条件的限制,这一实验发现未能得到重视和充分的利用。上世纪九十年代以来,心脏电生理学和超声医学界开始重新尝试采用超声波进行心脏的起搏治疗。1991年,Richard 等[3]发表论文提出超声波具有起搏作用。1991~1994年Dalecki和Delius等报告证实,采用高强度单脉冲超声波,当脉冲波宽度为数个毫秒,超声波脉冲峰值强度大于5MPa时就能够对心脏的功能产生确切的生物学效应,其中包括导致心室早搏和主动脉压力的减低。与此同时,他们发现上述超声波生物学效应不仅能在两栖爬行类动物的心脏诱导出来,还能在哺乳动物(如:猪和狗)心脏上诱导出来。其他学者重复了上述实验过程并获得了相同的实验结果[4-9];研究同时发现,尽管超声造影剂流动于毛细血管内,注射超声造影剂仍然能够增强起搏效应。
1.2 现有研究已经证实,采用超声波对组织细胞进行辐照时,超声波导致的空化和冲流过程可使被辐照组织细胞壁和质膜等被击穿,产生可逆或不可逆的小孔,即超声“声孔效应” (sonoporation)[10]。声孔效应是超声波辐照在生物体内最直接的效应表现。有学者在实验中观察到了两种声孔效应,即可修复性声孔效应和致死性声孔效应,这两种效应是同一机制、作用程度不同的两种表现形式[11-12]。超声造影剂存在环境中进行超声波辐照可使声孔效应更为明显。造影剂浓度低时表现为可修复性声孔效应;当辐照时间延长或造影剂浓度增大时,细胞膜上发生的声孔无法修复即致死性声孔效应。空化阈值是指导致空化效应发生的最低超声波强度值,当辐照强度低于瞬态空化阈值时,声孔效应由微束产生;高于瞬态空化阈值时,声孔效应则在不均一的微泡萎陷时产生。声孔效应的存在将改变细胞膜的通透性,并有可能导致心肌细胞膜离子通道状态发生改变。有研究表明膜通道功能改变多发生在空化效应稳定之前,即一旦空化效应稳定,膜通道功能将会相对稳定。
1.3 上世纪八十年代以来, Forester等[13]采用963kHz超声波发射频率,强度为0.25、0.5、1.0、2.0W/cm2的连续超声波刺激大鼠离体心脏乳头肌,在不同的电刺激频率下发现心肌收缩力增强现象,且收缩的最大速度与超声波辐照强度呈线性相关。同期研究证实心肌细胞的动作电位第3相延长,心肌细胞环境中Ca2+离子浓度改变与心肌细胞的肌力改变相关。已有基础实验研究发现超声波辐照可导致正性和负性的心肌细胞肌力改变,正性肌力作用仅发生在大约20%的被超声波辐照心肌,其正性肌力增加幅度可达到18%。这提示不同的超声波辐照参数设置,可能会导致不同程度和方向的心肌肌力变化。
1.4 超声波辐照导致心脏整体功能和血流动力学改变的研究结果尚存争议。2000年Greenberg曾报告采用1MHz和2W/cm2强度超声波辐照鼠离体心脏15分钟,未能诱导产生确切的血流动力学改变,左心室压力在不同超声波辐照观察时相(每间隔5分钟)均未发生明显变化[14-15]。但是,2006年Kuma等[16]采用1MHz高强度连续波超声波辐照豚鼠心脏发现,辐照后左心室收缩压力和主动脉血流量明显增加,同时左心室舒张末期压力明显减低。这进一步提示不同的超声波辐照参数设置将会诱导产生不同的左心室整体功能改变。
1.5 我们的第一阶段前期预实验研究结果提示,在单纯治疗剂量超声波辐照和治疗剂量超声波辐照联合超声造影剂并未导致11只比格犬开胸动物模型在显微镜和电子显微镜下出现明显的心肌细胞和血管损伤,部分心室壁节段心肌径向应变出现了增强现象[17-18],见图1和图2。 第二阶段预实验结果进一步证实,采用诊断剂量超声波联合超声造影剂辐照6只比格犬开胸模型导致左心室心内膜下和心外膜下心肌周向应变均有显著增强,其中心内膜下心肌周向应变值明显高于心外膜下心肌周向应变值。推论诊断剂量超声波辐照联合超声造影剂微泡能够加大左心室心肌形变,可能具有正性肌力作用[19],见图3。
1.6 我们前期基础实验研究采用超声心动图组织多普勒成像进行电刺激蛙骨骼肌机械收缩观察已经确定,采用超声心动图组织多普勒成像技术能够准确观察到电极位点局部骨骼肌结构及其肌力状态变化[20],见图4。
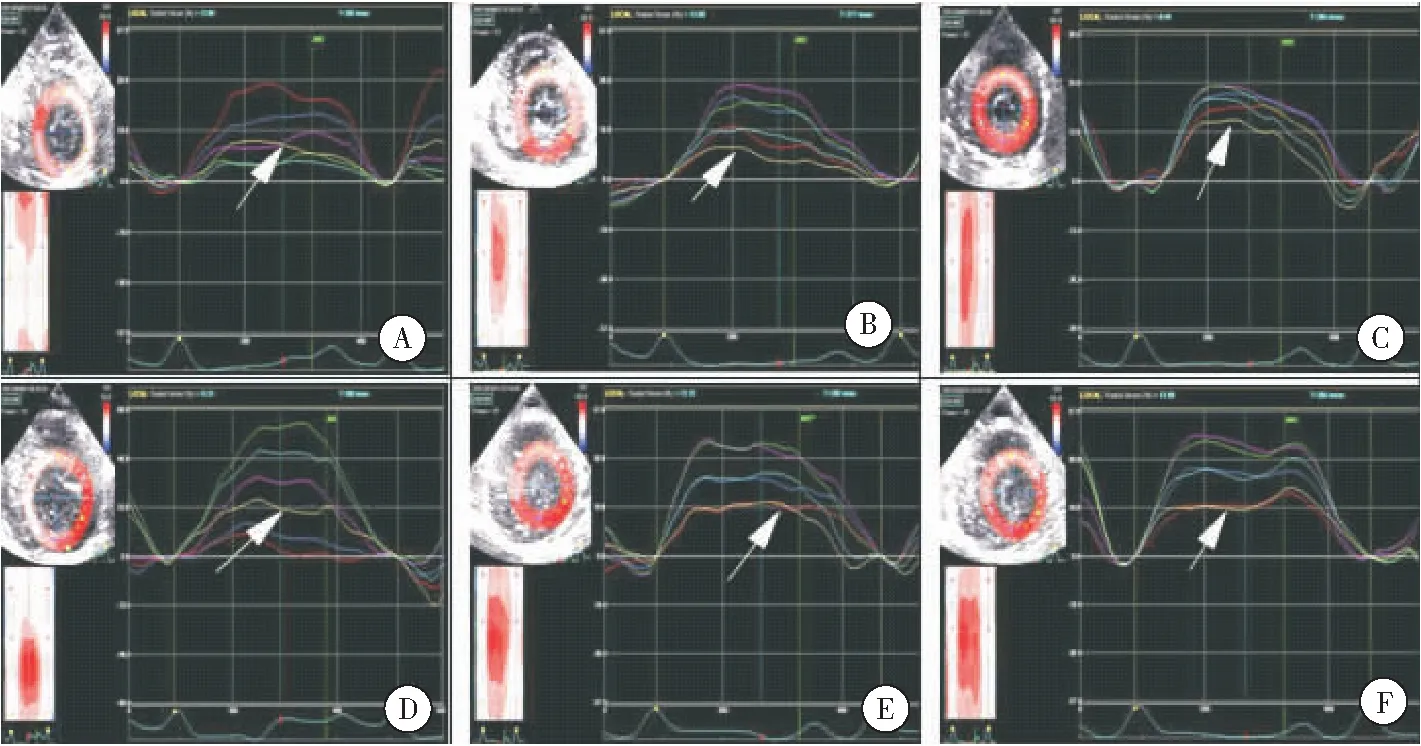
图1第一阶段Beagle犬预实验结果(n=11)
Figure1ThefirstphasestudyresultsofpilotexperimentonBeaglemodels
注:各种状态二尖瓣水平前间隔径向应变—时间曲线:可见(图中箭头所示黄色曲线)在各状态较基础水平径向应变有一增大趋势,其中在超声波辐照造影后即刻、20min、40min及60min组差异有统计学意义(P<0.05);A.基础状态,B.空白对照组,C.造影后即刻组,D.造影后20min组,E.造影后40min组,F.造影后60min
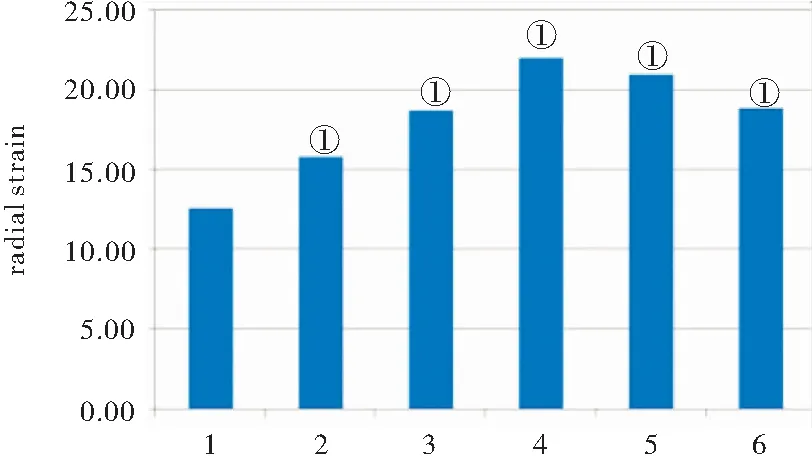
图2 第一阶段Beagle犬预实验结果(n=11)
Figure2ThefirstphasestudyresultsofpilotexperimentonBeaglemodels
注:各种状态二尖瓣水平前室间隔径向峰值应变(1:基础状态,2:空白对照组(超声波辐照无造影剂),3:超声波辐照造影后即刻组,4:超声波辐照造影后20min组,5:超声波辐照造影后40min组,6:超声波辐照造影后60min组)。Radial strain: 径向应变。与基础状态比较,①P<0.05

图3第二阶段Beagle犬预实验结果(n=6)
Figure3ThesecondphasestudyresultsofpilotexperimentonBeaglemodels
注:左心室超声波辐照和超声造影微泡干预状态心内膜下心肌和心外膜心肌峰值周向应变比较, 差异有统计学意义(P<0.05);baseline:基础状态,irradiate:超声辐照5min,contrast:注射造影剂后辐照5min,contrastzomin:注射造影剂后20min

图4超声组织多普勒成像观测骨骼肌电机械兴奋
Figure4UltrasonictissueDopplerimagingmappingtheskeletalmuscleelectro-mechanicalactivation
注:A. 红色箭头指超声心动图组织多普勒成像显示刺激电极位置和骨骼肌收缩初始速度改变一致;B. M型组织多普勒取样线通过刺激电极处,分别取样发放电脉点位的骨骼肌组织运动速度和时间参数测量方法。 t: 电机械延迟时间; Tm:骨骼肌收缩持续时间
2 超声波辐照诱导产生心肌肌力改变的现有实验结论
2.1 采用超声波辐照能够改变心肌细胞的电兴奋过程。
2.2 采用超声波辐照可能有两个相反的肌力作用:既可增强心肌细胞的收缩功能,也有可能减低心肌细胞的收缩功能。目前,产生超声波正性肌力作用的机制和辐照参数条件尚不清楚,亟需应用先进的细胞电生理观测技术进一步研究超声波辐照正性肌力作用在心肌细胞分子水平的可能机制,确定产生正性肌力的必要超声波辐照参数条件。
2.3 采用超声波辐照能否改变离体心脏整体功能和血流动力学状态存在不同的研究结果和结论,这一问题的存在与产生正性肌力作用的超声波辐照条件不明确有关。
2.4 超声波辐照联合超声造影剂微泡能够增强左心室心肌形变,具有正性肌力作用,其作用机制有待进一步加以明确。
3 超声波辐照诱导产生心肌肌力改变机制的理论解释和推论
3.1 较高强度超声波传播过程中导致组织快速振动将产生瞬时负压冲流和空化效应及其导致的心肌细胞膜瞬间穿孔,有可能导致心肌细胞膜的通透性增加[21-22]。
3.2 超声波通过纵向振动波的传导和组织内部声压的增高能够造成组织的快速振动和心肌组织的被动延伸或拉长从而导致细胞膜电位变化。心肌组织在舒张期的拉伸已经被证实能够导致对机械拉伸敏感的心肌细胞膜离子通道的功能状态发生改变从而造成心肌细胞膜的除极过程。但是在实际应用中,超声波诱导心肌细胞除极的机制仍然不清。尽管超声脉冲波的宽度与组织被拉伸的时间长度相等。但是进一步研究发现,超声波导致的心肌细胞位移程度仍然不足以导致由心肌细胞被动拉伸所可能触发的细胞生物电流改变并最终导致心肌细胞膜的有效除极:例如发射频率1MHz、声压1.8atm/W和脉冲波宽度15μm的超声波仅能够导致18nm的心肌位移。该拉伸长度不足以导致毫米级拉伸才能够导致心肌细胞生物电效应[23]。因此,超声波辐照导致心肌细胞除极的机制尚待进一步研究予以明确。
3.3 国外有学者推测超声波导致心肌除极的机制既不是超声脉冲波宽度导致心肌细胞位移造成除极,也不是超声波的机械纵波声压导致心肌细胞除极。较高的超声波辐射声力在心肌细胞除极过程中发挥了主要作用,最终导致细胞膜的除极和电兴奋信号的产生和传播。因此,在超声波脉冲诱导的心室电除极过程中,超声波声学辐射力可能起到了重要作用[24]。但上述推论目前缺乏细胞分子水平的证据。
3.4 当超声波束撞击心脏时,心肌组织内部的超声波声学辐射力与心肌组织所能够吸收的声能成正比。心肌组织吸收的超声波声能越高,心肌组织所接受的超声波声学辐射力越大。决定心肌组织吸收超声波声能大小的主要因素包括心肌组织的声能吸收系数和超声波的声束宽度两大部分。调节超声波的频率等参数将同时改变超声波束宽度和影响特定心肌组织的声能吸收系数。
3.5 低频高强度超声波辐照有可能通过改变心肌细胞膜通透性和离子通道功能状态,进一步导致肌力相关离子的浓度分布发生变化。已知心肌收缩力增强可表现为细胞胞浆网内Ca2+增多和心肌收缩功能及张力增强,从而导致心肌细胞收缩力改变[25-28]。
3.6 尽管有学者认为超声波的热效应不是导致超声波辐照心脏生物学效应的主要机制;但也有研究结果提示,超声波的热效应仍有可能在诱导心肌细胞的除极和增强心肌收缩力的过程中发挥了一定的作用[29]。
4 现有超声波辐照诱导产生心肌肌力改变相关研究的局限性
4.1 缺乏直接的超声波辐照环境心肌细胞膜通透性和离子通道功能改变证据以及心肌细胞内肌力相关离子分布和浓度改变证据。缺乏足够的超声波辐照声能相关细胞分子水平心肌肌原纤维功能改变证据。超声波辐照诱导心肌细胞正性肌力作用机制和产生条件不清。
4.2 缺乏足够的超声波辐照声能效应与局部和整体心肌功能状态改变的时空关联关系证据。
4.3 除我们前期预实验研究外,未见系统性的超声造影剂存在环境超声波辐照与心肌肌力改变的研究结果和结论。
4.4 已有的超声波辐照诱导左心室局部和整体血流动力学状态和收缩功能研究结果存在矛盾。未能建立诱导产生心肌正性肌力效应的超声波辐照参数设置必要条件和最优化条件。
5 超声波辐照诱导产生心肌肌力改变的进一步假设
5.1 超声波辐照所诱导产生心肌细胞膜通透性和肌力相关离子通道功能改变能够导致心肌细胞内的肌力相关离子分布和浓度发生改变,这最终导致单个心肌细胞和整体心肌细胞组织的收缩功能状态发生改变,有可能导致正性的心肌局部和整体功能改变。
5.2 超声波辐照导致的超声造影剂微泡破裂能够有助于提高心肌细胞膜通透性并增强上述超声波声能效应。
6 超声波辐照诱导产生心肌肌力改变研究的科学价值和潜在临床价值
6.1 有可能为建立一种全新的无创性临床心力衰竭物理治疗方法提供基础实验数据并揭示超声波辐照正性肌力作用的机制。
6.2 有可能为特定病因或特定阶段的临床心力衰竭患者提供一种非药物的即时正性肌力增强技术手段。
7 小结与展望
超声波辐照能在特定条件下产生心脏正性肌力作用。若能系统性证实超声波辐照具有心脏正性肌力作用,系统性揭示和阐明其可能存在的细胞分子机制,在此基础上通过关联分析确立诱导产生正性肌力效应的超声波辐照参数必要条件和最佳条件,将开辟一个全新的心血管疾病治疗学研究领域并有助于推动心血管疾病非药物治疗学向前发展。因此,开展该领域的创新性研究可能产生的衍生成果对心血管病学临床和基础研究均具有十分重要的科学和实用价值。
【参考文献】
[1]卫生部心血管病防治研究中心.中国心血管病报告2008-2009[M].中国大百科全书出版社,2009,:9.
[2]Harvey EN. The effect of high frequency sound waves on heart muscle and other irritable tissues[J]. Am J Physiol, 1929,91:284-290.
[3]Richard S,Meltzer MD, Karl Q,etal. Therapeutic Cardiac Ultrasound[J]. J Am Coll Cardiol,1991,67:422-424.
[4]Dalecki D, Keller B, Cartensen E,etal. Thresholds for premature ventricular contractions in frog hearts exposed to lithotripter[J]. Ultrasound Med Biol,1991, 17(4):341-346.
[5]Dalecki D, Keller B, Raeman C,etal. Effects of pulsed ultrasound on the frog heart: thresholds for changes in cardiac rhythm and aortic pressure[J]. Ultrasound Med Biol, 1993,19(5):385-390.
[6]Daleki D, Raeman C, Carstensen E. Effects of pulsed ultrasound on the frog heart: an investigation of heating as a potential mechanism[J]. Ultrasound Med Biol, 1993,19(5):391-398.
[7]Delius M, Hoffmann G, Steinbeck G,etal. Biological effects of shock waves: Induction of arrhythmia in piglet hearts[J]. Ultrasound Med Biol,1994,20:279-285.
[8]MacRobbie AG, Raeman CH, Child SZ,etal. Thresholds for premature contractions in mouse hearts exposed to pulsed ultrasound[J]. Ultrasound Med Biol, 1997,23(5):761-765.
[9]Towe BC, Rho R. Ultrasonic Cardiac Pacing in the Porcine Model[J]. IEEE transactions on biomedical engineering,2006, 53(7):1446-1448.
[10] Clarke PR, Hill CR. Physical and chemical aspects of ultrasonic disruption of cells[J]. J Acoust Sot Am,1970,47:649-653.
[11] Bazan-Peregrino M, Arvanitis CD, RifaiB,etal. Ultrasound induced cavitation enhances the delivery and therapeutic efficacy of anoncolytic virusinan in vitro model[J]. J Control Release,2012,2:235-242.
[12] Ward M, Wu J, Chiu JF. Experimental study of the effects of Optison concentration on sonoporation in vitro[J]. Ultrasound Med Biol,2000,26:1169-1175.
[13] Forester GV, Roy OZ, Mortimer AJ. Ultrasound intensity and contractile characteristics of rat isolated papillary muscle[J]. Ultrasound Med Biol 1985,11:951-958.
[14] Dalei D, Keller BB, Raeman CH,etal. Effects of pulsed ultrasound on the frog heart: I. Thresholds for changes in cardiac rhythm and aortic pressure[J]. Ultrasound Med Biol,1993,19:385-390.
[15] Greenberg S, Finkelstein A, Raisman E,etal. Direct ultrasound application had no effect on cardiac hemodynamic performance in a baseline isolated rat heart model[J]. Ultrasound in Medicine & Biology, 2000,26 (2): 315-319.
[16] Kuma F, Ueda N, Ito H,etal. Effects of ultrasound energy application on cardiac performance in open-chest Guinea pigs[J]. 2006 ,70(10):1356-1361.
[17] 苏莉,尹立雪,王志刚.心肌超声造影安全性的实验研究[J].中华超声影像学杂志,2012,21(6):514-520.
[18] 苏莉,尹立雪,王志刚. 心肌超声造影安全性的研究进展[J].中华超声影像学杂志,2011,8(2):537-539.
[19] 李文华,尹立雪. 超声辐照诱导左心室跨壁心肌力学状态变化的实验研究[J].中华超声影像学杂志,2014, 23(4): 333-339.
[20] 孟庆国,尹立雪.蛙腿骨骼肌电机械兴奋的超声标测[J].实用医院临床杂志,2012,5:27-33.
[21] Kohl P,Sachs F. Mechano-electric feedback in cardiac cells[J]. Philosophical Trans Roy Soc A, 2001, 359:1173-1185.
[22] Gu CX,Juranka PF, Morris CE. Stretch-activation and stretch-inactivation of Shaker-IR, a voltage-gated K channel[J]. Biophys J,2001,80(6):2678-2693.
[23] Galler S, Schmitt TL, Pette D. Stretch activation, unloaded shortening velocity, and myosin heavy chain isoforms of rat skeletal muscle fibres[J]. J Physiol (Lond.),1994,478.3: 513-521.
[24] Craelius W. Stretch activated ion channels in ventricular myocytes[J]. Biosci Rep,1995,8(5):407.
[25] Christensen. Mediation of cell volume regulation by Ca++ influx through stretch activated channels. Nature,1987; 330(5):66-68
[26] Morris E, Sigurdson WJ. Stretch inactivated ion channels coexist with stretch activated ion channels[J]. Science,1989,243:807-809.
[27] Wise. Bioinstrumentation and Biosensors[M]. New York: Marcel Dekker, 1991,1-824.
[28] Rudenko A. Saravazan, and S. Emelianov. Acoustic radiation force and streaming induced by focused nonlinear ultrasound in a dissipative medium[J]. J Acoust Soc Am,1996, 99(5):2791-2798.
[29] Dalei D, Raeman CH, Carstensen EL. Effects of pulsed ultrasound on the frog heart: II. An investigation of heating as a potential mechanism[J]. Ultrasound Med Biol, 1993,19:391-398.
