利用光学相干断层扫描血管造影分析PM2.5对小鼠角膜上皮和角膜全层厚度的影响
2018-04-28姜楠刘启韩云李娟杨启晨王亚虹袁晴马明洋叶蕾朱佩文邵毅
姜楠 ,刘启 ,韩云 ,李娟 ,杨启晨 ,王亚虹 ,袁晴,马明洋,叶蕾,朱佩文,邵毅
(1.南昌大学第一附属医院 眼科,江西 南昌 330006;2.厦门大学 眼科研究所,福建 厦门 361102;3.陕西省西安市第四医院 眼科,陕西 西安 710004;4.陕西省西安市环境监测站,陕西 西安 710054)
近年来环境污染引起人们越来越多的关注,许多研究表明环境污染会损害人体健康。PM2.5是评估环境污染中空气污染严重程度的指标之一。PM2.5指的是大气空气动力学中的大气悬浮颗粒,直径>2.5 μm[1]。其主要来自于燃料[2]。复杂复合物燃烧,包括大量的有机物质(如苯二烯和多环芳烃)和大量的无机成分,如硫酸盐、硝酸盐和重金属(如铅和镍)[3]。既往研究表明[4],杭州公共场所的室内灰尘中多环芳烃的浓度占总颗粒物的71.5%,这与PM2.5成分一致。多环芳烃被公认为环境污染物,其有强致癌和诱变特性从而影响人体健康[5]。PM2.5不仅对呼吸系统和心血管系统有害,还能减少人的寿命。眼球最为直接与外界接触的重要器官之一,PM2.5可能直接对其功能产生影响。流行病学和临床研究都指出空气污染对眼表有生物效应。TORRICELLI等做过关于PM2.5对71例司机眼表影响的调查,调查显示该司机的泪膜破裂时间(break-up time,BUT)值比正常人低[6]。CAMARA等人研究火山灰的对眼的影响。组成该污染物的主要成分是PM2.5,研究发现该污染物会引起眼痒、异物感觉、流泪和烧灼等眼部症状,以及一些其他症状,如结膜充血、黏液分泌增多、圆锥角膜肿胀、眼睑肿胀和结膜水肿[7]。笔者前期发现,PM10还可进一步破坏小鼠泪膜稳定性,并影响泪液膜的渗透,从而导致干眼的形成[8]。而PM2.5会导致角膜和结膜上皮细胞的炎症反应,并改变黏液的表达[9],而角膜上皮细胞的自我更新能力对眼表防御系统的完整性至关重要,因此进一步研究其对角膜上皮细胞损害的机制是尤为重要的。本文旨在应用光学相干断层扫描血管造影(optical coherence tomography angiography,OCTA)分析PM2.5对角膜上皮和角膜全层厚度的影响,并讨论PM2.5对角膜上皮影响机制,为PM2.5影响眼表功能提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物随机选取BALB/c小鼠(18~21 g,6~8周龄,雄性)共32只64眼(厦门大学医学院实验动物中心提供),均为无特定病原体(SPF)级实验动物,实验前用裂隙灯显微镜检查所有小鼠眼底,眼前节和眼底部均未发现异常,所有小鼠均生活在标准环境中:室温(25±1)℃,湿度(60±10)%,给予12 h交替规律的明暗周期(早上8点至晚上8点)[10],两组食物及水源相同且充足。本研究经医学院动物伦理委员会批准,且严格遵循《赫尔辛基宣言》,符合医学伦理原则。
1.1.2 PM2.5的采集和滴眼液的制备PM2.5样品由西安环境监测站提供,2015年10月1~31日于西安市超级站,采用武汉天虹仪表有限责任公司的TH16A四通道大气颗粒物智能采样仪,切割粒径为2.5 μm,采用美国产Whatman聚四氟乙烯滤膜进行采样。从上午10∶30到次日上午8∶30,每天进行连续22 h的取样。将采集到的样本用聚四氟乙烯滤膜修剪为1 cm×1 cm,浸润在蒸馏水中,超声振荡3次,每次45 min。经过6层纱布过滤后,样品进行真空冷冻干燥处理,所得到的样品即为PM2.5混悬液,所含物质包括大量可溶的有机物(如苯二烯和多环芳烃)和大量不可溶的无机成分,如硫酸盐、硝酸盐和重金属(如铅和镍),制备PM2.5滴眼液,用无菌PBS稀释PM2.5样品,浓度为5 mg/ml,然后进行超声检测。浓度控制在0.005%的两组眼药水(PM2.5和PBS)中加入保存剂苯扎溴铵。置入4℃冰箱保存备用。
1.2 方法
1.2.1 动物实验方法32只小鼠随机分为实验组(n=16)、对照组(n=16)两组,体重、周龄匹配,双眼为实验眼。实验组采用5 mg/ml的PM2.5滴眼液滴眼,对照组采用PBS滴眼液滴眼,每天4次。利用光学相干断层扫描血管造影技术分别在干预前,干预后第1、4、7、10及14天对两组小鼠角膜上皮和角膜全层厚度进行测量。所有小鼠在第14天数据测量后进行安乐死。
1.2.2 检查方法所有实验小鼠使用Angio Vue OCTA系统(Optovue,Inc.Fremont,CA)视网膜成像(Angio Retina模式)上的分频幅去相关血管成像算法进行成像,并使用前段透镜光学适配器镜片。每次扫描以横向分辨率为15 μm,轴向分辨率为5 μm,光束宽度为22 μm,光源以840 nm为中心进行。该仪器捕获后续的横断面扫面(B-扫描),包含以每秒70 000次的慢性横向的304×304 A扫描,其大约在3~4 s内构建3D扫描[11],因为OCTA系统默认的聚集是针对视网膜,所以在测量角膜全层及角膜上皮厚度时要关闭自动聚焦功能[12]。收集所得数据,并利用两种分区标准,利用系统软件将角膜划分为17个区域(以右眼的分区名称命名),17分区法中角膜中心区域为角膜中央2 mm直径范围,内环、外环分别为角膜中央5 mm、6 mm直径范围。内环、外环各区域分别再划分为上方(S)、鼻上(SN)、鼻侧(N)、鼻下(IN)、下方(I)、颞下(IT)、颞侧(T)及颞上(ST)8个方位(见图1),测量各区域角膜上皮和角膜全层厚度。得到A和B各32眼的角膜上皮厚度数据,各组左眼数据经过翻转后与右眼对应叠加。测得数据选择具有最高信号强度指数的扫描图进行分析。角膜厚度平均值指的是17个区域角膜厚度相加后除以17后的厚度。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,两组同一时间的厚度比较采用t检验,不同时间的厚度均数比较采用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 PM2.5混悬液滴眼对小鼠角膜上皮不同区域厚度的影响
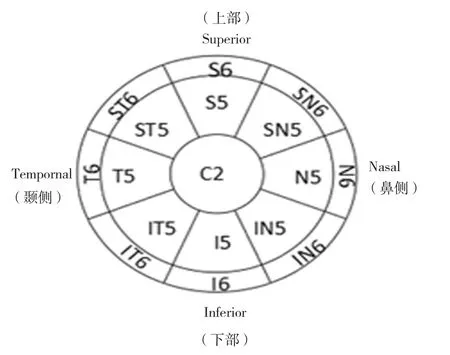
图1 角膜上皮和角膜全层厚度的测量图
两组不同时间的角膜上皮各区域厚度,采用重复测量设计的方差分析,结果:①不同组间角膜上皮厚度比较,差异有统计学意义(FC2=19.352,FS5=21.261,FSN5=17.665,FN5=18.694,FIN5=16.614,FI5=19.123,FIT5=17.617,FT5=17.432,FST5=19.632,FS6=19.122,FSN6=18.315,FN6=19.228,FIN6=21.734,FI6=20.134,FIT6=17.231,FT6=20.137,FST6=21.714 ;PC2=0.034,PS5=0.022,PSN5=0.031,PN5=0.023,PIN5=0.028,PI5=0.038,PIT5=0.021,PT5=0.032,PST5=0.042,PS6=0.035,PSN6=0.036,PN6=0.037,PIN6=0.033,PI6=0.037,PIT6=0.028,PT6=0.039,PST6=0.043);②不同时间的角膜上皮厚度比较,差异有统计学意义(FC2=29.313,FS5=26.321,FSN5=27.612,FN5=28.672,FIN5=26.984,FI5=29.124,FIT5=27.625,FT5=32.412,FST5=29.612,FS6=29.198,FSN6=28.912,FN6=32.122,FIN6=31.732,FI6=30.133,FIT6=27.222,FT6=32.142,FST6=32.535 ;PC2=0.031,PS5=0.021,PSN5=0.032,PN5=0.023,PIN5=0.022,PI5=0.018,PIT5=0.023,PT5=0.022,PST5=0.022,PS6=0.025,PSN6=0.026,PN6=0.031,PIN6=0.023,PI6=0.031,PIT6=0.021,PT6=0.036,PST6=0.023);③两组不同区域的角膜上皮厚度变化趋势均有差异(FC2=9.312,FS5=7.351,FSN5=7.422,FN5=8.614,FIN5=6.164,FI5=9.234,FIT5=7.455,FT5=8.474,FST5=9.322,FS6=9.116,FSN6=8.544,FN6=9.642,FIN6=11.715,FI6=10.147,FIT6=11.222,FT6=10.107,FST6=8.172;PC2= 0.036,PS5=0.029,PSN5=0.037,PN5=0.033,PIN5=0.039,PI5=0.038,PIT5=0.033,PT5=0.035,PST5=0.029,PS6=0.039,PSN6=0.029,PN6=0.038,PIN6=0.029,PI6=0.039,PIT6=0.029,PT6=0.039,PST6=0.033)。干预第1天两组间各区域角膜上皮厚度比较,差异无统计学意义(均P>0.05),第4天起,与对照组比较,实验组角膜上皮下部厚度的IT5、I5、IN5、IT6、I6及 IN6区域增厚(均P<0.05),第7天起,与对照组比较,实验组小鼠角膜上皮厚度所有区域均增厚(均P<0.05)。第10天、第14天,与对照组比较,实验组小鼠角膜上皮厚度各个区域均增厚(均P<0.05)。见图2。
2.2 不同时间PM2.5混悬液滴眼对小鼠角膜不同区域全层厚度的影响
两组不同时间各区域角膜全层厚度,采用重复测量设计的方差分析,结果:①不同组间不同区域角膜全层厚度比较,差异有统计学意义(FC2=8.312,FS5=9.785,FSN5=7.376,FN5=9.125,FIN5=7.963,FI5=8.742,FIT5=9.664,FT5=8.562,FST5=9.617,FS6=7.617,FSN6=6.641,FN6=7.543,FIN6=8.123,FI6=7.542,FIT6=6.532,FT6=8.655,FST6=8.724;PC2=0.017,PS5=0.022,PSN5=0.019,PN5=0.023,PIN5=0.018,PI5=0.027,PIT5=0.021,PT5=0.019,PST5=0.026,PS6=0.022,PSN6=0.015,PN6=0.019,PIN6=0.024,PI6=0.016,PIT6=0.018,PT6=0.025,PST6=0.023);②不同时间的区域角膜全层厚度比较,差异有统计学意义(FC2=11.312,FS5=12.792,FSN5=11.387,FN5=10.512,FIN5=13.612,FI5=14.678,FIT5=12.153,FT5=13.322,FST5=12.652,FS6=11.631,FSN6=14.961,FN6=12.152,FIN6=14.715,FI6=11.123,FIT6=11.231,FT6=13.435,FST6=11.712;PC2=0.021,PS5=0.032,PSN5=0.031,PN5=0.034,PIN5=0.028,PI5=0.038,PIT5=0.041,PT5=0.035,PST5=0.026,PS6=0.041,PSN6=0.025,PN6=0.037,PIN6=0.033,PI6=6.036,PIT6=0.026,PT6=0.029,PST6=0.033);③两组的角膜全层厚度变化趋势均有差异(FC2=6.431,FS5=7.734,FSN5=7.642,FN5=7.612,FIN5=6.532,FI5=5.175,FIT5=7.542,FT5=6.626,FST5=6.675,FS6=5.093,FSN6=6.516,FN6=7.647,FIN6=5.841,FI6=6.357,FIT6=6.741,FT6=5.273,FST6=5.859;PC2=0.037,PS5=0.015,PSN5=0.017,PN5=0.041,PIN5=0.015,PI5=0.024,PIT5=0.021,PT5=0.023,PST5=0.012,PS6=0.022,PSN6=0.025,PN6=0.028,PIN6=0.019,PI6=0.012,PIT6=0.018,PT6=0.013,PST6=0.022)。干预第1和4天两组间区域角膜厚度比较差异无统计学意义(均P>0.05),第7天起,与对照组比较,实验组小鼠角膜全层下部厚度的C2、IT5、I5、IN5、IT6、I6及 IN6区域增厚(均P<0.05)。第10和14天,与对照组比较,实验组小鼠角膜全层厚度各个区域均增厚(均P<0.05)。见图3。
2.3 两组不同时间整体角膜上皮厚度和角膜全层厚度比较
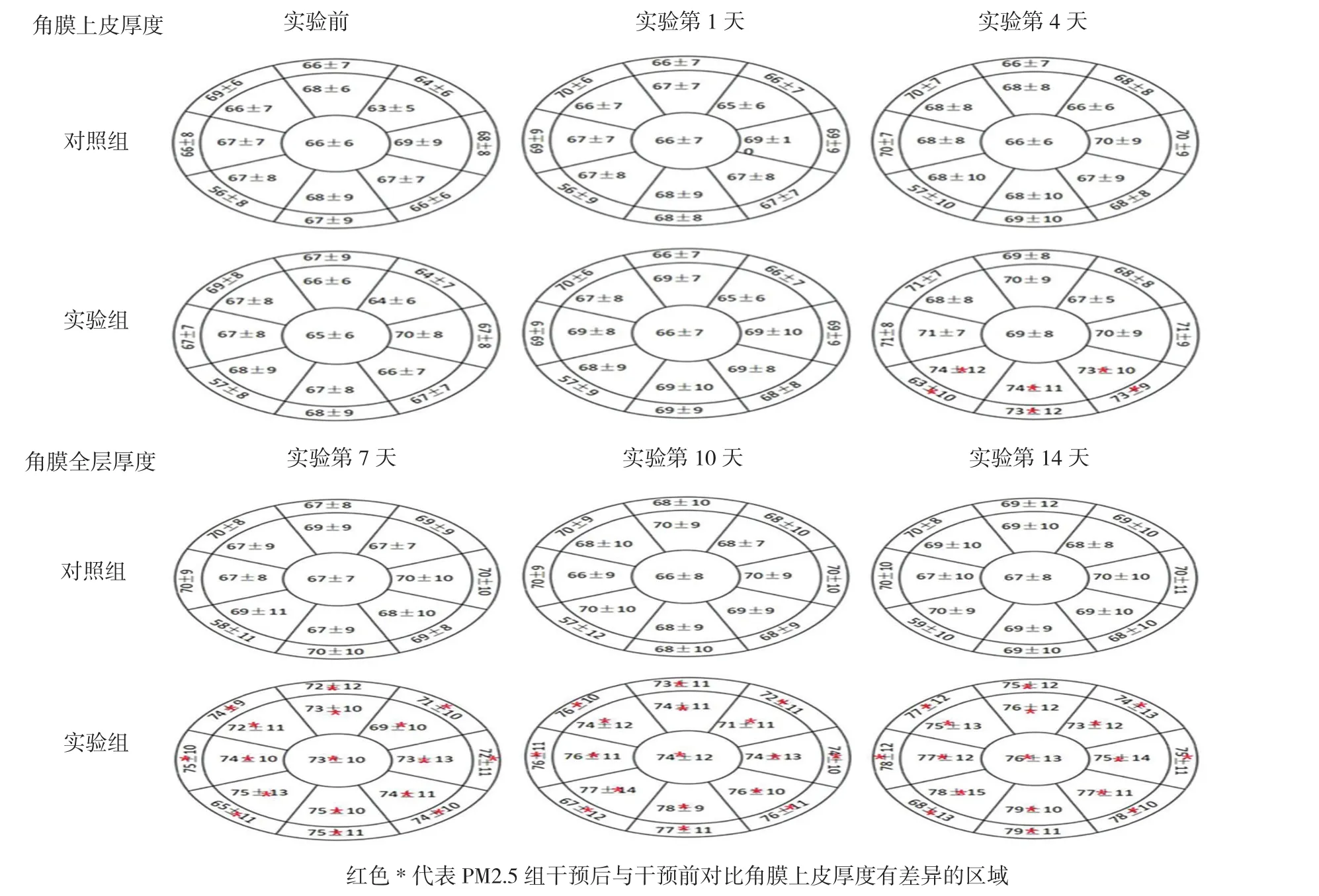
图2 从第4天起,随着干预时间延长,角膜上皮下方各区最先增厚,其他区域随后增厚
两组不同时间角膜上皮厚度和角膜全层厚度的各区域平均值,采用重复测量设计的方差分析,结果:①不同组间角膜上皮厚度和角膜全层厚度比较,差异有统计学意义(F上皮=19.89,F全层=8.43;P上皮=0.035,P全层=0.015);②不同时间角膜上皮厚度和角膜全层厚度比较,差异有统计学意义(F上皮=29.162,F全层=11.424;P上皮=0.026,P全层=0.032);③两组的角膜上皮和角膜全层厚度变化趋势均有差异(F上皮=8.321,F全层=6.543 ;P上皮=0.038,P全层=0.019)。见表1、2。
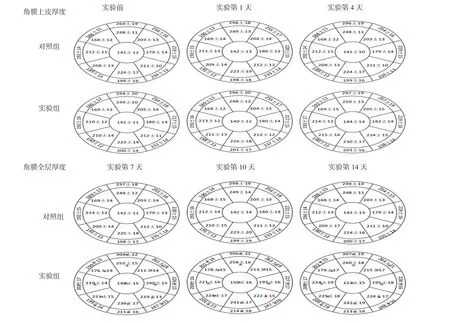
图3 从第7天起,随着干预时间延长,角膜全层厚度也变厚,且中央和下方各区最先增厚,随后其他区域增厚
表1 两组不同时间的角膜上皮厚度比较 (mm,±s)
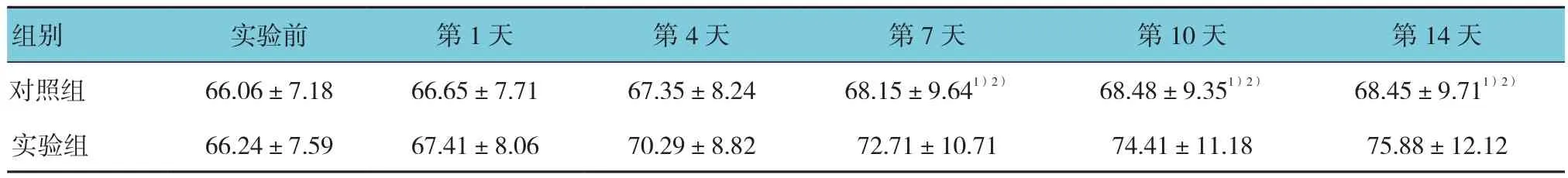
表1 两组不同时间的角膜上皮厚度比较 (mm,±s)
注:1)与实验组比较,P <0.05;2)与实验前比较,P <0.05
组别 实验前 第1天 第4天 第7天 第10天 第14天对照组 66.06±7.18 66.65±7.71 67.35±8.24 68.15±9.641)2) 68.48±9.351)2) 68.45±9.711)2)实验组 66.24±7.59 67.41±8.06 70.29±8.82 72.71±10.71 74.41±11.18 75.88±12.12
表2 两组在不同时间角膜全层厚度比较 (mm,±s)
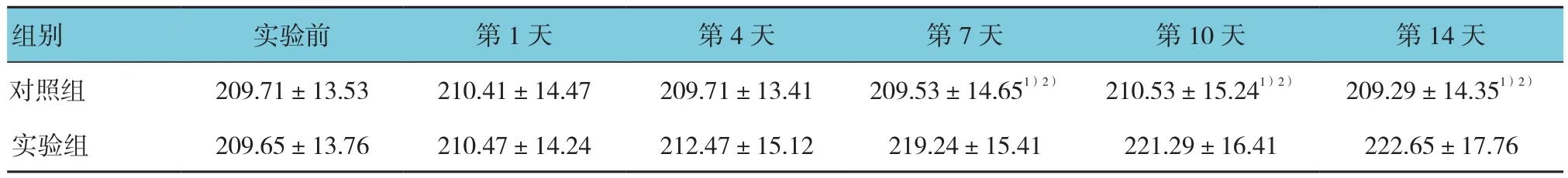
表2 两组在不同时间角膜全层厚度比较 (mm,±s)
注:1)与实验组比较,P <0.05;2)与实验前比较,P <0.05
组别 实验前 第1天 第4天 第7天 第10天 第14天对照组 209.71±13.53 210.41±14.47 209.71±13.41 209.53±14.651)2) 210.53±15.241)2) 209.29±14.351)2)实验组 209.65±13.76 210.47±14.24 212.47±15.12 219.24±15.41 221.29±16.41 222.65±17.76
3 讨论
近年来,OCTA已被成功地用于检查有角膜病理特征患者的异常角膜新生血管[11]。OCTA是一种非侵入性成像技术,通过检测相位变化或反射率变化以检测血管内血液流动,还能同时获得周围组织的光学相干断层扫描(optical coherence tomography,OCT)影像[12],因此应用OCTA可以检测角膜上皮和角膜全层各区域厚度的改变。
角膜上皮位于角膜的最外层,容易受到各种损伤。研究表明,紫外线辐射和防腐剂等多种因素可以通过诱导DNA损伤从而损害角膜上皮[13]。PM2.5是复杂的化学和生物物质混合物,含有多环芳烃和离子等,该物质不仅吸附在PM2.5表面,还深入到其中心结构[14],且在室内粉尘引起的毒性中起着至关重要的作用。PM2.5中还富含Pb、Al和MN等金属,且PM2.5对人体的影响与该金属对人体的影响相一致。眼表是直接与外部环境接触的,因此外部环境的变化将会对眼部微小环境产生重大的影响。以前的研究表明,PM2.5可以在许多细胞类型中诱发DNA损伤。近年来有研究表明,PM2.5暴露可诱导角膜上皮细胞DNA损伤和细胞衰老,进而损害角膜上皮修复再生能力。γ-H2AX是H2A蛋白家族的一种变异体,是DNA损伤反应的重要调控器。其是由丝氨酸139在DNA损伤后的1~3 min在激酶的催化作用下磷酸化形成。γ-H2AX是DNA修复中重组和定位作用的第1个蛋白,因此,细胞中γ-H2AX含量增高可以间接反应细胞中DNA损伤从而修复活跃。有研究表明,利用免疫荧光技术检测暴露在PM2.5后的角膜上皮细胞中γ-H2AX发现其含量上升,说明角膜上皮细胞暴露在PM2.5后影响其DNA损伤后的修复,从而诱发角膜上皮细胞衰老,衰老细胞通过分泌炎症细胞因子和产生氧化应激作用对邻近的细胞产生衰老效应[15],使得损害范围增大。角膜上皮干细胞也称为角膜缘干细胞,是位于角膜缘基底上皮层的干细胞。许多研究表明,角膜上皮干细胞是角膜上皮细胞增殖的来源,对角膜上皮再生非常重要。因此,PM2.5导致角膜上皮再生不足,也可能是通过诱导角膜上皮干细胞衰老进而加重角膜上皮的损害。而且衰老的角膜经历了结构的改变,更容易受到感染[16],从而形成恶性循环。PM2.5影响角膜上皮细胞和角膜上皮干细胞DNA损伤机制可能通过诱导角膜上皮细胞产生活性氧进一步发生氧化应激作用而产生的[17]。活性氧是含氧的化学反应分子,是正常细胞代谢的副产物,其在病理生理条件下会增加,从而导致活性氧生成和细胞内防御机制失衡,即氧化应激作用。活性氧会损害细胞结构,许多研究表明,活性氧的形成是微粒物质在不同类型细胞中发挥毒性作用的一种关键机制[18]。而PM2.5可诱导角膜上皮细胞产生活性氧从而对自身产生损害[17],抑制氧化应激作用可以有效地减缓这一损害。且该损害与PM2.5浓度有关。2013年TAU等[9]在研究中发现,当PM2.5浓度低至0.5 μg/ml时,角膜上皮细胞的存活时间也会降低,本研究中PM2.5浓度为5 mg/ml,对角膜上皮的影响为促进其厚度增加。还有研究表明,微粒对人体的影响与该微粒自身的直径有关[19],根据其大小,PM存放在于不同的呼吸道水平。通常情况下,大直径的微粒通过鼻纤毛和黏液被过滤,直径>10 μm的微粒可以渗透到肺和支气管肺泡结构。直径>2.5 μm的微粒有更大渗透能力。其可能渗透到正常的支气管壁,且干扰肺的气体交换[20]。该微粒最终会渗透到人的血管内,通过血液循环可能影响身体的其他部位[21],使得PM2.5危害更大。该规律与PM2.5对角膜上皮细胞的影响一致,超细颗粒物(DEPs)指环境空气中空气动力学当量直径≥0.1 μm的颗粒物,是PM2.5中的一种,与暴露在DEPs中的角膜上皮细胞比较,暴露在PM2.5中的角膜上皮细胞的细胞毒性更强[19],这可能是由于颗粒直径不同造成,PM2.5的直径比DEPs要大,因此,PM2.5可能携带更多有害化学物质。
近年来,也有研究表明PM2.5可破坏泪膜稳定性,从而引起眼部的各种不适,即引起干眼综合征(dry eye syndrome,DES)[22],DES将会进一步造成角膜的严重损害(侵蚀和继发感染等),甚至导致视力丧失[23],干眼引起角膜上皮和角膜全层厚度增加,可能与其通过改变角膜上皮不同细胞密度和角膜结构有关。研究表明,干眼会引起角膜上皮中不同细胞的密度发生变化。可引起中央区角膜上皮细胞,包括表层鳞状上皮细胞、翼状上皮细胞和上皮基底层细胞的细胞密度下降[24],但近年来关于干眼对角膜结构的影响仍有争议,李晶等人使用高渗盐水点眼制作小鼠干眼模型发现,实验组小鼠的角膜上皮层基底部细胞缺失,分层减少,出现空洞,角膜上皮层厚度减少,这可能与PM2.5诱导角膜上皮细胞发生氧化应激反应触发的自噬现象[25]有关。而FABIANI等[26]用人工气候室制作小鼠干眼模型,发现干眼小鼠模型角膜上皮层厚度增加。李娟等[8]在研究中发现,干眼小鼠模型角膜上皮中翼状细胞及基底细胞排列紊乱,细胞层数开始增多,上皮厚度增加。本研究发现实验组小鼠角膜上皮和角膜全层厚度均随干预时间增加而增加。角膜上皮下部各区域厚度首先增加,随后其他区域厚度增加,角膜全层中央和下部各区域厚度首先增加,随后其他区域厚度增加。且角膜全层增厚速度慢于角膜上皮增厚的速度,提示PM2.5导致的干眼可能引起角膜侵蚀性损害,引起角膜除上皮层外其他层的细胞损伤。而角膜上皮厚度和角膜全层厚度的各区域平均值变化和全层厚度变化是一致的,进一步证明PM2.5影响角膜的变化趋势。
综上所述,PM2.5能引起小鼠角膜上皮和角膜全层厚度增厚,且角膜上皮增厚的速度大于角膜全层增厚的速度,这可能与PM2.5引起角膜上皮细胞和角膜上皮干细胞的衰老反应,衰老细胞分泌炎症细胞因子和产生氧化应激作用从而改变角膜上皮厚度有关,笔者将进一步研究其增厚的原因是否与其他因素有关,是否与角膜上皮不同细胞密度的改变或者角膜结构改变有关。本研究也为PM2.5导致的干眼影响角膜上皮厚度的现象提供依据。同时在其预防和治疗上有一定意义。
参 考 文 献:
[1] FENG C, LI J, SUN W, et al. Impact of ambient fine particulate matter (PM2.5) exposure on the risk of influenza-like-illness: a time-series analysis in Beijing, China[J]. Environ Health, 2016,15(1): 17.
[2] LIU D, LI J, CHENG Z, et al. Sources of non-fossil-fuel emissions in carbonaceous aerosols during early winter in Chinese cities[J].Atmospheric Chemistry & Physics, 2017, 17(18):1-25.
[3] JEONG CH, WANG JM, EVANS GJ. Source apportionment of urban particulate matter using hourly resolved trace metals,organics, and inorganic aerosol components[J]. Atmospheric Chemistry & Physics, 2016: 1-32. DOI: 10.5194/acp-2016-189.
[4] LU H, ZHU L, CHEN S. Pollution level, phase distribution and health risk of polycyclic aromatic hydrocarbons in indoor air at public places of Hangzhou, China[J]. Environ Pollut, 2008, 152(3):569-575.
[5] MISHRA N, AYOKO G A, MORAWSKA L. Atmospheric polycyclic aromatic hydrocarbons in the urban environment:Occurrence, toxicity and source apportionment[J]. Environ Pollut,2016, 208 (Pt A): 110-117.
[6] TORRICELLI A A, NOVAES P, MATSUDA M, et al. Correlation between signs and symptoms of ocular surface dysfunction and tear osmolarity with ambient levels of air pollution in a large metropolitan area[J]. Cornea, 2013, 32(4): 11-15.
[7] CHANG C J, YANG H H, CHANG C A, et al. Relationship between air pollution and outpatient visits for nonspecific conjunctivitis[J]. Invest Ophth Vis Sci, 2012, 53(1): 429-433.
[8] LI J, TAN G, DING X, et al. A mouse dry eye model induced by topical administration of the air pollutant particulate matter 10[J].Biomed Pharmacother, 2017, 96(12): 524-534.
[9] TAU J, NOVAES P, MATSUDA M, et al. Diesel exhaust particles selectively induce both proinflammatory cytokines and mucin production in cornea and conjunctiva human cell lines[J]. Invest Ophth Vis Sci, 2013, 54(7): 4759-4765.
[10] YU Y, ZOU J, HAN Y, et al. Effects of intravitreal injection of netrin-1 in retinal neovascularization of streptozotocin-induced diabetic rats[J]. Drug Des Dev Ther, 2015, 9(1): 6363-6377.
[11] SPAIDE R F, KLANCNIK JM J R, COONEY M J. Retinal vascular layers imaged by fluorescein angiography and optical coherence tomography angiography[J]. Jama Ophthalmol, 2015,133(1): 45-50.
[12] JIA Y, TAN O, TOKAYER J, et al. Split-spectrum amplitudedecorrelation angiography with optical coherence tomography[J].Opt Express, 2012, 20(4): 4710-4725.
[13] BASHIR H, SEYKORA J T, LEE V. Invisible shield: review of the corneal epithelium as a barrier to UV radiation, pathogens, and other environmental stimuli[J]. Journal of Ophthalmic & Vision Research, 2017, 12(3): 305-311.
[14] DENG X B, ZHANG F, WANG L J, et al. Airborne fine particulate matter induces multiple cell death pathways in human lung epithelial cells[J]. Apoptosis, 2014, 19(7): 1099-1112.
[15] ZHU Y, ARMSTRONG J L, TCHKONIA T, et al. Cellular senescence and the senescent secretory phenotype in age-related chronic diseases[J]. Curr Opin Clin Nutr Metab Care, 2014, 17(4):324-328.
[16] WANG C, FU T, XIA C, et al. Changes in mouse corneal epithelial innervation with age[J]. Invest Ophthalmol Vis Sci, 2012, 53(8):5077-5084.
[17] GAO Z X, SONG X L, LI S S, et al. Assessment of DNA Damage and cell senescence in corneal epithelial cells exposed to airborne particulate matter (PM2.5) collected in Guangzhou, China[J].INVEST OPHTH VIS SCI, 2016, 57(7): 3093.
[18] MOLLER P, DANIELSEN P H, JANTZEN K, et al. Oxidatively damaged DNA in animals exposed to particles[J]. Crit Rev Toxicol, 2013, 43(2): 96-118.
[19] BROWN J S, GORDON T, PRICE O, et al. Thoracic and respirable particle definitions for human health risk assessment[J].Part Fibre Toxicol, 2013, 10(1): 12.
[20] FALCONRODRIGUEZ CI, OSORNIOVARGAS AR,SADAOVALLE I, et al. Aeroparticles, composition, and lung diseases.[J]. Frontiers in Immunology, 2016, 7(1): 3.
[21] LONDAHL J, PAGELS J, SWIETLICKI E, et al. A set-up for field studies of respiratory tract deposition of fine and ultrafine particles in humans[J]. J Aerosol Sci, 2006, 37(9): 1152-1163.
[22] 李娟, 丁小艳, 王亚虹,等. PM2.5对小鼠泪膜功能和角膜上皮组织结构的影响[J]. 眼科新进展, 2017, 37(3): 201-204.
[23] LU H, WANG M R, WANG J, et al. Tear film measurement by optical reflectometry technique[J]. J Biomed Opt, 2014, 19(2):27001.
[24] 刘庆言, 陈晓宇, 李晶, 等. 共聚焦显微镜下干眼症患者角膜形态变化的诊断价值初探[J]. 安徽医科大学学报, 2017, 52(7):1025-1028.
[25] FU Q, LYU D, ZHANG L, et al. Airborne particulate matter(PM2.5) triggers autophagy in human corneal epithelial cell line[J]. Environmental Pollution, 2017(227): 314-322.
[26] FABIANI C, BARABINO S, RASHID S, et al. Corneal epithelial proliferation and thickness in a mouse model of dry eye[J]. Exp Eye Res, 2009, 89(2): 166-171.
