丹参酮ⅡA磺酸钠对血管紧张素Ⅱ诱导的大鼠心肌纤维化的影响
2018-04-28李泽孟哲李宇娜陶海龙白中乐李凌
李泽,孟哲,李宇娜,陶海龙,白中乐,李凌
[郑州大学第一附属医院 心内科(河南省高等学校临床医学重点学科开放实验室),河南 郑州 450052]
心肌纤维化指在致病因素作用下,细胞外基质(extracellular matrix,ECM)过量沉积,最终导致心脏收缩舒张功能受损的病理性改变[1]。血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)能够诱导活性氧(reactive oxygen species,ROS)的大量生成,导致ROS的生成和清除失衡,进而导致心肌纤维化的发生和进展[2-3]。
丹参酮ⅡA是我国传统中药丹参的重要活性成分。丹参酮ⅡA磺酸钠(sodium tanshinone ⅡA sulfonate,STS)是丹参酮ⅡA经磺化而得到的水溶性药物。研究表明[4-6],STS具有抗氧化应激、抗纤维化及保护心肌等作用。转录因子NF-E2相关因子 2(nuclear factor erythroid 2-ralated factor 2,Nrf2)和其胞质接头蛋白Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)参与调控细胞的抗氧化应激反应。本研究旨在观察STS能否减轻Ang Ⅱ诱导的大鼠心肌纤维化,以及这种抗纤维化的作用是否依赖于Nrf2信号通路,为其应用于临床治疗提供一定的实验依据。
1 材料与方法
1.1 药品与试剂
Ang Ⅱ(美国Sigma-Aldrich公司),Alzet微量渗透泵(美国Durect公司),STS(上海第一生化药业有限公司),细胞核/细胞浆蛋白抽提试剂盒、组织蛋白抽提试剂盒(北京康维世纪生物科技有限公司),Trizol试剂(美国Invitrogen公司),兔抗大鼠Keap1多克隆抗体、小鼠抗大鼠Nrf2单克隆抗体(英国Abcam公司),兔抗大鼠Ⅰ型胶原(Collagen Ⅰ)、Ⅲ型胶原(Collagen Ⅲ)、血红素加氧酶1(HO-1)及醌氧化还原酶1(NQO1)多克隆抗体(武汉博士德生物工程有限公司),兔抗大鼠GCLC多克隆抗体(上海生工生物工程有限公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)Master Mix、SYBR ® Green real time PCR Master Mix(日本Toyobo公司),总谷胱甘肽(total glutathione,GSH)检测试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)活性及脂质氧化丙二醛(malonaldehyde,MDA)检测试剂盒(上海碧云天生物技术有限公司)。
1.2 实验动物
40只SPF级健康雄性SD大鼠,体重200~250 g,购于河南省实验动物中心。
1.3 方法
1.3.1 心肌纤维化模型复制及处理40只健康SD大鼠随机分成5组,分别为对照组、模型组、低剂量STS组、中剂量STS组、高剂量STS组。采用SNIJDER等[7]所用方法,皮下植入微量渗透泵缓释AngⅡ复制大鼠心肌纤维化模型。适应性喂养3 d,术前禁食12 h,自由饮水。将大鼠用10%水合氯醛(3 ml/kg)麻醉后,背部肩胛区除毛,消毒后切开皮肤,对照组植入预装0.9%生理盐水的微量渗透泵,模型组与各STS组植入预装Ang Ⅱ[435 ng/(kg·min)]的微量渗透泵,缝合切口。从术后24 h开始,对照组及模型组分别给予0.9%生理盐水[10 ml/(kg·d)]腹腔注射,低、中、高剂量STS组分别给予STS[5、10及20 ml/(kg·d)]腹腔注射,共注射3周。
1.3.2 取材及切片最后一次腹腔注射后24 h,将大鼠处死后立即开胸摘取心脏,0.9%生理盐水灌洗,于室间隔处分离左心室,取部分左心室置于10%甲醛固定(标本用10%甲醛固定后脱水、石蜡包埋并切片);剩余部分立即置于液氮中冷冻后置于-80℃冰箱冷冻保存,以用于其他指标的检测。
1.3.3 心肌组织病理形态学检查石蜡切片二甲苯脱蜡,梯度酒精入水,用苏木素-伊红(HE)染色液及马松(Masson)染色液染色后,梯度酒精脱水,二甲苯透明,中性树胶封片,在显微镜下观察形态学改变,并对心肌纤维化程度进行Masson染色评分。评分采用Image-Pro Plus 6.0软件计算各组心肌胶原容积分数(collagen volume fraction,CVF)。CVF=胶原面积/心肌组织总面积×100%。
1.3.4 Western blot检测取左心室心肌组织,采用细胞核/浆蛋白抽提试剂盒分别提取细胞核、细胞浆蛋白用于Nrf2的检测,采用组织蛋白抽提试剂盒提取总蛋白用于Keap1、Collagen I、Collagen Ⅲ、HO-1、NQO1和GCLC的检测。采用BCA蛋白定量分析试剂盒检测蛋白浓度后,每孔30 μg蛋白上样,6%~12%SDS-聚丙烯酰胺凝胶电泳,恒流湿转法电转移至PVDF膜,5%脱脂牛奶室温封闭2 h,一抗4℃孵育过夜,TBS-Tween洗膜3次,辣根过氧化物酶标记的相应二抗室温孵育2 h,TBS-Tween洗膜3次,滴加ECL发光试剂,于Tanon 5200全自动化学发光图像分析系统(上海天能科技有限公司)自动曝光,采集图像后分析条带光密度值。细胞核蛋白采用Lamin B为内参,细胞质蛋白采用β-tubulin为内参,总蛋白采用DAPDH为内参。
1.3.5 qRT-PCR检测使用Trizol提取心肌组织总mRNA,按照说明书的步骤,使用qRT-PCR Master Mix逆转录试剂盒合成cDNA后,在ABI 7500 fast realtime PCR system qRT-PCR仪(美国Applied Biosystems公司)进行荧光定量扩增。采用2-ΔΔCt方法求得各个目的基因mRNA的相对含量。根据SYBR ® Green realtime PCR Master Mix的使用说明,PCR的反应条件为:95℃预变性1 min;95℃变性15 s,60℃退火15 s,72℃延伸45 s,共40个循环。引物序列见表1。

表1 qRT-PCR引物序列
1.3.6 心肌MDA、GSH含量及SOD活性的测定取左心室心肌组织,匀浆后取上清液,按照说明书的步骤,采用比色法检测心肌组织中MDA、总GSH含量以及总SOD的活性。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,先进行正态性检验和方差齐性检验,符合条件,采用单因素方差分析,两两比较采用LSD-t检验;不符合条件,采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 STS减轻Ang Ⅱ诱导的大鼠心肌纤维化
2.1.1 STS对大鼠心肌病理形态学的改变HE染色结果显示,对照组大鼠心肌组织未见明显炎症细胞浸润,心肌纤维排列均匀致密。模型组大鼠心肌组织可见坏死、心肌纤维断裂、大量炎症细胞浸润。各STS处理组心肌细胞损伤不同程度地减轻,于高剂量STS组改善更为明显(见图1A)。Masson染色结果显示,模型组大鼠心肌纤维化明显,心肌间质可见大量蓝色胶原纤维(见图1B)。各Ang II处理组CVF值差异有统计学意义(F=8.157,P=0.000)。并且随着STS剂量的增加,各STS组CVF值逐渐降低(均P<0.05)(见表2)。
2.1.2 STS减少大鼠心肌组织中Collagen Ⅰ、CollagenⅢ的表达qRT-PCR结果显示,与对照组比较,模型组CollagenⅠ、Collagen Ⅲ mRNA含量增加,差异有统计学意义(均P<0.05)(见图2A)。Western blot结果显示,各Ang Ⅱ处理组胶原蛋白表达量经方差分析,差异有统计学意义(FCollagenI=8.233,P=0.002;FCollagenIII=8.345,P=0.001)。与模型组比较,低剂量STS组Collagen Ⅰ蛋白含量减少,差异有统计学意义(t=2.412,P<0.05),Collagen Ⅲ蛋白含量差异无统计学意义(P>0.05),中、高剂量 STS组 Collagen Ⅰ、Collagen Ⅲ蛋白含量降低,差异有统计学意义(均P<0.05)(见图2B)。
2.2 STS对Nrf2核转位的影响
qRT-PCR结果显示,各Ang Ⅱ处理组Keap1、Nrf2 mRNA表达量经方差分析,差异有统计学意义(FKeap1=4.001,P=0.027;FNrf2=6.918,P=0.003)。与模型组比较,低剂量STS组Keap1、Nrf2 mRNA含量差异无统计学意义(均P>0.05),中、高剂量STS组Keap1 mRNA含量减少,Nrf2 mRNA含量增加,差异有统计学意义(均P<0.05)(见图3A)。Western blot结果显示,各Ang Ⅱ处理组Keap1、细胞质Nrf2、细胞核Nrf2蛋白表达量经方差分析,差异有统计学意义(FKeap1=9.514,P=0.001;F细胞质Nrf2=7.856,P=0.002;F细胞核Nrf2=7.252,P=0.003)。与模型组比较,中、高剂量STS组Keap1、细胞质Nrf2蛋白含量降低,细胞核Nrf2蛋白含量增加,差异有统计学意义(均P<0.05)(见图3B)。
表2 各组 CVF 值比较 (n =8,±s)
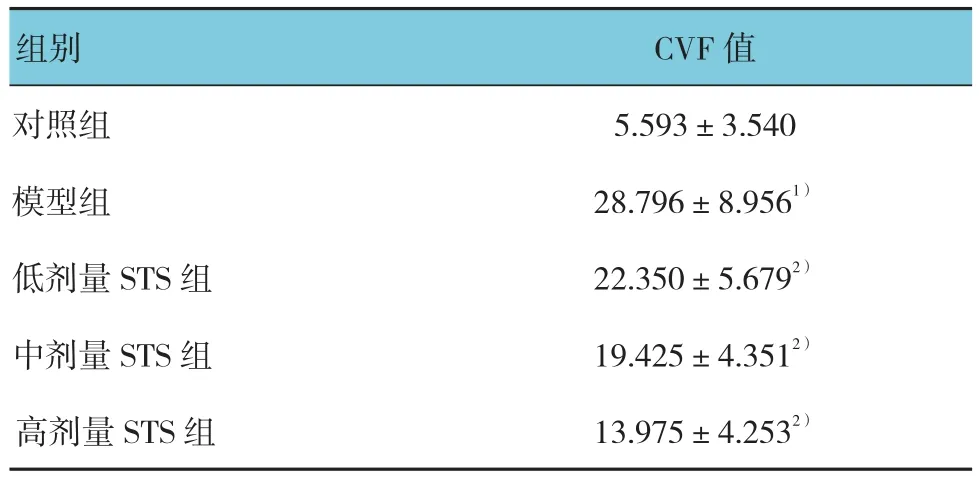
表2 各组 CVF 值比较 (n =8,±s)
注:1)与对照组比较,P <0.05;2)与模型组比较,P <0.05
组别 CVF值对照组 5.593±3.540模型组 28.796±8.9561)低剂量 STS 组 22.350±5.6792)中剂量 STS 组 19.425±4.3512)高剂量 STS 组 13.975±4.2532)

图1 STS对Ang Ⅱ诱导的心肌纤维化大鼠心肌组织病理形态学的影响
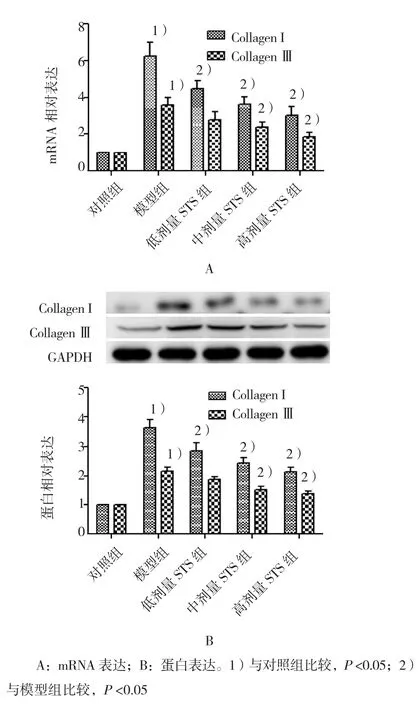
图2 STS对Ang Ⅱ诱导的心肌纤维化大鼠心肌组织中I型、Ⅲ型胶原表达的影响
2.3 STS对大鼠心肌组织中抗氧化酶及Ⅱ相解毒酶表达的影响
qRT-PCR结果显示,各Ang Ⅱ处理组HO-1、NQO1、GCLC mRNA表达量经方差分析,差异有统计学意义(FHO-1=4.741,P=0.015;FNQO1=4.994,P=0.012;FGCLC=12.289,P=0.000)。与模型组比较,高剂量STS组HO-1、NQO1、GCLC mRNA含量增加,差异有统计学意义(均P<0.05)(见图4A)。Western blot结果显示,各Ang Ⅱ处理组HO-1、NQO1、GCLC蛋白表达量经方差分析,差异有统计学意义(FHO-1=11.790,P=0.000 ;FNQO1=7.316,P=0.003 ;FGCLC=41.993,P=0.000)。与模型组比较,中、高剂量STS组HO-1、NQO1、GCLC蛋白含量增高,差异有统计学意义(均P<0.05)(见图4B)。
2.4 STS对大鼠心肌组织脂质过氧化水平和抗氧化应激的能力的影响
各Ang Ⅱ处理组MDA、GSH含量及SOD活性经方差分析,差异有统计学意义(FMDA=7.216,P=0.012;FGSH=5.838,P=0.021;FSOD=8.306,P=0.008)。与模型组比较,中、高剂量STS组MDA含量降低,差异有统计学意义(均P<0.05),GSH含量、SOD活性升高,差异有统计学意义(均P<0.05)(见图5)。
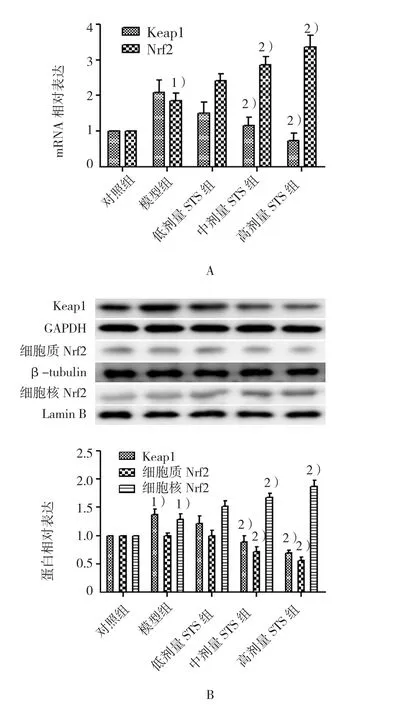
图3 STS对Ang Ⅱ诱导的心肌纤维化大鼠心肌组织中Keap1和Nrf2表达的影响
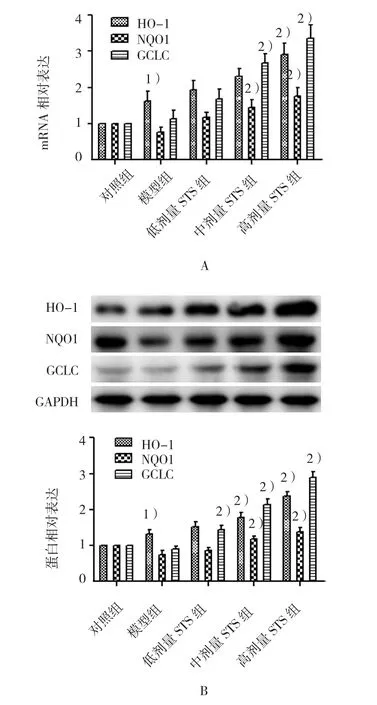
图4 STS对Ang Ⅱ诱导的心肌纤维化大鼠心肌组织中HO-1、NQO1和GCLC表达的影响

图5 STS对Ang Ⅱ诱导的心肌纤维化大鼠心肌组织中MDA、GSH含量及SOD活性
3 讨论
Ang Ⅱ是肾素-血管紧张素-醛固酮系统(reninangiotensin-aldosterone system,RAAS)重要的效应因子。Ang Ⅱ通过激活还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶,促使ROS的生成[3]。过多的ROS引起氧化应激增加,造成心肌肥大、ECM沉积,导致心肌纤维化。ECM中Ⅰ、Ⅲ型胶原的合成增加和比例失调,增加心肌僵硬度,降低心室壁顺应性,引起心室收缩舒张功能障碍,最终导致心力衰竭[8-10]。
丹参是我国传统中药,广泛用于心血管疾病的治疗[11]。丹参酮ⅡA是丹参的主要脂溶性活性成分。研究表明,丹参酮ⅡA能够抑制Ang Ⅱ处理细胞的AT1R受体表达,增强细胞抗氧化应激能力,减少ECM的沉积,减轻心肌纤维化[12-14]。本实验观察到,给予Ang Ⅱ处理后,模型组大鼠心肌纤维排列紊乱,心肌间质可见大量纤维沉积,CollagenⅠ、Collagen Ⅲ含量增加,证实Ang Ⅱ可引起心肌纤维化的发生;给予STS处理后,各组大鼠心肌细胞变性坏死程度减轻、心肌纤维化面积减少,CollagenⅠ、Collagen Ⅲ含量减少,并且这种改善随着STS剂量的增高而更加明显,证明STS能够减轻Ang Ⅱ诱导的心肌纤维化。
Nrf2属于Cap’-n’-Collar(CNC)家族抗氧化转录因子。研究表明,在生理条件下,Nrf2在胞浆中与其胞质接头蛋白Keap1偶联后被泛素化而降解,其活性处于相对抑制状态。当氧化应激发生时,Nrf2与Keap1解偶联并转移入核,与抗氧化反应元件(antioxidant response element,ARE)结合,启动其调控的抗氧化酶(HO-1、GCL及SOD等)和Ⅱ相解毒酶(NQO1、GST等)的表达[15-16]。HO-1降解产物参与细胞的抗氧化应激反应;NQO1、SOD能够保护细胞免受氧自由基及亲电子物质的损伤;谷氨酸半胱氨酸连接酶(glutamate cysteine ligase,GCL)的催化亚基(GCLC)含有GCL的所有底物结合位点和催化功能,Nrf2可以通过上调GCLC的表达增加GSH的合成,清除ROS,减轻细胞的氧化损伤。MDA是氧自由基与细胞膜多不饱和脂肪酸发生脂质过氧化的终产物,MDA可衡量氧化应激对细胞造成的损伤程度。实验结果显示,与模型组比较,中、高剂量STS组细胞质Nrf2蛋白含量减少,细胞核Nrf2蛋白含量增加,Nrf2 mRNA含量增加,HO-1、NQO1、GCLC含量增加,说明STS处理可以促进Nrf2核聚集,增强其下游抗氧化酶及Ⅱ相解毒酶的合成;与模型组比较,各STS组大鼠心肌组织中SOD活性增加,MDA含量降低,表明STS能增加大鼠心肌细胞抗氧化应激能力,减轻心肌细胞损伤。本研究发现,中、高剂量的STS可以使大鼠心肌细胞Keap1含量减低,故推测Nrf2核转位增多可能与Keap1含量减少、结合能力的降低,进而导致Nrf2降解减少有关,其具体机制有待进一步的研究。
综上所述,本研究结果表明STS可以呈剂量依赖性地抑制Ang Ⅱ诱导的心肌纤维化,这种心肌保护作用可能与STS能够促使Nrf2核转位,增加Nrf2调控的抗氧化酶和Ⅱ相解毒酶的表达,从而增强细胞抗氧化应激能力有关。
参 考 文 献:
[1] BERK B C, FUJIWARA K, LEHOUX S. ECM remodeling in hypertensive heart disease[J]. J Clin Invest, 2007, 117(3): 568-575.
[2] DIEZ J. Mechanisms of cardiac fibrosis in hypertension[J]. J Clin Hypertens (Greenwich), 2007, 9(7): 546-550.
[3] GRIENDLING K K, SORESCU D, USHIO-FUKAI M. NAD(P)H oxidase: role in cardiovascular biology and disease[J]. Circ Res,2000, 86(5): 494-501.
[4] ZHU W, LU Q, CHEN H W, et al. Protective effect of sodium tanshinone ⅡA sulfonate on injury of small intestine in rats with sepsis and its mechanism[J]. Chin J Integr Med, 2012, 18(7): 496-501.
[5] YANG L, ZOU X J, GAO X, et al. Sodium tanshinoneⅡA sulfonate attenuates angiotensinⅡ-induced collagen type I expression in cardiac fibroblasts in vitro[J]. Exp Mol Med, 2009,41(7): 508-516.
[6] ZHANG M Q, ZHENG Y L, CHEN H, et al. Sodium tanshinoneⅡA sulfonate protects rat myocardium against ischemiareperfusion injury via activation of PI3K/Akt/FOXO3A/Bim pathway[J]. Acta Pharmacol Sin, 2013, 34(11): 1386-1396.
[7] SNIJDER P M, FRENAY A R, DE BOER R A, et al. Exogenous administration of thiosulfate, a donor of hydrogen sulfide,attenuates angiotensinⅡ-induced hypertensive heart disease in rats[J]. Br J Pharmacol, 2015, 172(6): 1494-1504.
[8] MUNZEL T, GORI T, KEANEY J J, et al. Pathophysiological role of oxidative stress in systolic and diastolic heart failure and its therapeutic implications[J]. Eur Heart J, 2015, 36(38): 2555-2564.
[9] KONG P, CHRISTIA P, FRANGOGIANNIS N G. The pathogenesis of cardiac fibrosis[J]. Cell Mol Life Sci, 2014, 71(4): 549-574.
[10] 谢永进, 盖鲁粤. 血管紧张素Ⅱ致心肌纤维化及其信号转导机制研究进展[J]. 解放军医学院学报, 2014(6): 630-633.
[11] 杨志霞, 林谦, 马利. 丹参对心血管疾病药理作用的文献研究[J].世界中西医结合杂志, 2012, 7(2): 93-96.
[12] YANG R, LIU A, MA X, et al. Sodium tanshinone ⅡA sulfonate protects cardiomyocytes against oxidative stress-mediated apoptosis through inhibiting JNK activation[J]. J Cardiovasc Pharmacol, 2008, 51(4): 396-401.
[13] FU J, HUANG H, LIU J, et al. TanshinoneⅡA protects cardiac myocytes against oxidative stress-triggered damage and apoptosis[J]. Eur J Pharmacol, 2007, 568(1/2/3): 213-221.
[14] MAO S, LI W, QA’ATY N, et al. Tanshinone Ⅱ A inhibits angiotensin Ⅱ induced extracellular matrix remodeling in human cardiac fibroblasts - Implications for treatment of pathologic cardiac remodeling[J]. Int J Cardiol, 2016(202): 110-117.
[15] CULLINAN S B, GORDAN J D, JIN J, et al. The Keap1-BTB protein is an adaptor that bridges Nrf2 to a Cul3-based E3 ligase:oxidative stress sensing by a Cul3-Keap1 ligase[J]. Mol Cell Biol,2004, 24(19): 8477-8486.
[16] LAU A, VILLENEUVE N F, SUN Z, et al. Dual roles of Nrf2 in cancer[J]. Pharmacol Res, 2008, 58(5/6): 262-270.
