甲型肝炎患者黏蛋白域蛋白1和4表达与抗体产生的相关性研究*
2018-04-28胡耀华阳慧吴翔符春苗邵运禄郑才玲卓书伟
胡耀华,阳慧,吴翔,符春苗,邵运禄,郑才玲,卓书伟
(海南省中医院 1.检验科,2.妇产科,海南 海口 570203)
T细胞免疫球蛋白及黏蛋白域蛋白(T cell immunoglobulin domain and mucin domain,TIM)家族是McIntire等于2001年发现的1个新的基因家族,在人体中包括TIM-1、TIM-3和TIM-4[1]。TIM-1是甲型肝炎病毒受体-1(hepatitis A virus cellular receptor 1,HAVCR-1),TIM-4是TIM-1的天然配体[2]。流行病学发现甲型病毒性肝炎患者痊愈后具有较强的免疫能力[3],且TIM家族参与T细胞的增殖活化调节T细胞的功能,而T细胞在体液免疫抗体产生的过程中起到重要作用,所以笔者猜测TIM-1和TIM-4可能在参与细胞免疫的同时,也参与机体的体液免疫的强化,本研究通过检测甲型肝炎患者外周血TIM-1和TIM-4 mRNA表达水平以及血清中白介素4(interleukin-4,IL-4),白介素 10(interleukin-10,IL-10)和总 Ig(IgG和IgA),探讨TIM-1、TIM-4是否对体验免疫有强化作用,为将来开发低毒的HAV疫苗从而间接提高体液免疫能力用以抗肿瘤和感染提供理论支持。
1 资料与方法
1.1 一般资料
选取2015年11月-2016年11月本院收治的甲型病毒性肝炎患者60例(研究组)。男性46例,女性14例;年龄28~42岁,平均(33±8.3)岁。所有患者依靠甲型肝炎典型症状和血清中抗HAV IgM阳性确诊为甲型肝炎,诊断标准参照2000年9月西安中华医学会传染病与寄生虫病学分会和肝病学分会修订的病毒性肝炎防治方案。选取同期于本院体检中心健康体检的志愿者60例为对照组。男性40例,女性20例;年龄26~43岁,平均(31±9.6)岁。入选患者及志愿者均对本研究内容充分知情,且均自愿签署知情同意书后入组,符合伦理学要求。
1.2 静脉血标本
于恢复期采集甲型病毒性肝炎患者静脉血抗凝(EDTA-Na2)全血2 ml及不抗凝血3 ml,分离血清。同时采集健康体检志愿者静脉血抗凝(EDTA-Na2)全血2 ml及不抗凝血3 ml,分离血清。
1.3 甲型肝炎患者和正常对照人群外周血单个核细胞TIM-1和TIM-4 mRNA表达水平检测
1.3.1 引物设计与合成应用生物信息学知识,根据GeneBank中 的TIM-1 mRNA、TIM-4 mRNA和 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)mRNA全长序列,用Primer Express软件设计目的基因TIM-1、TIM-4和内参照基因GAPDH引物,并由生工生物工程(上海)股份有限公司合成。
1.3.2 外周血单个核细胞(peripheral blood mononuclear cell,PBMC)的获取及总RNA的提取与逆转录将聚蔗糖-泛影葡胺分离液和预先稀释的抗凝全血加入离心管中,密度梯度离心法2 000 r/min水平离心20 min后,小心吸取密集在血浆层和分层液界面中呈白色雾状的单个核细胞,经RPMI 1640细胞培养液调整细胞浓度为1×106个/L。Trizol法抽提外周血单个核细胞总RNA,人TIM-1和TIM-4基因的cDNA文库按照逆转录说明书宝生物工程(大连)有限公司合成。按照pMD18-T Simple载体说明书连接上述人TIM-1和TIM-4加A的片段。并转化感受态大肠杆菌(Escherichia coli)DH5α,在链霉素选择性培养基上筛选,按蓝白斑实验挑选白斑并用PCR菌液PCR证实。
1.3.3 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)检测外周血单核细胞中TIM-1和TIM-4 mRNA表达根据NCBI GenBank中人GAPDH,TIM-1和TIM-4的基因序列,应用Primer 5.0引物设计软件设计特异性引物:GAPDH正 向5'-CCAAACTACCTTCAACTCCATC-3',反 向 5'-AGTGATCTCCTTCTGCATCCT-3';TIM-1正向 5'-CGTAATCCGAGGCATAAT-3',反向 5'-AAGCGA CAACCCAAAGGT-3';IM-1正向 5'-GCTAATCCCACG CATAAT-3',反向 5'-ATGGAACAACCCAAATGT-3'。利用Prime-STAR HSDNA聚合酶(TaKaRa)分别扩增人TIM-1和TIM-4全长片段,退火温度为60℃,纯化PCR产物。qRT-PCR仪上进行扩增并进行实时检测,具体为real-time PCR反应体系:10×PCR缓冲液2 μl,25 mmol/L Mg2+3.5 μl,10 mmol/L dNTPs 0.4 μl,10 μmol/L引物各0.5 μl,普通TaqDNA聚合酶1 u(1 u/μl),质粒 DNA 1 μl,牛血清白蛋白 BSA(1 mg/ml)2 μl,SYBR GreenI 20×1 μl,灭菌 H2O 8.1 μl。空白对照管加1.0 μl灭菌焦碳酸二乙酯(DEPC)水代替质粒DNA,盖上盖后瞬间离心,使样品聚集在毛细管底部,然后上机扩增。扩增条件为:95℃预变性4 min,然后3步反应:95℃变性30 s;60℃退火30 s;72℃延伸30 s,40个循环,再分别进行荧光检测,并做熔解曲线对PCR产物的特异性进行鉴定,最后反应冷却至40℃。PCR反应产物在2%琼脂糖凝胶电泳并测序检验其特异性。
1.4 ELISA检测外周血IL-4、IL-10、肿瘤坏死因子α和总Ig(IgG、IgM和IgA)水平
采用ELISA检测外周血IL-4、IL-10、肿瘤坏死因子α(tumor necrosis factor,TNF-α)和总 Ig(IgG、IgM和IgA)水平。具体步骤:取抗凝血,采用12 000 r/min离心5 min。吸取上清液100 μl。室温(18~25℃)温育30 min,倒掉板内液体,用清洗缓冲液洗板3次拍干,每孔滴加100 μl酶结合物室温(18~25℃)温育30 min,洗板3次拍干,滴加显色液A和B各100 μl,室温(18~25℃)避光温育15 min后加终止液100 μl,酶标仪450 nm读数。
1.5 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组TIM-1和TIM-4 mRNA表达水平比较
由qRT-PCR反应曲线得到阈值循环数(threshold cycle number,Ct)值,计算基因相对表达量,采用GAPDH作为内参照。ΔCt=Ct目的基因-Ct GAPDH 基因表达相对量 =2-ΔΔCt×100。其中甲型肝炎患者TIM-1、TIM-4 mRNA阈值循环数为分别为 Ct=39.662~ 2.136logX(r=0.682),Ct=30.279~3.028logX(r=0.748)。测得甲型肝炎患者恢复期以及对照组血清中的TIM-1和TIM-4的mRNA。结果见表1,甲型肝炎恢复期患者血清中TIM-1和TIM-4的mRNA的表达高于对照组(P<0.05)。
2.2 两组外周血清中IL-4和IL-10水平比较
甲型病毒性肝炎恢复期患者血清中IL-4、IL-10和TNF-α的水平均高于对照组(P<0.01)。其中IL-4水平在2次测量中变异较大,第2次测量中高于对照组。见表2。
2.3 两组组外周血清中总Ig水平比较
甲型病毒性肝炎恢复期患者血清IgG和IgA水平都高于对照组(P<0.05)。其中IgG的变异性较大,IgA的变异较小;甲型病毒性肝炎患者与对照组IgM比较,差异无统计学意义(P>0.05),见表3。
表1 两组TIM-1和TIM-4 mRNA水平比较 (±s)
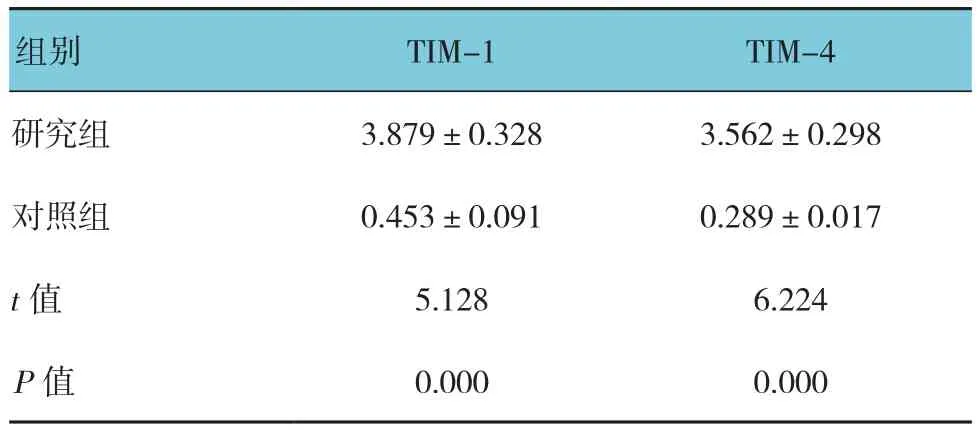
表1 两组TIM-1和TIM-4 mRNA水平比较 (±s)
组别 TIM-1 TIM-4研究组 3.879±0.328 3.562±0.298对照组 0.453±0.091 0.289±0.017 t值 5.128 6.224 P值 0.000 0.000
表2 两组外周血清中IL-4、IL-10及TNF-α水平比较(pg/ml,±s)

表2 两组外周血清中IL-4、IL-10及TNF-α水平比较(pg/ml,±s)
组别 IL-4 IL-10 TNF-α研究组 102.3±15.1 140.3±6.7 69.2±9.8对照组 46.5±2.6 13.2±5.4 31.2±3.4 t值 4.136 5.668 5.002 P值 0.001 0.000 0.000
表3 甲型病毒性肝炎患者和对照组外周血清中总 Ig 水平比较 (IU/ml,±s)

表3 甲型病毒性肝炎患者和对照组外周血清中总 Ig 水平比较 (IU/ml,±s)
组别 IgG IgM IgA 总Ig研究组 250±140 15±6 210±60 640±220对照组 150±121 13±5 140±36 470±180 t值 3.668 0.768 2.854 3.275 P值 0.000 0.423 0.000 0.000
3 讨论
TIM家族目前在人类中已经发现3个(TIM-1、TIM-3和TIM-4),作为T细胞的免疫调节分子对免疫反应的调节起着重要作用[4]。TIM-1又称HAVCR-1,是HAV的特异性受体;TIM-4是TIM-1的配体,特异性的表达于抗原提呈细胞(antigen present cell,APC)表面,且更多见于树突状细胞细胞(dendritic cell)表面[5]。研究发现,甲型肝炎患者痊愈后血清中的TIM-1和TIM-4的mRNA水平高于对照组,同时总Ig(IgG和IgA)水平也高于对照组。也就是说相比于对照组,HAV感染后患者的体液免疫能力会高于对照组,这与笔者的流行病学观察结果一致。
IL-4和IL-10主要是由Th2(T help cell)分泌,是血液中重要的抗炎症因子,具有促进B细胞增值分化以及浆细胞分泌抗体的功能。TNF-α是由单核细胞和巨噬细胞分泌产生的,参与细胞免疫和体液免疫。甲型病毒性肝炎患者愈后血清中IL-4、IL-10和TNF-α表达多于对照组,这可能是由于TIM-1和TIM-4传递一种细胞信号刺激Th2使其分泌的IL-4和IL-10增多,同时刺激单核巨噬分泌TNF-α增多。这与国外甲型病毒性肝炎患者恢复期Th2的功能增强的研究结果一致,发现TIM-4可诱导TIM-1胞内尾巴区酪氨酸磷酸化,提供1个共刺激信号,增强IL-4启动子的转录,并激活T细胞核因子(nuclear factor of activated T cells,NFAT)转录和活化蛋白1(AP-1)促使T细胞增殖和细胞因子产生[6-8]。最新在斑马鱼上关于TIM-1和TIM-4的研究也证实TIM-1可以增强体液免疫能力而且具有记忆能力,这与甲型肝炎患者长期的自我保护的能力是一致的[9]。国外有研究发现,TIM-1和TIM-4可以相互作用通过影响树突状细胞DC来影响体液免疫的能力,且与Th2细胞所分泌的细胞因子IL-4和IL-10相关[11-12]。最近流行病学发现,甲型病毒性肝炎患者预后患哮喘和类风湿等过敏性和自身免疫性疾病的风险会降低,而对于其他病毒感染也会有较强的抵抗能力,研究认为可能是由于TIM-1和TIM-4之间传递一种双向调节信号,可以既提高免疫耐受同时激活免疫防御[10-11]。但是实验还存在一些不足:TIM-1和TIM-4的具体相互关系以及如何刺激Th2细胞还是不清楚;笔者只是通过IL-4和IL-10间接反映Th2细胞的能力,至于是由于Th2细胞的增值还是活化还不清楚;同时样本量还是偏小。下一步将通过基因敲除的大鼠同时结合免疫共沉淀技术进一步探讨TIM-1和TIM-4与Th2细胞的具体作用机制;利用流式细胞方法进一步检测Th2细胞的数量来探讨Th2细胞的增值和活化;利用基因芯片技术进一步从TIM-1和TIM-4基因多态性角度进一步阐述其对体液免疫调节的复杂机制。
TIM-1和TIM-4是调节T细胞功能的重要分子,对T细胞的影响是很容易理解,但如何调节体液免疫一直不太清楚。通过T细胞影响体液免疫还是直接影响B细胞来实现调节体液免疫也不清楚。本研究发现,TIM-1和TIM-4可能是通过刺激Th2细胞分泌IL-4和IL-10来激活体液免疫。对甲型病毒性肝炎患者而言,HAV病毒会特异性的结合于TIM-1,TIM-1高表达会较持续的激活T细胞进一步影响B细胞。从而达到进一步保护机体的作用。本研究结果认为,可以通过接种低毒性的甲肝疫苗,从而达到刺激TIM-1和TIM-4的表达,从而给机体提供较强的细胞免疫和体液免疫的能力。笔者相信通过对甲型病毒性肝炎患者血清中的TIM-1和TIM-4的进一步研究,可为T细胞和B细胞之间的信号传递提供一种新的方式[13]。
参 考 文 献:
[1] MCINTIRE J J, UMETSU S E, AKBARI O, et al. Identification of Tapr (an airway hyperreactivity regulatory locus) and the linked Tim gene family[J]. Nat Immunol, 2001, 2(12): 1109-1116.
[2] RENNERT P D. Novel roles for TIM-1 in immunity and infection[J]. Immunology Letters, 2011, 141(1): 28-35.
[3] KIM H Y, EYHERAMONHO M B, PICHAVANT M, et al. A polymorphism in TIM1 is associated with susceptibility to severe hepatitis A virus infection in humans[J]. Journal of Clinical Investigation, 2011, 121(3): 1111-1118.
[4] RODRIGUEZ-MANZANET R, DEKRUYFF R, KUCHROO V K,et al. The costimulatory role of TIM molecules[J]. Immunol Rev,2009, 229(1): 259-270.
[5] MEYERS J H, CHAKRAVARTI S, SCHLESINGER D, et al.TIM-4 is the ligand for TIM-1, and the TIM-1–TIM-4 interaction regulates T cell proliferation[J]. Nature Immunology, 2005, 6(5):455-464.
[6] ZHAO C Q, LI T L, HE S H, et al. Specific immunotherapy suppresses Th2 responses via modulating TIM1/TIM4 interaction on dendritic cells[J]. Allergy, 2010, 65(8): 986-995.
[7] YEUNG M Y, DING Q, BROOKS C R, et al. TIM-1 signaling is required for maintenance and induction of regulatory B cells[J].American Journal of Transplantation, 2015, 15(4): 942-953.
[8] SUN H W, WU C, TAN H Y, et al. A new development of FG-CC’siRNA blocking interaction of Tim-1 and Tim-4 can enhance DC vaccine against gastric cancer[J]. Hepatogastroenterology, 2012,59(120): 2677-2682.
[9] XU X G, HU J F, MA J X, et al. Essential roles of TIM-1 and TIM-4 homologs in adaptive humoral immunity in a Zebrafish model[J].J Immunol, 2016, 196(4): 1686-1699.
[10] de SOUZA A J, ORISS T B, O’MALLEY K J, et al. T cell Ig and mucin 1 (TIM-1) is expressed on in vivo-activated T cells and provides a costimulatory signal for T cell activation[J]. Proc Natl Acad Sci U S A, 2005, 102(47): 17113-17118.
[11] CHAKRAVARTI S, SABATOS C A, XIAO S, et al. Tim-2 regulates T helper type 2 responses and autoimmunity[J]. The Journal of Experimental Medicine, 2005, 202(3): 437-444.
[12] XIAO S, ZHU B, JIN H, et al. Tim-1 stimulation of dendritic cells regulates the balance between effector and regulatory T cells[J].Eur J Immunol, 2011, 41(6): 1539-1549.
[13] DU P, XIONG R, LI X, et al. Immune regulation and antitumor effect of TIM-1[J]. Journal of Immunology Research, 2016(2016):1-6.
