乳腺癌患者血清中miRNA-21、miRNA-210、miRNA-1246的表达及临床意义*
2018-04-28舒耀吴斌宋俊
舒耀,吴斌,宋俊
(西南医科大学附属医院 乳腺外科,四川 泸州 646000)
乳腺癌(breast cancer,BC)是全球妇女中最常见的癌症,BC的早期诊断对于提高患者的生存率及生活质量至关重要。乳腺钼靶和超声成像被广泛用于BC的筛查,但乳腺摄影术中乳房密度增加会降低检查的敏感性,钼靶的阳性检出率并不高[1]。两种基于血清的肿瘤生物标志物(CA15-3和CEA)用于检测BC,但敏感性和特异性有限[2]。因此新型和更准确的无创生物诊断标志物引起人们的关注。到目前为止,研究已经证明微小RNA(miRNA)不仅在肿瘤组织中异常表达,也会在外周血中稳定存在,其可作为肿瘤诊断的生物标志物[3]。本研究对48例BC患者进行血清miRNA-210、miRNA-21和miRNA-1246水平检测,分析其与BC发病的关系及诊断价值。
1 资料与方法
1.1 一般资料
选取2017年3月-2017年6月西南医科大学附属医院乳腺外科确诊的女性BC患者48例(BC组)。年龄34~69岁,中位52岁;绝经前患者20例(41.7%),绝经后28例(58.3%);非浸润性癌6例(12.5%),浸润性癌42例(87.5%);肿瘤直径小于2 cm者15例(31.3%),直径2~5 cm者33例(68.7%);有淋巴结转移者13例(27.1%),无淋巴结转移者35例(72.9%);TNM分期(UICC第7版):0期15例(31.3%),Ⅰ期9例(18.8%),Ⅱ期14例(29.2%),Ⅲ期10例(20.8%)。入选标准:①所有病例均经病理学诊断确诊为BC;②具备完整的临床资料;③取得标本前均未接受过新辅助治疗;④既往无肿瘤病史且无其他部位转移的BC患者。
正常对照组为同一时期进行年度体检的健康女性48例(对照组)。年龄37~68岁,中位53岁。两组患者在年龄、体重指数、哺乳史及月经史等方面比较,差异无统计学意义(P>0.05)。本研究通过医院伦理委员会审批,所有患者均知晓本研究目的、过程和意义,并同意参与,签署知情同意书。
1.2 材料与试剂
1.2.1 标本采集BC患者于手术前1天抽取清晨空腹静脉血6 ml、对照组受试者体检的当日(空腹10 h以上)采集其肘静脉血6 ml(含促凝胶的真空采血管),室温静置30 min~1 h,血液凝固后取上清于洁净1.5 ml EP管,置入-80℃冰箱保存待测。
1.2.2 试剂血清miRNA提取试剂(10% PEG试剂、lysis buffer),探针及引物设计(美国Applied Biosyste公司),Rever Tra Ace qRT-PCR Kit,THUNDERBIRD Probe qPCR Mix(东洋坊上海科技生物有限公司)。
1.2.3 仪器与设备ABI-7500荧光定量PCR仪(ABI公司、美国),离心机(Eppendorf、德国),37℃水浴锅、95℃金属浴锅(北京田园奥瑞生物科技有限公司)。
1.3 方法
1.3.1 RNA的提取将血清样本置入离心机中4℃5 000 r/min离心30 min,取400 μl上层血清于洁净1.5 ml EP管中,加入44 μl 10% PEG试剂,于4℃冰箱静置沉淀2 h,再于离心机4℃ 5 000 r/min离心10 min,得到的沉淀用400 μl柠檬酸钠缓冲液(0.1 mol/L、pH=4.5)冲洗3次,再次于离心机中4℃ 5 000 r/min离心10 min,弃去上清液,往剩余的沉淀中加入20 μl lysis buffer溶液。
1.3.2 cDNA合成严格按照Rever Tra ACE qRTPCR试剂盒说明书进行逆转录反应。反应体系:RNA模板 5 μl,引物 miRNA-21、miRNA-210、miRNA-1246、U6 各 1 μl,Enzyme Mix 1 μl、5×Buffer 4 μl、DEPC水6 μl。逆转录条件:37℃水浴箱中2 h,待转录结束后再置于95℃金属浴中5 min,然后立即置于冰盒上。
1.3.3 实时荧光定量PCR(quantitative real-timepolymerase chain reaction,qRT-PCR)检测以荧光定量PCR仪使用THUNDERBIRD Probe qPCR Mix试剂盒进行扩增反应,以U6为内参检测目的基因相对表达水平,U6、miRNA-21、miRNA-210和miRNA-1246引物序列见表1。反应体系:cDNA产物2 μl,2×miRNA qPCR Mix 10 μl,20× 引物各 1 μl,余用MQ水补齐至20 μl。扩增条件:95℃预变性1 min,95℃变性15 s,60℃退火延伸60 s,共40个循环,所有反应设立2个复孔。根据各样品qRT-PCR曲线得到Ct值,Ct值表示荧光达到阈值所需要的循环数。miR-21/210/1246在乳腺癌患者血清中的相对表达量用2-△△Ct描述,△△ Ct=(CtmiR-21/210/1246-CtU6)乳腺癌-(CtmiR-21/210/1246-CtU6)对照组。

表1 引物序列
1.4 评判标准
ROC曲线下面积值1.0~0.5。在AUC>0.5的情况下,AUC越接近于1,说明诊断效果越好。0.5<AUC<0.7时有较低准确性;0.7≤AUC≤0.9时有一定准确性,AUC>0.9以上时有较高准确性。AUC=0.5时,说明诊断方法完全不起作用,无诊断价值。约登指数(youden index,YI)表示诊断试验(或某一种检测方法)发现真正的患者与非患者的总能力;约登指数=敏感性+特异性-1,其值于0~1之间波动,其值愈大,说明该诊断试验(检测方法)的真实性越好且更稳定,其诊断价值越高。
1.5 统计学方法
数据分析采用SPSS 20.0和MedCalc统计软件,定性资料用频数及百分率表示,定量资料用中位数及其四分位数间距表示,采用秩和检验,利用ROC曲线确定不同指标对BC的诊断价值,P<0.05为差异有统计学意义。BC的最佳诊断模型由Fisher判别分析建立。
2 结果
2.1 两组miRNA-21、miRNA-210、miRNA-1246的表达水平
BC组患者血清miRNA-21的相对表达水平为0.591(0.340,1.022),对照组相对表达水平为0.145(0.078,0.193)(Z=-7.108,P =0.001)。BC组患者血清miRNA-210的相对表达水平为1.187(0.411,2.043),对照组相对表达水平为0.060(0.032,0.100)(Z=-8.112,P =0.000)。BC组患者血清miRNA-1246的相对表达水平为109.758(33.201,282.513),对照组相对表达水平为36.383(18.777,65.918)(Z=-4.008,P =0.000)。miRNA-21、miRNA-210、miRNA-1246 3 者在BC组患者血清中的表达水平均升高。
2.2 血清 miRNA-210、miRNA1246、miRNA-21水平与BC患者临床特征的关系
血清miRNA-210、miRNA-1246、miRNA-21在Ⅲ期BC患者或有淋巴结转移的患者中高表达(P<0.05),而与绝经状况、肿瘤大小及病理类型无关系(P>0.05)。见表2。
2.3 血清miRNA在BC诊断中的ROC曲线分析
通过ROC曲线分析显示,miRNA-210曲线下面 积(AUC) 为 0.980(95%CI:0.928,0.998), 敏感性为 95.80%(95%CI:0.857,0.995),特异性为91.70%(95%CI:0.800,0.977),约登指数为0.875;miRNA-21的 AUC 为 0.936(95%CI:0.866,0.976),敏感性为89.60%(95%CI:0.773,0.965),特异性为85.40%(95%CI:0.722,0.939),约登指数为0.750;miRNA-1246 的 AUC 为 0.737(95%CI:0.638,0.822),敏感性为 58.30%(95%CI:0.432,0.724),特异性为89.60%(95%CI:0.773,0.965),约登指数为0.479。提 示 miRNA-210、miRNA-21、miRNA-1246对 BC均有一定诊断效能。而AUC miRNA-21+miRNA-210+miRNA-1246=AUC miRNA-210+miRNA-1246>AUC miRNA-21+miRNA-210>AUC miRNA-21+miRNA-1246。AUC miRNA-210+miRNA-1246 vs AUC miRNA-210,差异无统计学意义(Z=1.332,P=0.183),也就是说miRNA-210+miRNA-1246联合检测、miRNA-21+miRNA-210+miRNA-1246联合检测的诊断效能并不优于miRNA-210单独检测。见表3和图1。

表2 BC患者血清miRNA-210、miRNA-1246、miRNA-21表达水平与临床特征的关系
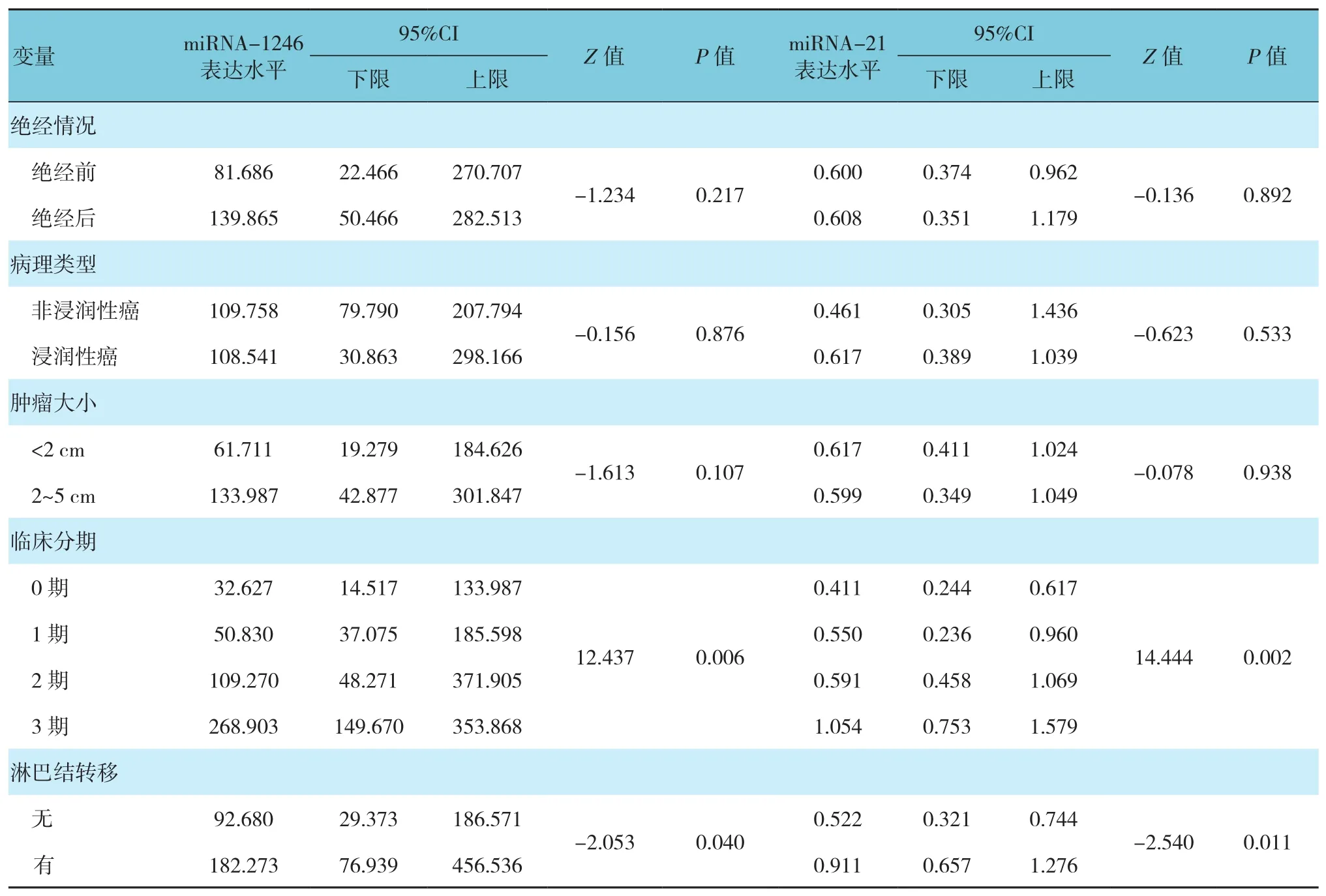
续表2
2.4 BC诊断模型的建立
Fisher判别分析用于建立BC的最佳诊断模型,其中进入F=3.84,移除F=2.71,得到:miRNA-21(a1)、miRNA-210(a2)、miRNA-1246(a3)的判别方程系数,见表4和图2。

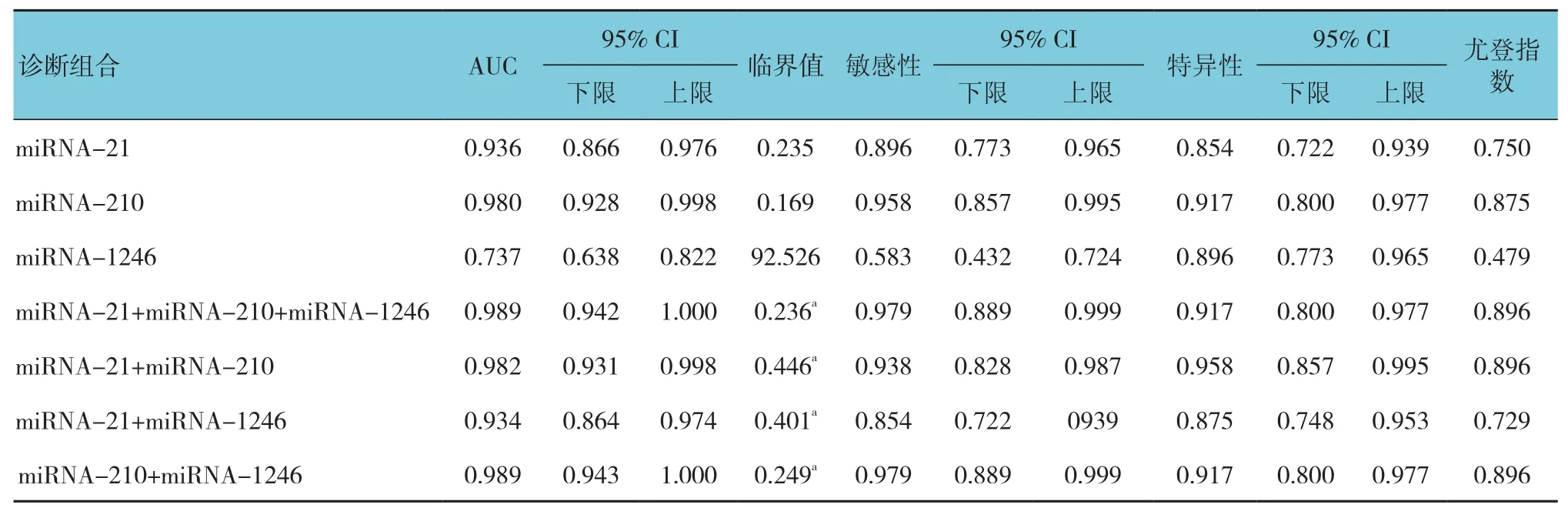
表3 不同指标或指标组合的诊断价值比较 (n =48)
即,当将患者上述参数(a1~a3)分别带入方程Q1、Q2,当Q1>Q2时,认为该患者应归为对照组(正常组);当Q1<Q2时,认为该患者应归为病例组,应对该患者做进一步的筛查与核实。
应用该模型对本样本进行回代判别,结果显示:本判别模型的敏感性为62.5%;特异性为100.0%,即该模型排除非患者的能力较好,而发现患者的能力相对较弱,见表5。
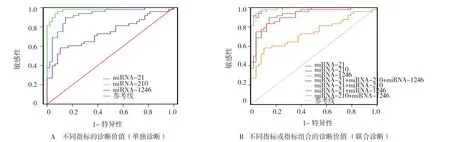
图1 不同指标的诊断价值比较
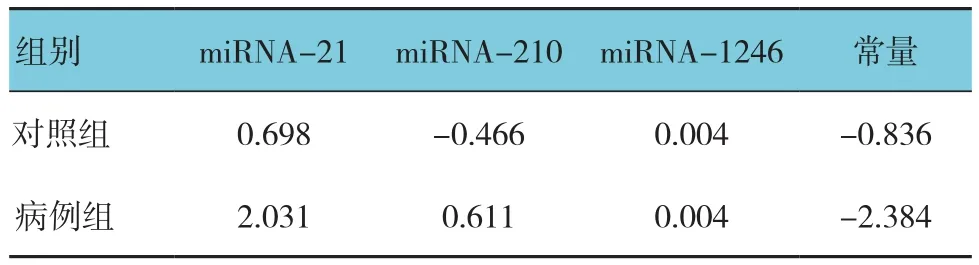
表4 分类函数系数 (未标准化)
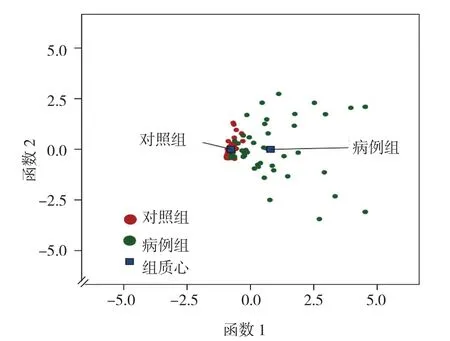
图2 判别分析对BC诊断的效果图
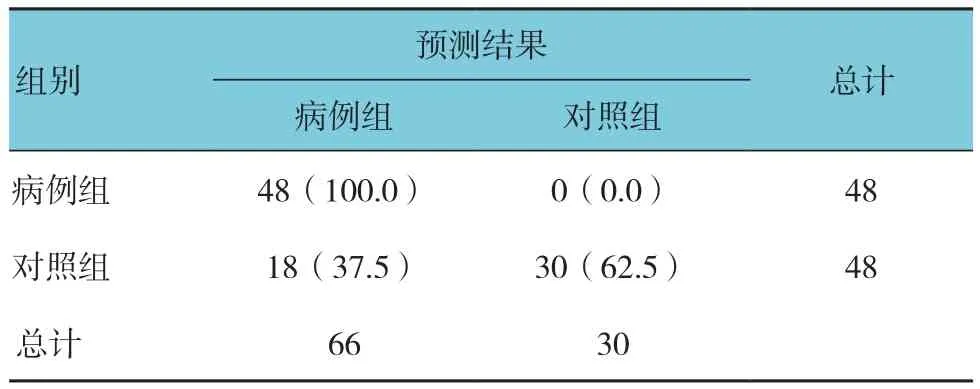
表5 判别模型的分类结果
3 讨论
miRNA是21~25个核苷酸组成的非编码RNA,其在转录后水平上以序列特异性方式负调节基因表达。每个miRNA通过与靶mRNA的3'-非翻译区结合以诱导信号降解或抑制翻译来控制多个靶基因的表达。miRNA表达可以对细胞表型和功能产生重要的影响[4]。许多研究发现,miRNA与肿瘤的发展,侵袭,转移和其他特征密切相关,表明miRNA有可能成为癌症治疗新策略的基础[5]。CHEN等[6-7]将各种来源的血清miRNA在恶劣条件下进行处理,发现煮沸、低/高pH,RNA降解酶、反复冻融或延长储存时间等方法均不会造成miRNA的损失,进一步证实血清miRNA的稳定性,其具备作为疾病分子生物标志物的许多优点。几项研究已经评估血清或血浆miRNA作为不同类型癌症的生物标志物的潜在用途,如肺癌、结直肠癌、卵巢癌、肾细胞癌、舌鳞状细胞癌及成胶质细胞瘤[8-13]。
miRNA-21在大多数人类肿瘤中表达,已被证明是致癌过程中的关键调节因子,在肿瘤形成和进展中起重要作用。IORIO等[14]报道miRNA-21在BC组织中过表达,可能是BC有用标记。WANG等[15]使用qRTPCR测定结直肠癌组织或细胞系中miRNA-1246的miRNA表达水平,发现miRNA-1246在肿瘤组织中的表达水平高于成对的相邻组织。此外,SW620、SW480、HCT116、HT29和LOVO细胞系中miRNA-1246的表达水平也比正常肠上皮细胞高,结果提示miRNA-1246可能参与结直肠癌的形成和进展,其可能具有促癌基因的作用。位于染色体11p15.5上的miRNA-210在许多人类癌症中过表达[16-18]。miRNA-210过度表达,特别是在缺氧条件下,影响涉及肿瘤发展的许多过程,包括促进血管生成和DNA修复能力的降低[17,19]。尿路上皮细胞癌(UTUC)组织中miRNA-210表达高于非癌性尿路上皮细胞,且miRNA-210表达水平与肿瘤分期和组织学分级正相关,这提示miRNA-210可能是UTUC的重要致癌因子[20]。本研究均证明,恶性肿瘤的发生、进展与miRNA表达失衡有关。但是通过活检或手术取得标本是1个有创过程,容易引起邻近组织损伤或癌症转移。
YING等[21]研究证实miRNA-210过表达促进癌细胞的侵袭和转移。ROTKRUA等[22]发现,miRNA-210的血清水平在弥漫性胃癌的小鼠模型中高于对照组。YU等[23]提出miRNA-210可能是早期检测胃癌的可靠标志物。HENEGHAN等[24]发现在148例BC患者的循环血中,miRNA-195和let-7a的水平较正常对照组高,肿瘤切除后降低至与对照组相当的水平。上述研究表明,血清miRNA的检测可以作为癌症无创诊断的潜在生物标志物。本研究结果显示,BC组患者的水平高于对照组(P<0.001),提示3者在BC患者中可能发挥促癌基因的作用,其血清水平过表达可能是BC诊断的潜在生物标志物。进一步分析发现,BC患者miRNA-21、miRNA-210和miRNA-1246血清水平与临床特征相关,3者在BCⅢ期患者、有淋巴结转移的患者高表达(P<0.05)。以上结果表明,miRNA-21、miRNA-210和miRNA-1246不但参与BC发病,还可能与肿瘤细胞转移、临床分期有关。WANG等[25]发现miRNA-21在BC患者血清中增高(P<0.001)。CHEN等[26]提出BC患者血清miRNA-21高表达不仅与BC的发生有关,而且与淋巴结转移有关。YAN等[27]研究表明,miRNA-21的过表达与临床分期、淋巴结转移和预后差相关。上述3个研究结论与本文结果一致。
为进一步评估血清miRNA-21、miRNA-210、miRNA-1246对BC诊断的价值,本研究分别对3者做ROC曲线分析,结果显示,miRNA-210+miRNA-1246联合检测、miRNA-21+miRNA-210+miRNA-1246联合检测的诊断效果并不优于miRNA-210单独检测。Fisher判别分析用于建立BC的最佳诊断模型,该模型的敏感性为62.5%;特异性为100.0%,即排除非患者的能力较好,而发现患者的能力相对较弱。故miRNA-210可能是一种理想的BC诊断标志物。
综上所述,BC患者血清miRNA-21、miRNA-210和miRNA-1246水平呈高表达状态,对BC有一定的诊断价值,miRNA-210对BC的诊断价值可能最高。3者与肿瘤分期和淋巴结转移有关系。本研究存在样本量小,仅对比BC患者和健康组血清miRNA的表达水平,未深入研究多种因素如手术、化疗等对血清中miRNA的影响。将在后续的研究中开展相应的工作。
参 考 文 献:
[1] CHECKA C M, CHUN J E, SCHNABEL F R, et al. The relationship of mammographic density and age: implications for breast cancer screening[J]. AJR Am J Roentgenol, 2012, 198(3):W292-295.
[2] GAO J, ZHANG Q, XU J, et al. Clinical significance of serum miR-21 in breast cancer compared with CA153 and CEA[J]. Chin J Cancer Res, 2013, 25(6): 743-748.
[3] GILLIS A J, RIJLAARSDAM M A, EINI R, et al. Targeted serum miRNA (TSmiR) test for diagnosis and follow-up of (testicular)germ cell cancer patients: a proof of principle[J]. Mol Oncol, 2013,7(6): 1083-1092.
[4] SOON P S, KIARIS H: MicroRNAs in the tumor microenvironment: big role for small players[J]. Endocr Relat Cancer 2013, 20(5): R257-R267.
[5] CHOU J, SHAHI P, WERB Z, et al. microRNA-mediated regulation of the tumor micro environment[J]. Cell Cycle 2013(12): 3262-3271.
[6] CHEN X, BA Y, MA L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18(10): 997-1006.
[7] BOERI M, VERRI C, CONTE D, et al. MicroRNA signatures in tissues and plasma predict development and prognosis of computed tomography detected lung cancer[J]. Proc Natl Acad Sci U S A,2011, 108(9): 3713-3718.
[8] CHEN X, BA Y, MA L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18(10): 997-1006.
[9] NG E K, CHONG W W, JIN H, et al. Differential expression of microRNAs in plasma of patients with colorectal cancer: a potential marker for colorectal cancer screening[J]. Gut, 2009,58(10): 1375-1381.
[10] RESNICK K E, ALDER H, HAGAN J P, et al. The detection of differentially expressed microRNAs from the serum of ovarian cancer patients using a novel real time PCR platform[J]. Gynecol Oncol, 2009, 112(1): 55-59.
[11] FENG G, LI G, GENTIL-PERRET A, et al. Elevated serumcirculating RNA in patients with conventional renal cell cancer[J].Anticancer Res, 2008, 28(1A): 321-326.
[12] WONG T S, LIU X B, WONG B Y, et al. Mature miR-184 as potential oncogenic microRNA of squamous cell carcinoma of tongue[J]. Clin Cancer Res, 2008, 14(9): 2588-2592.
[13] SKOG J, WÜRDINGER T, VAN RIJN S, et al. Glioblastoma microvesicles transport RNA and proteins that promote tumor growth and provide diagnostic biomarkers[J]. Nat Cell Biol, 2008,10(12): 1470-1476.
[14] IORIO M V, FERRACIN M, LIU C G, et al. MicroRNA gene expression deregulation in human breast cancer[J]. Cancer Res 2005(65): 7065-7070.
[15] WANG S, ZENG Y, ZHOU J M, et al. MicroRNA-1246 promotes growth and metastasis of colorectal cancer cells involving CCNG2 reduction[J]. Mol Med Rep, 2016, 13(1): 273-280.
[16] VALERA V A, WALTER B A, LINEHAN W M, et al. Regulatory effects of microRNA-92 (miR-92) on VHL gene expression and the hypoxic activation of miR-210 in clear cell renal cell carcinoma[J]. Cancer, 2011(2): 515-526.
[17] YU P, FAN S, HUANG L, et al. MIR210 as a potential molecular target to block invasion and metastasis of gastric cancer[J]. Med Hypotheses, 2015, 84(3): 209-212.
[18] HO A S, HUANG X, CAO H, et al. Circulating miR-210 as a novel hypoxia marker in pancreatic cancer[J]. Transl Oncol, 2010,3(2): 109-113.
[19] IVAN M, HUANG X. MiR-210: fine-tuning the hypoxic response[J]. Adv Exp Med Biol, 2014(772): 205-227.
[20] KE H L, LI W M, LIN H H, et al. Hypoxia-regulated microRNA-210 overexpression is associated. with tumor development and progression in upper tract urothelial carcinoma[J]. Int J Med Sci,2017, 14(6): 578-584.
[21] YING Q, LIANG L, GUO W, et al. Hypoxia-inducible microRNA-210 augments the metastatic potential of tumor cells by targeting vacuole membrane protein 1 in hepatocellular carcinoma[J]. Hepatology 2011, 54(6): 2064-2075.
[22] ROTKRUA P, SHIMADA S, MOGUSHI K, et al. Circulating microRNAs as biomarkers for early detection of diffuse-type gastric cancer using a mouse model[J]. Br J Cancer 2013, 108(4):932-940.
[23] P, FAN S, HUANG L, et al. MIR210 as a potential molecular target to block invasion and metastasis of gastric cancer[J]. Med Hypotheses, 2015, 84(3): 209-212.
[24] HENEGHAN H M, MILLER N, LOWERY A J, et al. Circulating microRNAs as novel minimally invasive biomarkers for breast cancer[J]. Ann Surg, 2010, 251(3): 499-505.
[25] WANG B, ZHANG Q. The expression and clinical significance of circulating microRNA-21 in serum of five solid tumors[J]. J Cancer Res Clin Oncol, 2012, 138(10): 1659-1666.
[26] 陈崇, 周桃玉, 温旺荣, 等. 家族性和三阴性乳腺癌血清中miR-21的表达[J]. 暨南大学学报(自然科学与医学版), 2015,36(1): 50-55.
[27] YAN L X, HUANG X F, SHAO Q, et al. MicroRNA miR-21 overexpression in human breast cancer is associated with advanced clinical stage, lymph node metastasis and patient poor prognosis[J]. RNA, 2008, 14(11): 2348-2360.
