不同来源革兰阴性菌armA基因分布与氨基糖苷类抗生素耐药性
2018-04-28卢金星梁建生罗成旺
龚 林, 李 娟, 袁 敏, 陈 霞, 卢金星, 梁建生, 罗成旺
(1 中国疾病预防控制中心传染病预防控制所,北京 102206;2 武汉市疾病预防控制中心,湖北 武汉 430015)
近年来,越来越多的菌株产生了对氨基糖苷类抗生素的耐药性,使临床上常用的氨基糖苷类抗生素的临床抗感染效果日益减弱。 16S rRNA甲基化酶的产生是氨基糖苷类抗生素耐药的重要机制,该类酶的产生阻断了氨基糖苷类药物与作用靶点的接合,介导细菌对几乎所有的氨基糖苷类药物高水平耐药[1]。
编码该酶的基因包括npmA、armA、rmtA、rmtB、rmtC、rmtD、rmtE、rmtF、rmtG和rmtH[2],其中armA基因是分布最广泛的16S rRNA甲基化酶基因[3]。它于2003年在法国一株肺炎克雷伯菌中被发现[4],随后的几年里,西班牙、日本、保加利亚、韩国、台湾地区等均有报道[5-10]。且该基因也发现于多种革兰阴性菌中,包括铜绿假单胞菌、鲍曼不动杆菌、大肠埃希菌、黏质沙雷菌、肺炎克雷伯菌、阴沟肠杆菌等[6-10],在世界各地呈现出散发或暴发的趋势。armA基因由774个碱基组成,其G+C含量为30.4%,比其他16s rRNA甲基化酶基因都低,并且armA基因编码的氨基酸与其他16s rRNA甲基化酶氨基酸的同源性均低于30%[11]。该编码基因通常位于质粒、转座子或I 类整合子[11]上,通过其高度可移动性,可在菌株间广泛转移和传播。目前,耐氨基糖苷类抗生素的armA基因在不同地区的革兰阴性菌中分布相差悬殊[12-15]。因此,有必要对其进行流行病学调查,以阐明armA在氨基糖苷类抗生素耐药中的作用和地位。本研究对不同来源的革兰阴性菌进行了氨基糖苷类耐药性分析和armA基因检测,以了解该基因在本地区的流行特征以及基因型与药敏表型的关系。
1 材料与方法
1.1 菌株来源 收集2011年2月—2014年11月不同来源的革兰阴性菌953株,其中846株菌株分离自国内3所三甲医院住院患者送检的痰、分泌物、尿、血、脑脊液等非重复标本;107株菌株来自于山东某养鸡场和屠宰场的种鸡体表、种鸡内脏、养殖人员体表、屠宰人员体表、屠宰水、屠宰鸡等标本。
1.2 仪器和试剂 荧光定量PCR仪(瑞士Roche公司)、VITEK 2 Compact 全自动细菌鉴定及药敏分析系统(法国生物梅里埃公司)、荧光定量PCR反应试剂(瑞士Roche公司)、细菌基因组DNA提取试剂盒(北京天根生化科技有限公司)。
1.3 菌株鉴定及药敏试验 所有菌株鉴定及药敏试验采用VITEK 2 Compact 全自动细菌鉴定及药敏分析系统。质控菌株为大肠埃希菌ATCC 25922,按美国临床实验室标准化协会(CLSI)2016年版标准判读药敏试验结果。
1.4armA基因的检测 采用细菌基因组DNA提取试剂盒提取革兰阴性菌基因组。荧光定量PCR的方法检测armA基因,引物及探针如下:armA-F:5’-TCAAAAACCTATACTTTATCGTCGTCTT-3’,armA-R:5’-TATTTTAGATTTTGGTTGTGGCTTCA-3’,TaqMan探针:FAM-AACTTCCCAATAATGCTAC-MGB,扩增片段长度为162bp[16]。扩增反应体系参考相关文献[16]。LightCycler○R480荧光定量PCR扩增程序如下:(1)预变性:95℃ 3 min;(2) 扩增: 95℃ 10 s,55℃ 20 s,72℃ 1 s,40个循环;(3)冷却:40℃ 10 s。

2 结果
2.1 基本情况 本研究共收集953株革兰阴性菌,其中846株为临床来源菌株,107株为养殖场来源菌株。临床来源菌株种属分布为:克雷伯菌属385株,不动杆菌属176株,埃希菌属91株,假单胞菌属66株,肠杆菌属48株,沙雷菌属27株,其他种属53株;养殖场来源均为克雷伯菌属菌株。
2.2 对氨基糖苷类药敏结果 除沙雷菌属和不动杆菌属外,其他菌属对阿米卡星药物敏感性的MIC50均≤8 μg /mL;不动杆菌属的耐药率最高,为86.4%,埃希菌属的耐药率最低,仅为7.7%。菌株对庆大霉素药物敏感性的MIC50均≥16 μg/mL;各菌属对庆大霉素耐药率均在54%以上,其中耐药率最高的为不动杆菌属,达89.8%。见表1。
2.3armA基因携带情况 本研究收集的菌株armA阳性率为26.9%(256/953),其中armA阳性率最高的是不动杆菌属,高达66.5%;埃希菌属和假单胞菌属armA阳性率较低,仅为3.3%和3.0%。见表1。
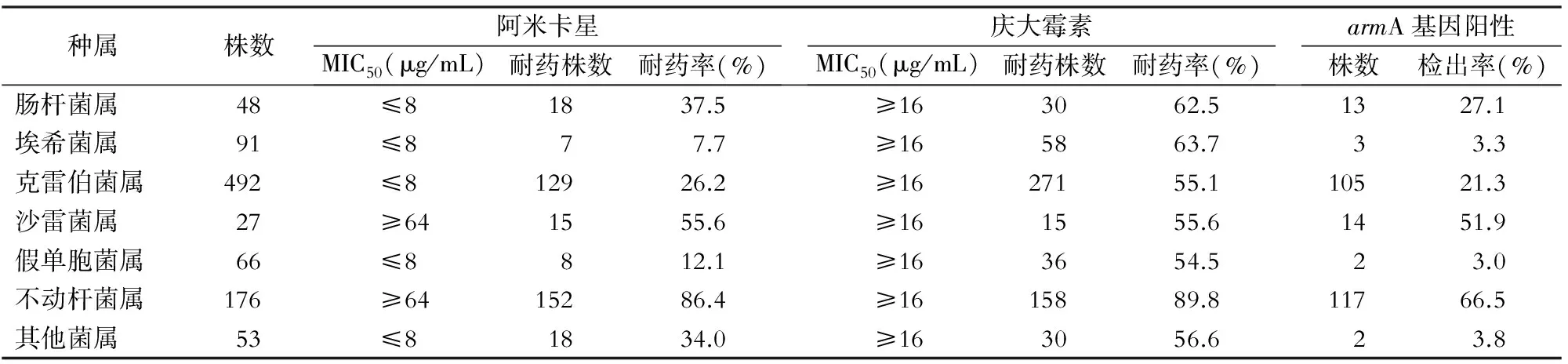
表1 不同种属菌株对氨基糖苷类抗生素耐药情况及armA基因检测结果
2.4armA基因携带与药物敏感性的关系 256株armA阳性菌株对阿米卡星和庆大霉素耐药率高达95.7%和98.4%,极少数armA阳性菌株对阿米卡星和庆大霉素敏感,比率分别为4.3%和1.6%; 697株armA阴性菌株中仍有部分菌株对阿米卡星和庆大霉素耐药,比率分别为14.6%和49.6%,见表2。对两表中基因与药物作关联性分析,阿米卡星、庆大霉素关联系数(r)分别为0.598、0.408,均P<0.001,携带armA基因的菌株与两种氨基糖苷类抗生素的药敏表型均存在关联,且与阿米卡星药敏表型的关联性更强。
2.5 对不同氨基糖苷类药物耐药率的比较 携带armA基因的革兰阴性菌对庆大霉素与阿米卡星耐药率的差异无统计学意义(均P>0.05);未携带armA基因的革兰阴性菌中,临床来源的肠杆菌属、埃希菌属、克雷伯菌属、假单胞菌属和不动杆菌属对庆大霉素的耐药率均高于阿米卡星,差异有统计学意义(均P<0.05)。见表3。
表2953株革兰阴性菌armA基因携带及其对阿米卡星、庆大霉素的耐药情况(株)
Table2Carrying ofarmA gene, as well as amikacin and gentamicin resistance of 953 gram-negative bacterial strains (No. of isolates)

armA携带株数阿米卡星耐药非耐药庆大霉素耐药非耐药阳性256245112524阴性697102595346351合计953347606598355
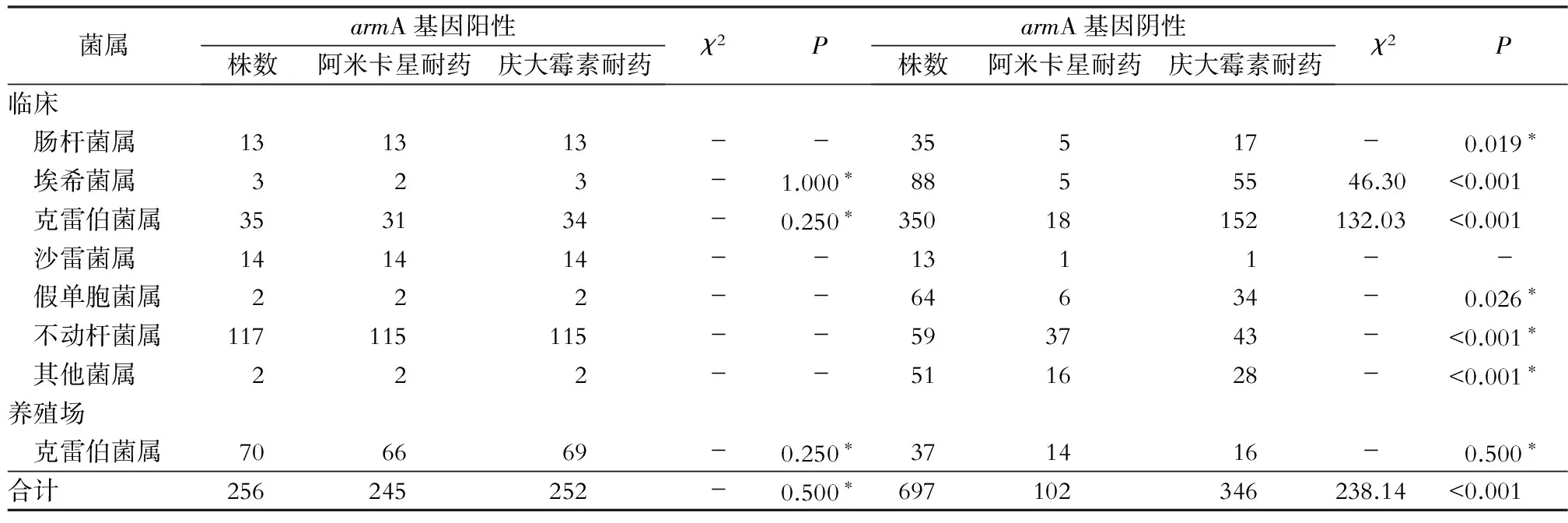
表3 不同菌属armA基因携带及其对氨基糖苷类耐药情况(株)
*:Fisher’s确切概率法
2.6 不同来源克雷伯菌属armA基因携带与耐药性的比较 养殖场来源克雷伯菌属对阿米卡星、庆大霉素耐药率和armA基因携带率分别为74.8%、79.4%和65.4%,均高于临床来源菌株(χ2值分别为166.59、32.79、158.26,均P<0.05)。见表4。
表4不同来源克雷伯菌属对氨基糖苷类抗生素耐药及armA基因检出情况[株(%)]
Table4Aminoglycoside resistance and detection results ofarmA gene inKlebsiellaspp. strains from different sources (No. of isolates[%])

来源菌株数阿米卡星耐药庆大霉素耐药armA基因阳性临床来源38549(12.7)186(48.3)35(9.1)养殖场来源10780(74.8)85(79.4)70(65.4)
3 讨论
氨基糖苷类抗生素是临床抗感染治疗的重要药物。了解细菌对氨基糖苷类抗生素耐药现状及其耐药性发展趋势,将为控制耐药菌的传播提供重要信息[17]。由于armA基因在国内外各地区的革兰阴性菌中分布相差悬殊,本研究较大规模的调查了国内部分地区的临床来源和养殖场来源的革兰阴性菌对氨基糖苷类抗生素的药物敏感性和armA的携带情况,为了解该地区细菌中armA的分布提供线索,明确该地区armA在氨基糖苷类抗生素耐药中的作用。但本试验仍存在部分局限性:菌株来源非随机样本,不能完全反映研究地区的氨基糖苷类耐药和基因携带水平。
本研究收集的953株革兰阴性菌对阿米卡星和庆大霉素的耐药率分别为36.4%和62.7%,与吴琼等[18]报道的基本一致。其中不动杆菌属对阿米卡星和庆大霉素的耐药率已分别达到86.4%和89.8%,提示氨基糖苷类抗生素已很难有效地治疗由不动杆菌属引起的感染。其次克雷伯菌属、肠杆菌属和沙雷菌属对氨基糖苷类抗生素的耐药性也日益严重。如果耐药菌的产生和传播不能得到有效控制,将进一步削弱氨基糖苷类抗生素的临床使用价值。
本研究菌株中armA基因阳性率为26.9%。潘韵峰等[19]在国内多个省市各医院调查发现,鲍曼不动杆菌中armA基因阳性率达47.7%,本研究的调查结果为66.5%,提示该基因在鲍曼不动杆菌中存在进一步扩散的可能。此外,armA阳性率在沙雷菌属、肠杆菌属中也高达51.9%和27.1%,提示armA 基因的传播可能已突破菌属界限,实现了种属间的水平传播。
本次研究分析了携带armA基因菌株的药物敏感性,其对阿米卡星和庆大霉素耐药率高达95.7%和98.4%。由此可见,armA基因的携带与氨基糖苷类抗生素耐药表型具有很高的一致性,此结果也与armA的耐药机制相吻合:修饰氨基糖苷类抗生素的作用靶点,从而导致细菌几乎对所有氨基糖苷类抗生素高水平耐药。本研究中发现部分菌株虽然耐药,但未检出armA基因,提示还存在其他氨基糖苷类耐药机制。也有极少数菌株虽然基因检测阳性,但表现为敏感,armA基因是否发生了突变或者是否其转录、表达受到了抑制尚待进一步验证[20]。养殖场来源克雷伯菌属菌株的armA基因携带率高于临床来源,提示armA基因在养殖场来源菌株中的流行度可能更广。相关部门应加强动物养殖中对抗菌药物使用的监管,密切监测动物源菌的耐药情况以及流行趋势,采用各种防治手段进行控制,以减少耐药菌的传播[20]。
[参考文献]
[1] Yokoyama K, Doi Y, Y amane K, et al. Acquisition of 16S rRNA methylase gene inPseudomonasaeruginosa[J]. Lancet, 2003, 362(9399):1888-1893.
[2] 王珊,吕媛,李耘,等. 我国阿米卡星耐药大肠埃希菌16S rRNA甲基化酶基因及其水平转移研究[J]. 中国临床药理学杂志,2015,31(4):283-285.
[3] 潘韵峰, 周华, 俞云松. 导致高水平氨基糖苷类抗生素耐药的新型16S rRNA 甲基化酶基因研究进展[J]. 中华检验医学杂志, 2007,30(6):699-701.
[4] Galimand M, Courvalin P, Lambert T.Plasmid-mediated high level resistance to aminoglycosides in Enterobacteriaceae due to 16S rRNA methylation[J]. Antimicrob Agents Chemother, 2003, 47(8): 2565-2671.
[5] Yamane K, Wachino J, Doi Y, et al. Global spread of multiple aminoglycoside resistance gene[J]. Emerg Infect Dis, 2005, 11(6): 951-953.
[6] Doi Y,Yokoyama K,Yamane K,et al. Plasmid mediated 16S rRNA methylase inSerratiamarcescensconferring high level resistance to aminoglycosides[J]. Antimicrob Agents Chemother, 2004, 48(2): 491-496.
[7] Waehino J, Yamane K, Shibayama K, et al.Novel plasmid-mediated 16S rRNA methylase, RmtC, found in aProteusmira-bilisisolate demonstrating extraordinary high level resistance against various aminoglycosides[J]. Antimicrob Agents Chemother, 2006, 50(1): 178-184.
[8] Doi Y, de Oliveira Garcia D, Adams J, et al. Coproduction of novel 16S rRNA methylase RmtD and metalio-lactamase SPM-1 in a panresistantPseudomonasaeruginosaisolate from Brazil[J]. Antimicrob Agents Chemother, 2007, 51(3): 852-856.
[9] Van JJ,Wu JJ, Ko WC,et al. Plasmid-mediated 16S rRNA methylases conferring high-level aminoglycoside resistance inEscherichiacoliandKlebsiellapneumoniaeisolates from two Taiwanese hospitals[J]. J Anitimicrob Chemother, 2004, 54(6): 1007-1012.
[10] González-Zorn B, Teshager T, Casas M, et al.armA and aminoglycoside resistance inEscherichiacoli[J]. Emerg Infect Dis, 2005, 11(6): 954-956.
[11] 韩玲. 革兰阴性菌中16S rRNA甲基化酶基因的检测[D].大连:大连医科大学,2010.
[12] 倪舒芳,钱雅芬,孙婷婷,等.鲍曼不动杆菌临床分离株16S rRNA甲基化酶基因研究[J].中国抗生素杂志,2011,36(12):935-938.
[13] Shrestha S, Tada T, Shrestha B, et al. Emergence of amino-glycoside resistance due toarmA methylase in multi-drug resistantAcinetobacterbaumanniiisolates in a university hospital in Nepal[J]. J Nepal Health Res Counc, 2016, 14(33): 72-76.
[14] 黄和赞,罗来恒,万鸣春,等.鲍曼不动杆菌耐药性及armA甲基化酶检测与分析[J].中国抗生素杂志,2014,39(3):234-235.
[15] Piekarska K, Zacharczuk K, Wolkowicz T, et al. Distribution of 16S rRNA methylases among different species of aminoglycoside-resistant Enterobacteriaceae in a tertiary care hospital in Poland[J]. Adv Clin Exp Med, 2016, 25(3): 539-544.
[16] 龚林,袁敏,陈霞,等.氨基糖苷类药物耐药基因armA荧光定量PCR检测方法的建立[J].疾病监测,2014,29(11):901-904.
[17] 代敏. PCR和核酸探针检测猪源沙门氏菌四环素耐药基因tetC的研究[J].畜牧兽医学报, 2005 , 36 (5) :482-485.
[18] 吴琼,韩立中,孙景勇,等. 氨基糖苷类耐药的肠杆菌科细菌16S rRNA甲基化酶基因研究[J],检验医学,2014,29(5):528-534.
[19] 潘韵峰,周华,俞云松.16S rRNA甲基化酶基因在鲍曼不动杆菌中的分布[J].中华传染病杂志,2007,25(10):593-596.
[20] 龚林.氨基糖苷类耐药基因armA实时荧光PCR检测方法的建立、应用及NDM-5阳性大肠埃希菌的特征研究[D].北京:中国疾病预防控制中心,2015.
