抗CD19 CAR-T对K562CD19+肿瘤细胞特异性杀伤作用的研究
2018-04-27高鹏李玉霞贾凡扈江伟乔雪辉王炜凌焱陈惠鹏
高鹏,李玉霞,贾凡,扈江伟,乔雪辉,王炜,凌焱,陈惠鹏
合成生物学旨在以人工手段制造生物系统[1],其中一个重要发展方向是模拟和新建生物信号通路并实现新的生物学功能。合成生物学经过多年的快速发展,产出了新型的研究工具和治疗方案[2]。嵌合抗原受体(chimeric antigen receptors,CAR)修饰的 T 淋巴细胞(CAR-T)就是利用合成生物学思路搭建信号通路形成的治疗方案,其应用已经在癌症治疗方面展现出巨大的前景并得到美国FDA 批准进入临床应用[3]。CAR-T 按照合成生物学的基本设计原则在安全性和可控性方面不断取得新的进展[4]。
急性淋巴细胞白血病(ALL)的 20% 儿童患者和 65% 成人患者存在化疗耐药性,导致疾病复发[5]。新型的治疗方案需要绕过药物抵抗才能显著提高治疗指数。由此,细胞治疗作为一种新型的治疗方案由于出色的疗效令人瞩目,其有效缓解率优于现有的经典疗法[6]。
通过人工修饰的方式可以改变 T 淋巴细胞的免疫杀伤靶向性,即在 T 细胞上修饰人造的免疫受体从而特异识别肿瘤细胞并激活 T 细胞,其高效的靶向性使 T 细胞毒性特异性针对肿瘤细胞,选择性杀伤肿瘤细胞,避免正常组织受到影响[7]。人造的嵌合抗原受体通常包括胞外的抗体来源单链可变结构域(single-chain variable fragment,scFv)和胞内信号转导分子。对于 ALL 细胞,CD19 表面抗原分子在高达 95% 的 B 细胞肿瘤上表达[8]。而且这种高表达是特异性的,不在正常的非造血细胞上表达,造血细胞中也仅仅在 B 淋巴细胞系表达,这使得 CD19 分子成为一个极具吸引力的靶向治疗抗原[9]。单纯的 CD3ζ 信号不足以激活 T 细胞发挥杀伤作用,根据 T 细胞激活的双通路理论,还需要添加共刺激信号分子,比如 4-1BB 分子[10]。
在本项研究中,我们探究了靶向 CD19 分子的嵌合抗原受体修饰的 T 淋巴细胞对于 CD19 细胞的特异性杀伤作用。结果表明,抗 CD19 CAR-T 细胞能够特异性地被 CD19 表型阳性的细胞激活,并且在较低的效靶比时即对靶细胞产生较强的杀伤作用。
1 材料与方法
1.1 材料
大肠杆菌 DH5α、293T 细胞、K562 细胞、K562CD19+细胞为本实验室保存。RPMI1640、DMEM、青霉素/链霉素、胎牛血清均为美国 Gibco公司产品;DNA 聚合酶、DNA marker、限制性内切酶为美国 NEB 公司产品;质粒大提试剂盒为天根生化科技(北京)有限公司产品;淋巴细胞分离液 Ficoll-Paque PLUS 购于美国 GE 公司;聚凝胺、聚乙烯亚胺为美国 Sigma-Aldrich 公司产品;IL-2 ELISA kit为美国 BD 公司产品;Cyto Tox96®非放射性细胞毒性检测试剂盒购于美国 Promega 公司。
1.2 方法
1.2.1 CD19-CAR 载体的构建 按照融合表达的设计,把 EGFP 与 CD19 CAR 分子通过自剪切的F2A 分子相连接。其中,CD19 CAR 分子通过融合PCR 技术将识别 CD19 分子的单链抗体片段CD19-ScFv 与协同共刺激分子 4-1BB 和胞内传递信号的 CD3ζ 串联。构建到慢病毒表达载体pLenti-EF1α 上,经酶切鉴定和测序鉴定正确克隆即命名为 pLenti-EGFP-CD19-CAR。
1.2.2 慢病毒包装、浓缩 在 15 cm 培养皿中接种 5 × 106293T 细胞,在 37 ℃ CO2培养箱中过夜培养。当汇合度达到 60% ~ 70% 时,即可进行慢病毒包装的质粒转染。转染时,制备转染 DNA 复合物:在 2 ml PBS 中加入 10 μg pLenti-EGFP-CD19-CAR、5 μg pMDL g/pRRE 慢病毒包装载体质粒、2.5 μg pRSV-Rev 载体质粒、2.5 μg pMD2.G 载体质粒,混匀后加入 18 μl 聚乙烯亚胺(100 μmol/L),再次混匀后室温静置 10 min即可转染。分别在转染后 48 h 和 72 h 收集含有病毒颗粒的细胞培养上清,经过 0.45 μm 过滤膜过滤后采用超速离心法(24 000 r/min,2 h)浓缩慢病毒颗粒,重悬后分装保存在 –80 ℃ 超低温冰箱。
1.2.3 T 细胞分离与修饰 采用 Ficoll 分离法获取人外周血来源的单个核细胞 PBMC,并用X-VIVO 无血清培养基培养。用抗 CD3/CD28 抗体和 IL-2 激活 T 细胞,第2 天用浓缩过的病毒感染。在适量体积的无血清的 X-VIVO 中加入聚凝胺至终浓度为 8 μg/ml,用该培养基重悬离心收集的 T 细胞,并以 5 × 105个/孔的密度接种在6 孔板中。根据病毒滴度与细胞数目,加入 MOI =30 的慢病毒浓缩液,轻轻摇动培养板以混匀。其后每 3 天补充培养基和 IL-2,在第14 天左右进行相关实验分析。
1.2.4 ELISA 检测 IL-2 的表达 取 K562 细胞与 K562CD19+细胞,按照 1 × 105个/孔浓度接种于U 型 96 孔细胞培养板,并按照效应细胞:靶细胞 = 2:1 的比例接种 primary-T 或 CD19 CAR-T细胞。将 96 孔板置于 37 ℃、5% CO2培养箱培养过夜。过夜培养后使用 ELISA 试剂盒测定上清中的 IL-2 含量,具体操作详见说明书。
1.2.5 乳酸脱氢酶(LDH)释放实验评价 T 细胞杀伤作用 同 IL-2 测定,共孵育培养 24 h 后,使用 Cyto Tox96®非放射性细胞毒性检测试剂盒测定培养物 LDH 释放量,具体操作详见说明书。细胞杀伤率 =(实验组释放量 – 效应细胞自发释放量 – 靶细胞自发释放量)/(靶细胞最大释放量 –靶细胞自发释放量)× 100%
1.3 统计学处理
采用 SPSS 21.0 统计软件,计量资料用±s表示,多组间比较用单因素方差分析,两两比较用Tukey 检验。检验水准 α = 0.05,P≤ 0.05 为差异具有统计学意义。
2 结果
2.1 获得抗 CD19 嵌合抗原受体慢病毒载体
利用融合 PCR 的方法把报告基因 EGFP 与抗 CD19 的 CAR 分子用自剪切的 F2A 分子连接。在细胞中表达后 EGFP 蛋白从融合蛋白上切割下来留在胞内,CAR 分子则在导肽的作用下定位在细胞膜上。抗 CD19 CAR 分子片段包括对CD19 表面抗原具有特异性的单链抗体片段,共刺激因子 4-1BB 片段和细胞内传递信号的 CD3ζ区域(包含 3 个ITAM 区域)。为了保证 CAR 分子在 T 细胞中高效稳定地表达,将 EGFP-CAR 分子克隆到 pLenti-EF1α 慢病毒载体上,质粒抽提后经过酶切和测序结果表明,完全符合预期结果。

图1 慢病毒包装镜检结果Figure 1 Protein expression in 293T cell transfected with lentivirus by GFP fluorescence assay
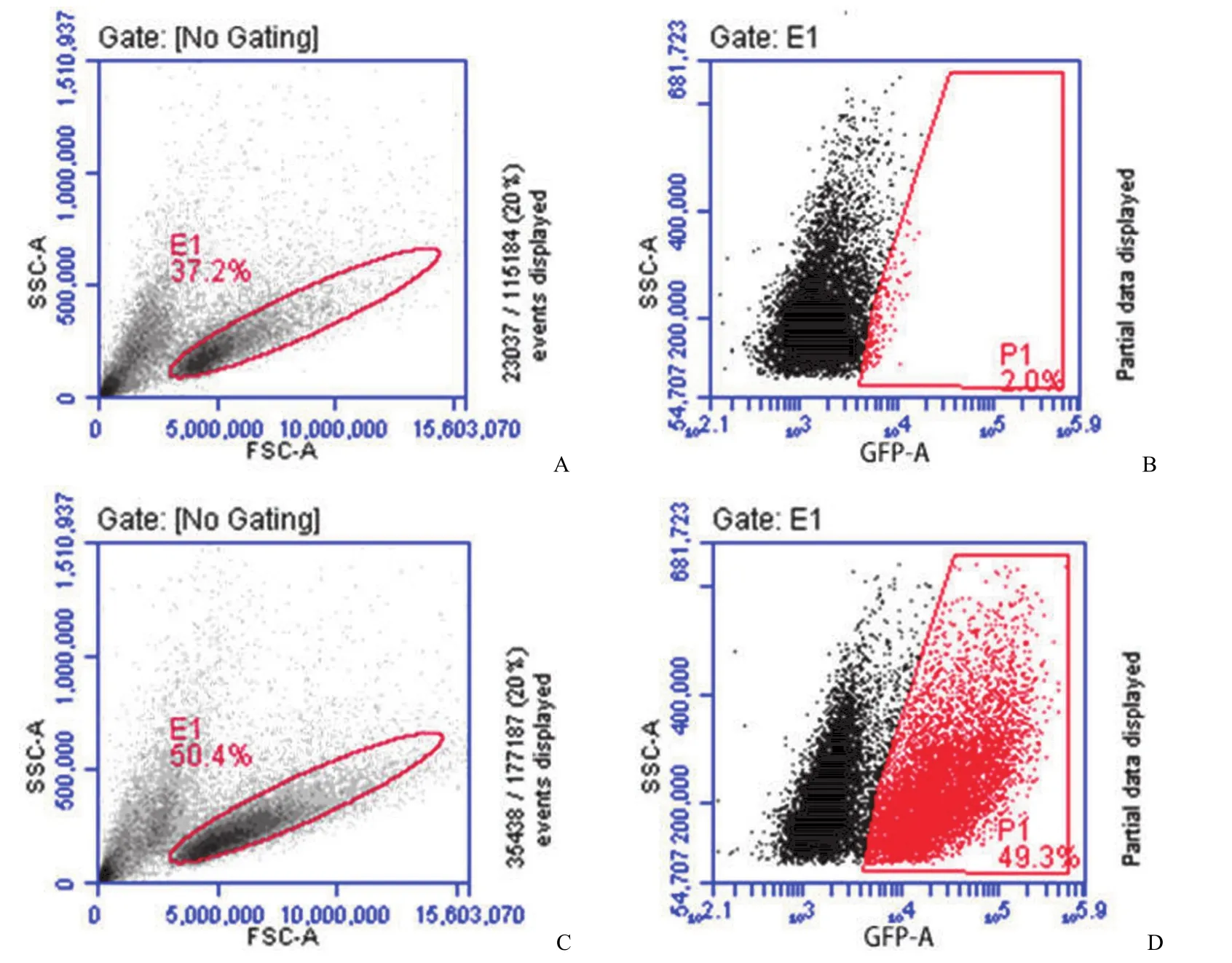
图2 流式细胞术检测 CAR-T 阳性细胞百分比(A:Primary-T 细胞散点图;B:Primary-T 细胞荧光分布;C:CAR-T 细胞散点图;D:CAR-T 细胞荧光分布)Figure 2 Transfection rate of CAR in T cells assayed by flow cytometry (A: Primary-T flow cytometry scatter plot; B: Primary-T flow cytometry GFP plot; C: CAR-T flow cytometry scatter plot; D: CAR-T flow cytometry GFP plot )
2.2 获得抗 CD19 CAR 慢病毒
通过融合的 EGFP 报告分子即可镜检初步判断病毒包装效率,包装病毒 72 h 荧光镜检并记录,结果如图 1 所示。浓缩的病毒感染 293T 细胞后,采用实时定量 PCR 技术,测定慢病毒滴度,慢病毒滴度达到 108TU/ml。
2.3 慢病毒介导的 T 细胞 CAR 表达效率
在慢病毒感染 T 细胞过表达 CAR 分子的第3 天,镜检感染成功。结果初步表明融合蛋白能够在 T 细胞中表达。进一步扩大培养后,在第5 天,感染慢病毒载体的 CAR-T 细胞与未感染慢病毒的 primary-T 细胞的流式细胞术分析表明,融合蛋白表达效率约达 50%,结果如图 2 所示。
2.4 CAR-T 细胞受 CD19 阳性细胞特异性激活
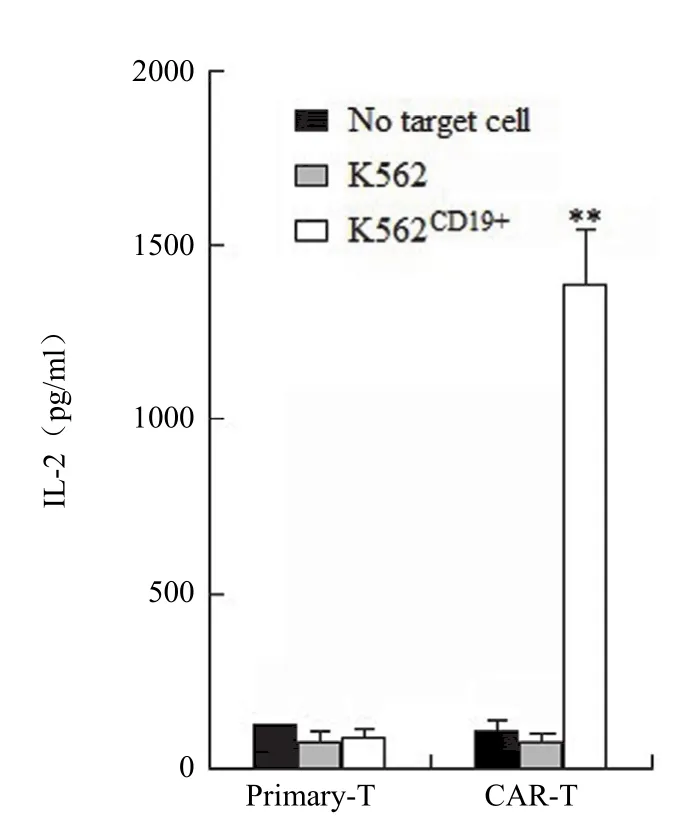
图3 CAR-T 细胞与靶细胞共培养后分泌 IL-2 检测(**P< 0.01)Figure 3 IL-2 secretion of CAR-T and primary-T assayed by ELISA (**P < 0.01)

图4 CAR-T 对靶细胞杀伤作用的镜检图(A:CAR-T 细胞 + K562CD19+ 细胞;B:Primary-T 细胞 + K562 细胞;C:CAR-T细胞 + K562 细胞;D:K562CD19+ 细胞)Figure 4 Results for killing effect of CAR-T cells (A: CAR-T + K562CD19+; B: Primary-T + K562; C: CAR-T + K562;D: K562CD19+)
T 细胞激活后分泌多种细胞因子发挥免疫活性,其中 IL-2 分泌量常被用来评价 T 细胞的活化水平。通过 ELISA 分析发现(图 3),CAR-T 细胞仅在与具有 CD19 表面抗原的 K562CD19+细胞共培养的时候,才具有分泌大量 IL-2 的能力,其IL-2 分泌量达 1387.33 pg/ml,显著高于无靶细胞组和 K562 靶细胞组(**P< 0.01),表明 CAR-T 细胞能够被 CD19 蛋白分子特异性激活。同时,CAR-T 细胞相对于 primary-T 细胞,对 K562CD19+细胞有特异性识别能力,primary-T 细胞并不能被K562CD19+细胞激活。
2.5 CAR-T 细胞有效杀伤 CD19 阳性细胞
靶向杀伤肿瘤细胞是 CAR-T 细胞的设计、构建和实施目标。镜检结果表明,同 CAR-T 细胞共培养实验组相对于其他对照组,个体较大的靶细胞K562CD19+的细胞数量明显变少(图 4)。进一步通过 LDH 释放实验定量检测 CAR-T 细胞的杀伤能力。图 5表明,随着效靶比逐渐升高(效应细胞:靶细胞依次为 1.25:1、2.5:1、5:1、10:1),细胞杀伤的细胞裂解只有 CAR-T 与 K562CD19+细胞共孵育的一组显著升高,其余两组有轻微升高。在效靶比 2.5:1、5:1、10:1 时,CAR-T 对 K562CD19+的杀伤作用明显高于两个对照组(P< 0.05,图 5)。镜检结果和 LDH 释放实验均表明,CAR-T 细胞针对 K562CD19+细胞具有靶向性的杀伤作用,并且在一定范围内杀伤作用随着效靶比升高而升高。
3 讨论
生物技术,尤其是合成生物学技术生产的生物药物作为化学药物的补充,已经开始在临床方面展示了巨大的活力,并服务于公众健康[11]。生物技术药物因其本质上的生物学特性而具有更好的特异性,进而在机体内具有高效、低毒的治疗特点,例如免疫检查点阻断剂 PD-1 抗体和过继性免疫细胞 CAR-T。合成生物学构建逻辑门的思路和方法为 CAR-T 的快速进化和发展提供了理论设计和实施基础[12-13]。针对耐药/复发急性 B 淋巴细胞白血病(B-ALL),免疫细胞治疗在血液学水平和分子学水平使患者获得极大程度的缓解[14]。CAR-T疗法作为一种新型细胞免疫疗法在血液肿瘤和实体瘤方面都取得了重要进展[15],本研究的结果表明表达抗 CD19 受体的 T 细胞可以对 ALL 产生强大的细胞毒性作用,靶向性杀伤肿瘤细胞。
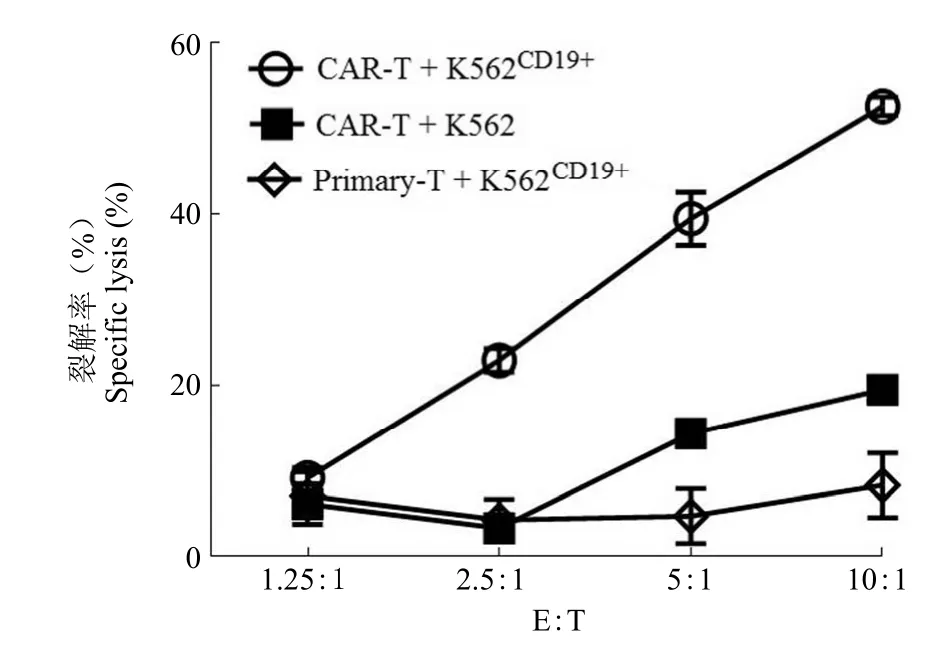
图5 CAR-T细胞在不同效靶比时的杀伤效果折线图Figure 5 Cell lysis at indicated effect: target ratios of CAR-T cells and primary-T cells
CAR-T 细胞最关键的指标之一就是其对特异性靶细胞的杀伤效率,在较低的效靶比下取得较高的杀伤效率是 CAR-T 研发的追求目标之一[16]。较高的杀伤率不仅能够降低慢病毒等高成本的耗用,还可以降低癌症患者回输所需的嵌合抗原受体修饰的 T 细胞个数,解决因化疗/放疗等因素造成的T 淋巴细胞偏低而体外培养扩增较慢的问题。本项目研究中,在效靶比仅为 2.5:1 时,杀伤效率就可以达到约 22%。
作为 CAR-T 细胞关键性的评价指标,杀伤效率比较常用的评价方法有51Cr 释放实验法、LDH释放实验法、CCK-8 法和 MTT 活性检测。51Cr 释放实验法由于放射性污染的问题适用范围小、安全性差。最常用的替代方法 LDH 释放实验法操作要求非常严格,影响因素较多,诸如培养基、pH 值、温度、底物显色时间和加终止剂等,尤其是效应细胞本身即对显色环境产生影响。CCK-8 法和 MTT活性检测较为粗放,不能精确反映细胞杀伤的作用。本课题组正在探究流式细胞染色分析 CAR-T细胞对靶细胞杀伤效率的评价方法,有望对现有方法进行改进。
本研究利用肿瘤过继性免疫治疗策略,探究了特异性靶向 CD19 表型细胞的 CAR-T 细胞用于B-ALL 治疗的作用。本研究克隆构建了能够自剪的荧光报告的 CAR 分子,并通过慢病毒感染的方式实现了其在 T 细胞中的高效表达(约 50%)。通过细胞因子 IL-2 释放实验和 LDH 评价杀伤实验验证了该 CAR-T 对 CD19 表型细胞的特异识别和杀伤。结果表明随着效靶比的升高,抗 CD19 CAR-T 对肿瘤细胞的杀伤率也逐渐提高。本研究结果为应用抗 CD19 CAR-T 细胞用于过继性免疫细胞治疗的研究提供了基础。
[1] Ling Y, Duan HQ, Chen HP. Synthetic biology. Bull Acad Milit Med Sci, 2006, 30(6):572-574. (in Chinese)凌焱, 段海清, 陈惠鹏. 合成生物学. 军事医学科学院院刊, 2006,30(6):572-574.
[2] Lienert F, Lohmueller JJ, Garg A, et al. Synthetic biology in mammalian cells: next generation research tools and therapeutics. Nat Rev Mol Cell Biol, 2014, 15(2):95-107.
[3] U.S. Food and Drug Administration. FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma --Yescarta is the second gene therapy product approved in the U.S..(2017-10-18) [2017-12-20]. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm581216.htm.
[4] Fesnak AD, June CH, Levine BL. Engineered T cells: the promise and challenges of cancer immunotherapy. Nat Rev Cancer, 2016, 16(9):566-581.
[5] Bhojwani D, Pui CH. Relapsed childhood acute lymphoblastic leukaemia. Lancet Oncol, 2013, 14(6):e205-e217.
[6] Morgan RA, Dudley ME, Wunderlich JR, et al. Cancer regression in patients after transfer of genetically engineered lymphocytes. Science,2006, 314(5796):126-129.
[7] Sadelain M, Brentjens R, Rivière I. The basic principles of chimeric antigen receptor design. Cancer Discov, 2013, 3(4):388-398.
[8] Turtle CJ, Riddell SR, Maloney DG. CD19-targeted chimeric antigen receptor-modified T-cell immunotherapy for B-cell malignancies. Clin Pharmacol Ther, 2016, 100(3):252-258.
[9] Kochenderfer JN, Rosenberg SA. Treating B-cell cancer with T cells expressing anti-CD19 chimeric antigen receptors. Nat Rev Clin Oncol,2013, 10(5):267-276.
[10] Kershaw MH, Westwood JA, Darcy PK. Gene-engineered T cells for cancer therapy. Nat Rev Cancer, 2013, 13(8):525-541.
[11] Ling Y, Li YX, Liu G, et al. The basic features and applications of synthetic biology. Chin Med Biotechnol, 2011, 6(3):209-213. (in Chinese)凌焱, 李玉霞, 刘刚, 等. 合成生物学的特征及应用. 中国医药生物技术, 2011, 6(3):209-213.
[12] Fesnak AD, June CH, Levine BL. Engineered T cells: the promise and challenges of cancer immunotherapy. Nat Rev Cancer, 2016, 16(9):566-581.
[13] Esensten JH, Bluestone JA, Lim WA. Engineering therapeutic T cells:From synthetic biology to clinical trials. Annu Rev Pathol, 2017, 12:305-330.
[14] Maino E, Bonifacio M, Scattolin AM, et al. Immunotherapy approaches to treat adult acute lymphoblastic leukemia. Expert Rev Hematol, 2016, 9(6):563-577.
[15] Qian Y, Yang M, Li XM. Research progress of anti-cd19 car-t in the treatment of acute B lymphocytic leukemia. Chin J Clin Rational Drug Use, 2017, 10(7):178-179. (in Chinese)钱怡, 杨敏, 李晓明. 抗 CD19 CAR-T 治疗急性 B 淋巴细胞白血病的研究进展. 临床合理用药杂志, 2017, 10(7):178-179.
[16] An N, Tao Z, Li S, et al. Construction of a new anti-CD19 chimeric antigen receptor and the anti-leukemia function study of the transduced T cells. Oncotarget, 2016, 7(9):10638-10649.
