基于短刺小克银汉霉的芍药苷转化芍药内酯苷研究
2018-04-27施敏马晓彤曹学丽裴海闰韩天郑积敏
施敏,马晓彤,曹学丽,裴海闰,韩天,郑积敏
芍药是我国传统的中药材,具有多种药理作用[1],广泛应用于保健食品、医药等领域[2]。芍药内酯苷和芍药苷是其中主要的活性成分[3],但两者在药理作用上有较明显差别[4]。芍药内酯苷具有抗抑郁作用[5],在促进睡眠、保护脑神经的药理活性甚至超过了芍药苷[6],此外其在镇痛、镇静、抗惊厥、调节免疫力、舒张平滑肌、抗炎、杀灭病原微生物和保护肝脏方面具有显著作用[7]。芍药苷和芍药内酯苷互为同分异构体[8],且在大多数芍药品种中,芍药苷的含量显著高于芍药内酯苷[9]。在芍药内酯苷抗抑郁药物的研发中,不仅需要采用高效的分离手段对两者进行分离,分离出来的芍药苷弃之不用造成资源的大量浪费[10]。所以,我们想到如果能利用微生物转化的方法将芍药苷转化为芍药内酯苷,一方面可以降低双苷分离的难度,另一方面可以极大地提高资源的综合利用度。目前,这方面的研究较少,刘鑫鑫等[11]曾对芍药苷和芍药内酯苷的微生物转化进行过初步研究。从 18 种真菌中筛选出分别对芍药苷和芍药内酯苷具有转化能力的菌株,其中短刺小克银汉霉(Cunninghamella blakesleeanaAS 3.910)、雅致小克银汉霉、华根霉可以将芍药苷转化为芍药内酯苷,但并没有深入研究各个菌种的转化能力。本研究在此基础上,就真菌短刺小克银汉霉转化芍药苷为芍药内酯苷的影响因素进行了系统考察,以芍药苷的转化率和芍药内酯苷的产率为考察指标,对转化工艺进行了优化。构建了较高效的微生物转化体系,提高了短刺小克银汉霉对芍药苷的转化能力,为进一步研究奠定了良好基础。
1 材料与方法
1.1 材料
1.1.1 菌种 短刺小克银汉霉干粉购自中国工业微生物菌种保藏管理中心,编号为 CICC40267。
1.1.2 培养基 种子培养基:马铃薯提取液(取新鲜去皮马铃薯 200 g,切成小块,加水 1.0 L,煮沸 30 min,滤去马铃薯块,将滤液补至 1.0 L)1.0 L、葡萄糖 20.0 g、琼脂15.0 g、自然 pH,121 ℃ 灭菌 15 min,放置于干净的工作台中,常温冷却凝固。 基础培养基:马铃薯提取液 100 ml、葡萄糖 2 g、自然 pH,121 ℃ 灭菌 15 min[12]。
1.1.3 底物 纯度为 96% 的芍药苷粉末由实验室自行制备,配制成 10 mg/ml 的底物甲醇溶液。
1.1.4 试剂 马铃薯(市售);葡萄糖、氯化钠、氢氧化钠、磷酸二氢钾均为分析纯,购于国药集团化学试剂有限公司;无水甲醇、无水乙醇、正丁醇、正己烷均为分析纯,购于北京化工厂;烟酸(国家药品标准物质)购自中国食品药品检定研究院;蛋白胨购自北京奥博星生物技术有限责任公司;甲醇为色谱级,购自赛默飞世尔科技(中国)有限公司。
1.1.5 仪器 Agilent 1260 高效液相色谱仪为美国安捷伦科技有限公司产品;HZQ-F160 全温振荡培养箱为苏州培英实验设备有限公司产品;MJP-250 霉菌培养箱为上海精宏实验设备有限公司产品;1312 SCL 超净台为北京赛伯乐实验仪器有限公司产品;MLS-3020 高压蒸汽灭菌锅为日本Sanyo 电器集团产品;FiveEasy Plus pH 计为梅特勒-托利多仪器(上海)有限公司产品;D-3750 离心机为美国 Sigma公司产品;UB202i 正置生物显微镜为重庆奥浦光电技术有限公司产品;XB.K.25 血球计数板为上海医用光学仪器厂产品。
1.2 方法
1.2.1 菌株活化与菌种孢子液的制备 将购买的短刺小克银汉霉(AS3.910)菌种干粉用 5 ml 无菌水溶解,接种于马铃薯培养基上,在温度为 28 ℃ 的恒温培养箱中培养至菌体产生明显的菌丝,然后再将菌丝接入新的培养基上进行培养,活化 3 次后得到活力较为旺盛的菌体。活化后的菌体,接种至马铃薯平板培养基上,在 28 ℃ 的恒温培养箱中培养至菌丝生长旺盛且孢子丰富的时候,取出培养基,用20 ml 无菌水将平板上的孢子冲洗到无菌的三角瓶中,制成孢子液[13]。然后通过血球计数法,计数孢子液中的孢子个数[14],从而确定接种量。
1.2.2 芍药苷的转化对照实验 设定 1 个实验组 1(菌体+ 芍药苷底物 + 基础培养基),将孢子液转移到转化瓶中(250 ml 的锥形瓶中装 100 ml 的发酵培养基),采用振荡培养的方式,在 28 ℃ 培养 72 h;然后加入 10 mg/ml的芍药苷甲醇溶液 1 ml,使药物浓度为 1 mg/ml,转化反应持续 192 h。加入底物后,每隔 24 小时取 1 ml 的发酵液(菌体经 HPLC 检测发现并无芍药苷与芍药内酯苷),7000 r/min 离心 10 min,取上清液,过滤后,进行 HPLC 分析。初步考察菌体的转化率、产率及转化时间。同时设计2 个对照实验:对照组 1(菌体 + 基础培养基),考察菌体仅在培养基存在下,是否产生芍药内酯苷;对照组 2(芍药苷底物 + 基础培养基),考察芍药苷底物在培养基中是否自动转化成芍药内酯苷。实验组的实验条件也是单因素实验的基础发酵条件。
1.2.3 转化效果的评价方法 HPLC 分析条件:色谱柱为Zorbax SB-C18(200 mm × 4.6 mm,5 μm);流动相为甲醇:0.2% 磷酸水 = 30:70(V/V);流速 1 ml/min;洗脱时间 10 min;柱温 30 ℃;进样量 10 μl;检测波长 230 nm。转化效果用芍药内酯苷的产率和芍药苷的转化率双指标进行评价。分别建立芍药苷与芍药内酯苷的标准曲线,通过标准曲线确定转化前后芍药苷与芍药内酯苷的浓度。计算公式如下:
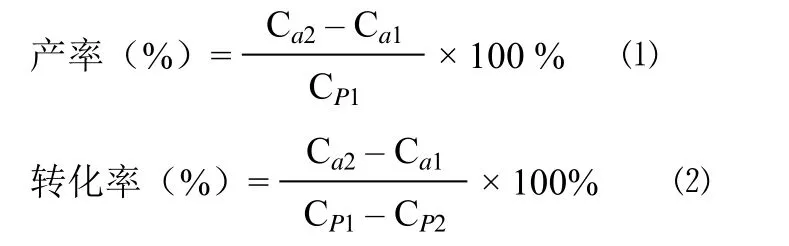
式中,Ca1为芍药内酯苷转化前的浓度;Ca2为芍药内酯苷转化后的浓度;CP1为芍药苷转化前的浓度;CP2为芍药苷转化后的浓度。
1.2.4 影响转化效果的单因素实验 在基础发酵培养基的基础上,本研究考察了添加不同的辅助成分蛋白胨(1、2、3、4、5 g/L)、无机盐 NaCl(1、2、3、4、5 g/L)、烟酸(0.1、0.2、0.4、0.5、0.6 g/L)等和不同培养条件,如最适 pH(4、5、6、7、8),转化时间(24、48、72、96、120、144、168、192 h),底物溶媒(甲醇、50% 甲醇-水、水、乙醇),摇床转速(150、200、250、300 r/min),接种量(1%、3%、5%、7%)、底物浓度(0.10、0.15、0.20、0.25、0.30 g/L)以及菌株培养时间(24、36、48、60、72、84 h)对产率及转化率的影响。
1.2.5 转化条件的正交试验优化 在单因素实验的基础上,选定菌种培养时间、底物浓度、蛋白胨浓度、烟酸浓度作为正交实验的 4 个因素,每个因素各自选择 3 个水平,忽略因素之间的相互作用,采用 L9(34) 正交试验设计(表 1)确定最佳转化条件。

表1 芍药苷转化条件的正交优化实验设计
2 结果
2.1 标准曲线的建立
首先对芍药苷与芍药内酯苷的对照品进行检测,得到 HPLC 色谱图(图 1),由图可知芍药苷的出峰时间为6.4 min,芍药内酯苷的出峰时间为 4.4 min。
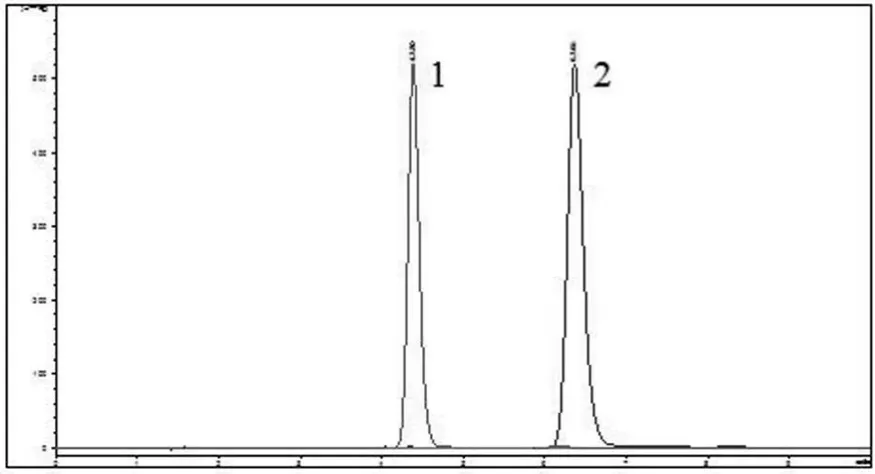
图1 芍药内酯苷(1)和芍药苷(2)对照品的 HPLC 图
分别配制不同浓度梯度的芍药苷和芍药内酯苷,利用HPLC 测定不同浓度下的芍药苷与芍药内酯苷的峰面积,建立两者的标准曲线(图 2 和图 3)。

图2 芍药内酯苷的标准曲线
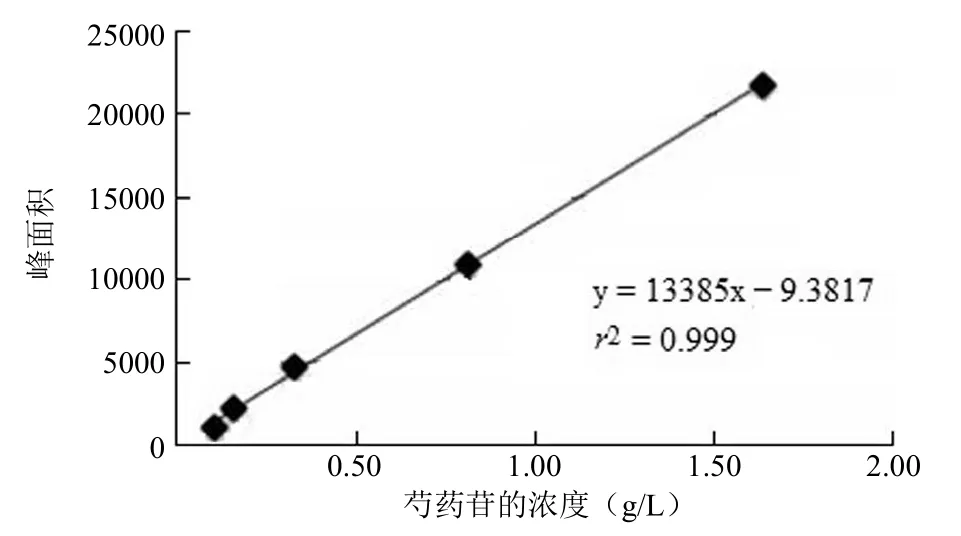
图3 芍药苷的标准曲线
2.2 对照实验结果
对实验组与对照组转化前后的样品进行分析。由对照组 1 的结果发现,短刺小克银汉霉不能在没有底物的情况下自行代谢出芍药内酯苷,转化菌体的发酵产物和培养基的残留成分对转化结果不会有影响(图 4);根据对照组 2 的结果,芍药苷不能在无菌种的发酵液中直接转化为芍药内酯苷,发酵液中不存在非生物对该转化反应的干扰(图 5);实验组 1 的结果表示在菌体、底物和培养基共存时,该菌体具有将芍药苷转化为芍药内酯苷的作用(图 6)。
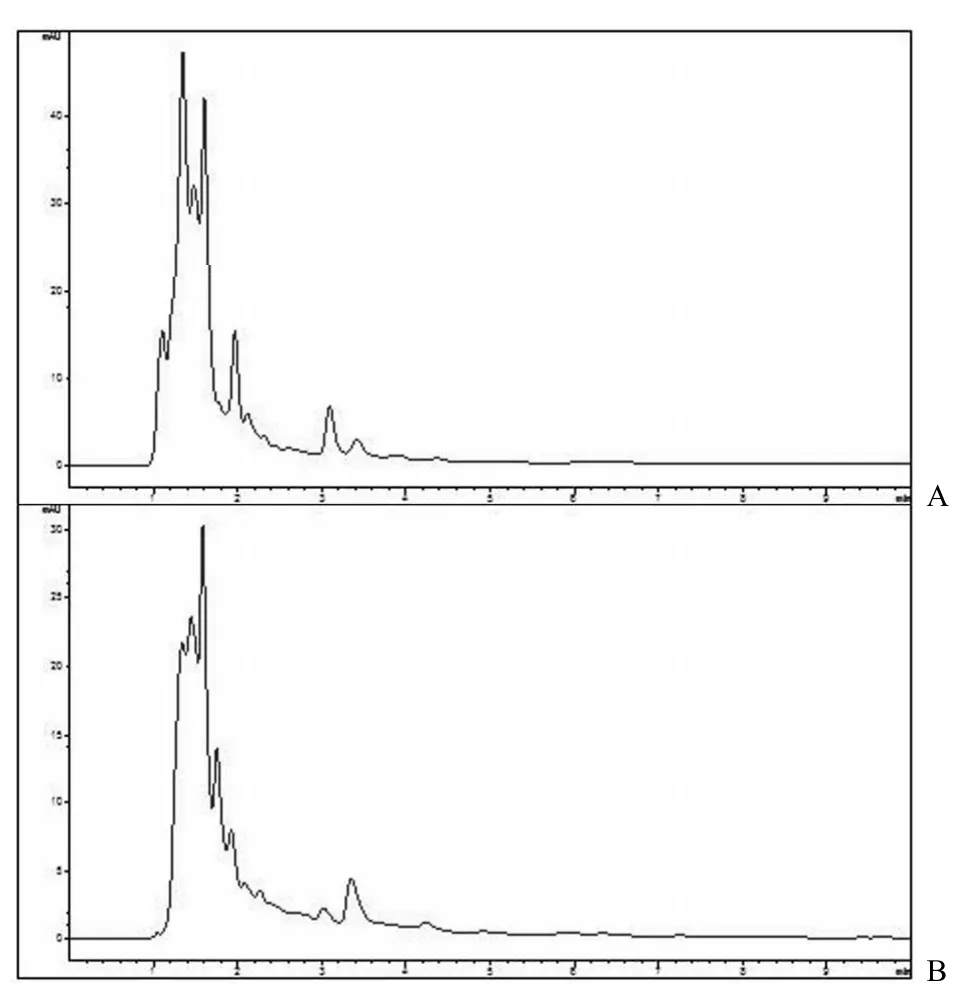
图4 对照组 1(菌体 + 培养基)的 0 h 取样(A)与168 h 取样(B)的 HPLC 色谱图

图5 对照组 2(底物 + 培养基)的 0 h 取样(A)与168 h 取样(B)HPLC 图(1:芍药内酯苷;2:芍药苷)
通过对实验组 1 不同培养时间的取样分析(图 7)可见,随着转化时间的延长,芍药内酯苷的产率和芍药苷的转化率均不断提高,在 168 h 达到产率(5.43 ± 0.12)% 与转化率(11.39 ± 0.38)% 的高值,之后出现下降趋势。因此,初步确定转化时间为 168 h。
2.3 单因素对转化效果的影响
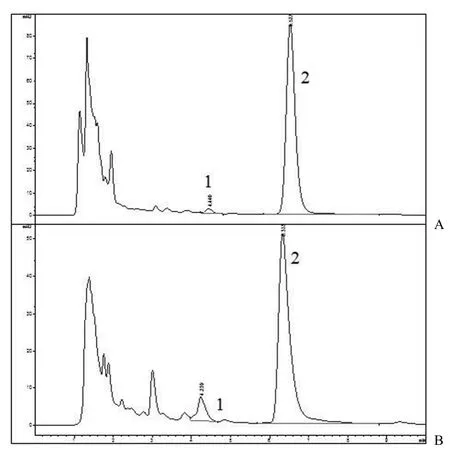
图6 实验组 1(菌体 + 底物 + 培养基)0 h 取样(A)与 168 h 取样(B)HPLC 色谱图(1:芍药内酯苷;2:芍药苷)
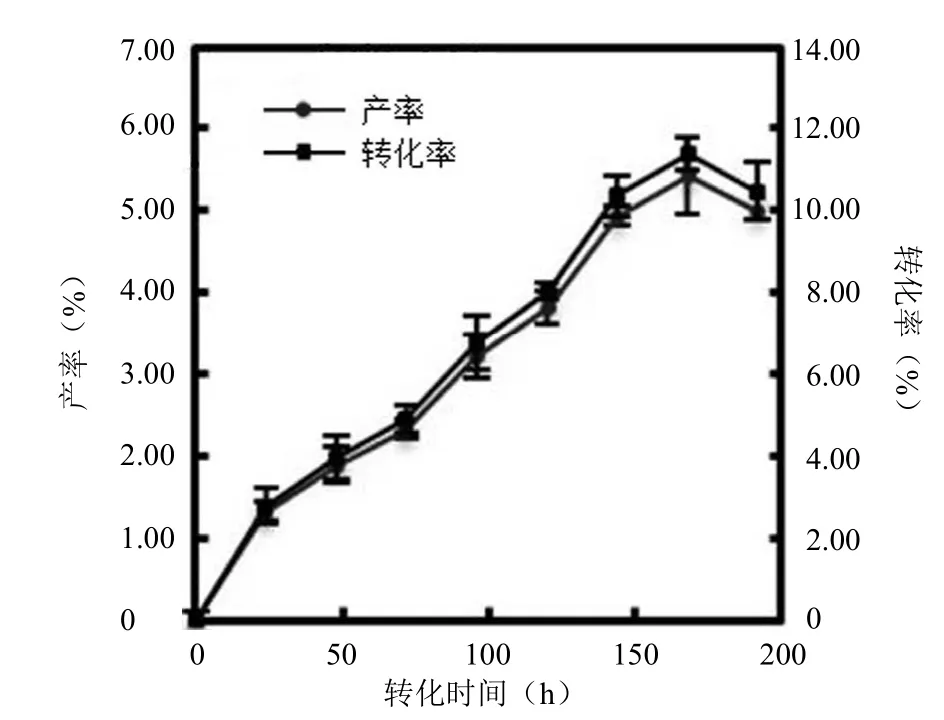
图7 实验组不同时间的取样结果
2.3.1 培养基的影响 氮源、无机盐和维生素等培养基成分会对菌体转化能力产生一定的影响[15],本研究主要考察了不同的蛋白胨浓度、NaCl 浓度、烟酸浓度下菌体的转化能力,结果见图 8 ~ 图 10。从结果可知,在蛋白胨浓度为4 g/L,NaCl 浓度为 2 g/L,烟酸浓度为 0.3 g/L 时菌体有较好的转化率和产率,其中蛋白胨浓度对转化率和产率的影响较大。添加蛋白胨可以大幅提高转化率,从(11.39 ±0.38)% 提高至(26.05 ± 1.52)%,但浓度过高时,转化率有下降的趋势。说明蛋白胨是短刺小克银汉霉必要的营养物质,但对其添加量需要严格控制。
2.3.2 菌株的影响
2.3.2.1 菌株培养时间的影响 菌株培养时间指加入底物前菌种的培养时间[16]。菌体生长时间较短,由于还没生长到生长代谢最旺盛的对数期,密度不够,转化率较低。菌种生长时间过长,密度虽然高,但菌体活力降低,故要选择合适的菌株培养时间[17]。在发酵液接种后,分别在培养 24、36、48、60、72、84 h 再加底物,考察菌株培养时间对转化率的影响,结果(图 11)表明培养时间为 60 h 有较高的产率和转化率。

图8 培养基中蛋白胨浓度对菌株转化能力的影响

图9 培养基中 NaCl 浓度对菌株转化能力的影响

图10 培养基中烟酸浓度对菌株转化能力的影响
2.3.2.2 菌株接种量的影响 菌种的添加比例对微生物发酵转化有很大的影响[18],主要影响微生物转化启动的时间[19]。将 28 ℃ 培养 7 d 的平板,用无菌水制成孢子悬浮液[20],调整浓度,通过血球计数法得到浓度为 2 × 106个/ml的孢子原液。向 100 ml 的发酵液中加入 0.5、1.5、2.5 和3.5 ml 的孢子原液,达到设定接种量 1%、3%、5%、7%,以此考察不同接种量对短刺小克银汉霉转化芍药苷为芍药内酯苷能力的影响,结果见图 12。可以看出接种量为 3%时,有较好的转化率与产率。

图11 菌株培养时间对转化效果的影响
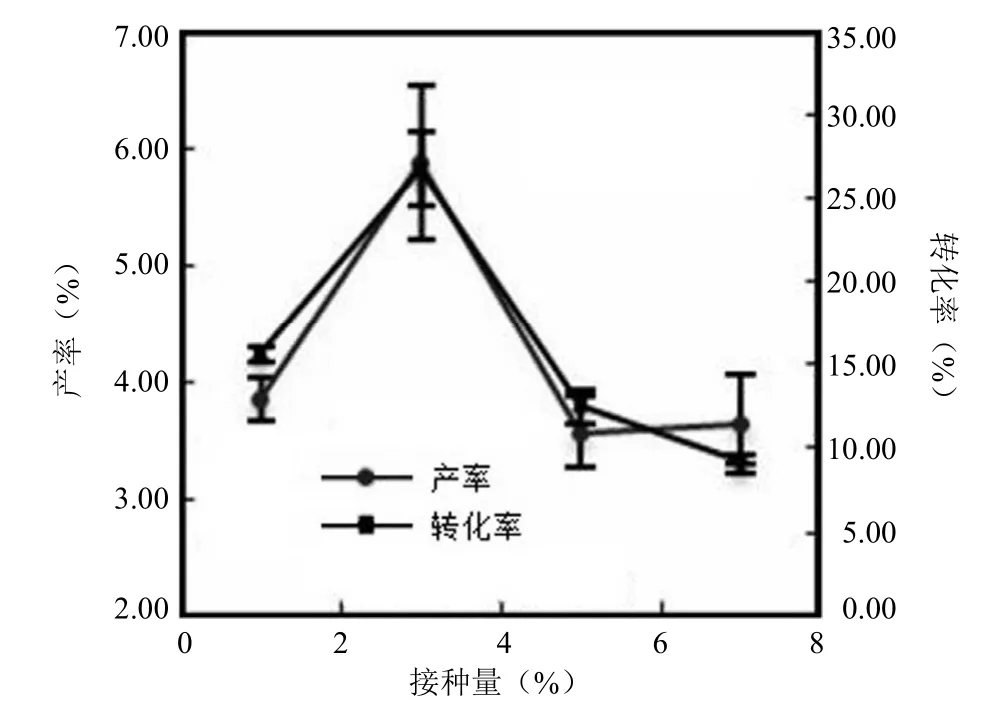
图12 不同接种量对转化效果的影响
2.3.3 底物对转化率的影响
2.3.3.1 底物浓度的影响 在微生物转化体系中,底物浓度对菌体的转化能力有着较明显的影响[21]。所以,在基础转化与发酵条件下,向 100 ml 发酵液中分别添加 1、1.5、2、2.5 和 3 ml 的 10 mg/ml 的底物甲醇混合液。结果见图 13,在设定的底物浓度范围内,当底物浓度为 0.15 g/L时,芍药苷有较好的转化率(19.87 ± 1.07)%。超过 0.15 g/L时,转化率呈现下降趋势,这表明转化体系的转化能力有限,也反映出底物的细胞毒性可能会对转化产生抑制。
2.3.3.2 溶媒的影响 底物在发酵液中的溶解能力较低是微生物转化效率较低的主要原因[22],因此,本实验研究了不同溶媒对微生物转化效率的影响。
由于有机溶剂对短刺小克银汉霉的转化能力有较大影响,分别用甲醇、50% 甲醇-水溶液、水以及乙醇等溶液溶解底物,考察不同溶媒对转化率的影响,结果如图 14 所示,用甲醇溶解底物,能使短刺小克银汉霉有较好的转化率和产率,所以选定甲醇作为芍药苷的溶媒。

图13 底物浓度对转化效果的影响
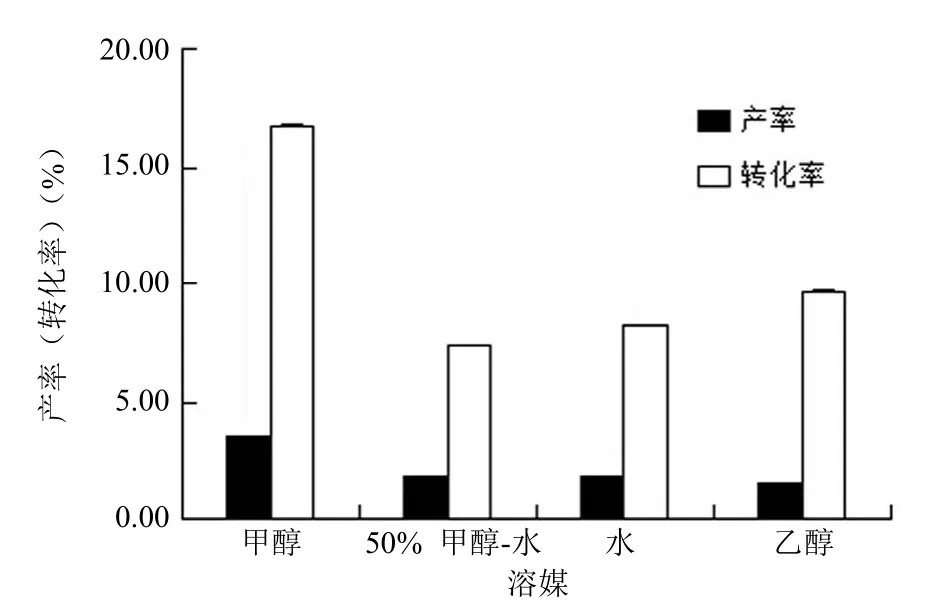
图14 溶媒对转化效果的影响
2.3.4 发酵条件的影响
2.3.4.1 初始 pH 值的影响 pH 值的变化会引起菌体细胞通透性与酶活力的变化,并影响菌体对营养物质的利用率,从而影响菌体的生长及代谢活动。适当的 pH 值将有利于短刺小克银汉霉的菌体生长及菌种活力[23],同时影响转化效率。因此考察不同 pH 值对短刺小克银汉霉转化芍药苷转化率与芍药内酯苷产率的影响,结果见图 15。在 pH为 6 时,该菌有较好的转化能力。

图15 培养基 pH 值对芍药苷内酯产率及芍药苷转化率的影响
2.3.4.2 转速的影响 摇床转速直接影响底物与菌体的接触程度,同时影响催化反应中氧气的供给[24],本实验考察了 150、200、250 和 300 r/min 4 个转速条件下短刺小克银汉霉对芍药苷的转化能力。由图 16 可以看出,当摇床转速为 250 r/min 时,该菌的催化效果最好,转化率与产率较高;当转速为 150 r/min 时,催化反应的氧气供应不足,造成转化产率大幅度下降[25];当转速为 300 r/min 时,该菌的转化产率也较低,可能是因为转速过高,菌体的生长与代谢受到较大影响,并且大部分的菌出现挂壁现象,从而影响了转化率。所以,转化的最适转速为 250 r/min。

图16 转速对转化效果的影响
实验结果表明,影响转化效果的因素有很多。综合考虑,根据单因素实验,对培养基中的烟酸浓度、NaCl 浓度、培养基初始 pH 值、摇床转速、底物溶媒、接种量等因素进行了优化定值,选取单因素条件下的最佳值作为后续的实验条件。对涉及菌种、培养基、底物和转化条件 4 方面的关键影响因素,包括菌株培养时间、蛋白胨浓度、底物浓度和转化时间 4 个因素进行了进一步正交试验优化。
2.4 正交试验对转化条件的优化
正交试验结果见表 2,转化效果最佳的条件:培养时间为 48 h,转化时间的最好水平是 144 h,底物的最佳浓度为0.15 g/L,蛋白胨的最佳浓度为 5 g/L。
综合单因素和正交试验的结果,得出最佳的转化工艺条件为:蛋白胨浓度 5 g/L,NaCl 浓度 2 g/L,烟酸浓度0.3 g/L,菌种培养时间 48 h,接种量 3%,培养基 pH 6,转速 250 r/min,转化时间 144 h,底物浓度 0.15 g/L,甲醇作为底物的溶媒。在优化的转化工艺条件下,进行 3 次验证实验,测得短刺小克银汉霉对芍药苷的转化率为(43.00 ±2.73)%,芍药内酯苷的产率为(9.29 ± 0.10)%。
3 结论
为了构建一套高效的基于短刺小克银汉霉的芍药苷转化芍药内酯苷的微生物转化体系和工艺,考察了菌种、培养基、底物和转化条件等 4 方面的影响因素,通过单因素试验和正交试验优化了一套较为高效的转化工艺条件。与基础发酵条件下相比,在优化体系和优化的工艺条件下,芍药苷的转化率从(11.39 ± 0.38)% 提高至(43.00 ± 2.73)%,芍药内酯苷的产率从(5.43 ± 0.12)% 提升至(9.29 ±0.10)%,转化效果有了显著提高。但是芍药内酯苷的产率仍然较低,其中一个原因是在芍药苷转化为芍药内酯苷的过程中,有其他物质的产生,芍药内酯苷并非唯一转化产物。要提高芍药内酯苷的转化产率还需进一步研究其中起转化作用的关键酶,并通过分子生物学手段对其进行代谢调控,提高其表达量和转化活性。
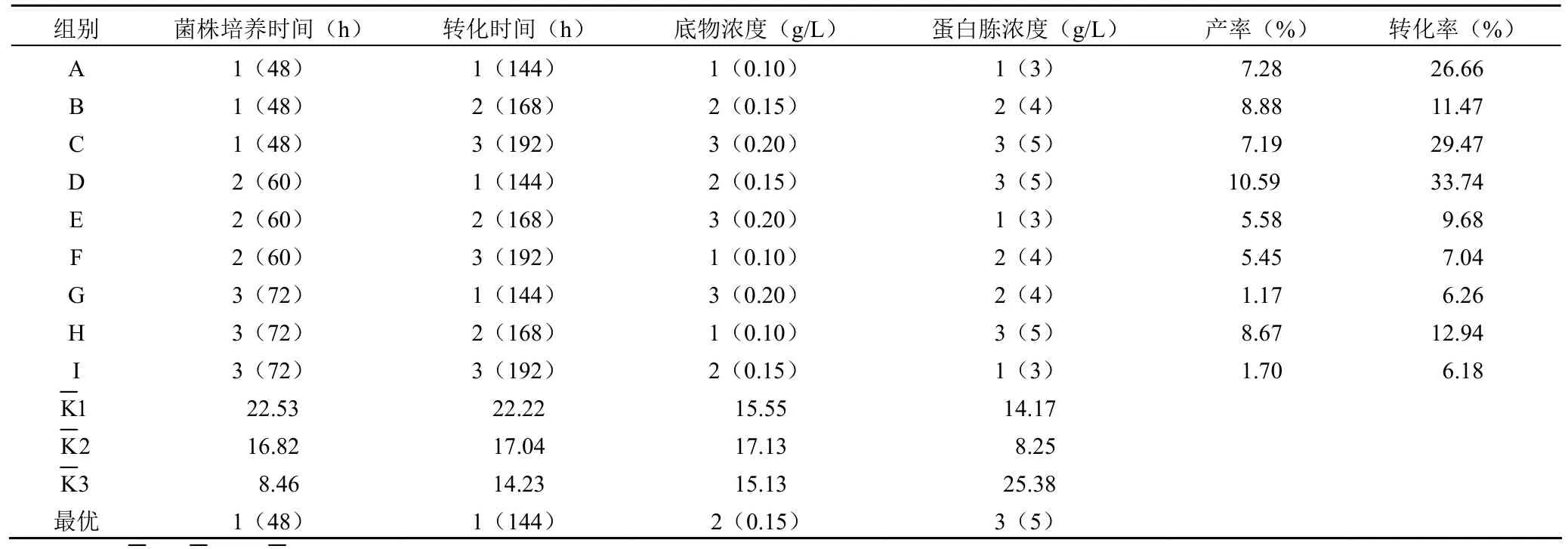
表2 正交试验设计的优化结果
[1] Miao YP, Yang J. Research and analysis on chemical constituents and pharmacological effect of herbaceous peony. World Latest Med Inf,2015, 15(59):1-2. (in Chinese)苗艳平, 杨晶. 芍药化学成分和药理作用的研究及分析. 世界最新医学信息文摘(连续型电子期刊), 2015, 15(59):1-2.
[2] Zhang ZG. Antianxiety and sleep disorder improving use of albiflorin or metabolite thereof in: CN, 201180051467.3. 2013-06-26. (in Chinese)张作光. 芍药内酯苷或其代谢物的抗焦虑及改善睡眠障碍的用途:中国, 201180051467.3. 2013-06-26.
[3] Wang ZL. Pharmacological effects comparison of radix paeoniae rubra and radix paeoniae alba. China Contin Med Educ, 2016,(3):199-200. (in Chinese)王忠良. 赤芍与白芍的药理作用比较. 中国继续医学教育, 2016,(3):199-200.
[4] Yang HL, Yu W, Zhou HB. The research progress of paeonia lactiflora lactone glycosides. J Front Med, 2016, 6(28):6-8. (in Chinese)杨海玲, 俞伟, 周海滨. 芍药内酯苷研究进展. 医药前沿, 2016,6(28):6-8.
[5] Zhu YL, Wang LY, Zhao DP, et al. Blood-enriching effects and mechanism of albiflorin and paeoniflorin on immunosuppressional model mice with blood deficiency pattern. J Beijing Univ Traditional Chin Med, 2016, 39(3):204-207. (in Chinese)朱映黎, 王林元, 赵丹萍, 等. 芍药内酯苷、芍药苷对血虚免疫抑制小鼠的补血作用及机制. 北京中医药大学学报, 2016, 39(3):204-207.
[6] Zhao ZX. Preclinical pharmacokinetics of paeoniflorin. Jinan:University of Jinan, 2015. (in Chinese)赵朕雄. 芍药内酯苷临床前药代动力学研究. 济南: 济南大学, 2015.
[7] Ruan JL, Zhao ZX, Zeng QZ, et al. Recent advances in study of components and pharmacological roles of Radix Paeoniae Rubra.Chin Pharmacol Bull, 2003, 19(9):965-970. (in Chinese)阮金兰, 赵钟祥, 曾庆忠, 等. 赤芍化学成分和药理作用的研究进展. 中国药理学通报, 2003, 19(9):965-970.
[8] Ge ZW, He Q, Lin YJ, et al. RP-HPLC determination of paeoniae alba lotus and its pieces of paeoniflorin, paeoniflorin and benzoyl paeonifloril. Chin Traditional Herbal Drugs, 2008, 39(3):378-380. (in Chinese)葛志伟, 贺庆, 林云径, 等. RP-HPLC法测定杭白芍及其饮片中芍药内酯苷、芍药苷和苯甲酰芍药苷. 中草药, 2008, 39(3):378-380.
[9] Liu J, Chen L, Fan CR, et al. Qualitative and quantitative analysis of major constituents of Paeoniae Radix Alba and Paeoniae Radix Rubra by HPLC-DAD-Q-TOF-MS/MS. China J Chin Materia Med, 2015,40(9):1762-1770. (in Chinese)刘杰, 陈琳, 范彩荣, 等. 基于HPLC-DAD-Q-TOF-MS/MS的白芍和赤芍主要成分定性定量研究. 中国中药杂志, 2015, 40(9):1762-1770.
[10] Yu HM, Huang MQ, Xiang Q, et al. Rapid separation, preparation and identification of terpenoid glycosides from paeony. Fujian J Traditional Chin Med, 2015, 46(2):37-39. (in Chinese)于虹敏, 黄鸣清, 向青, 等. 白芍萜苷类成分的快速分离制备及结构鉴定. 福建中医药, 2015, 46(2):37-39.
[11] Liu XX, Ma XC, Huo CH, et al. Microbiological transformation of paeoniflorin and albiflorin. China J Chin Materia Med, 2010, 35(7):872-875. (in Chinese)刘鑫鑫, 马骁驰, 霍长虹, 等. 芍药苷和芍药内酯苷的微生物转化.中国中药杂志, 2010, 35(7):872-875.
[12] Wang X, Xu W, You S. Application of microbialtransformation in pharmacology. J Shenyang Pharm Univ, 2006, 23(7):477-482. (in Chinese)王旭, 徐威, 游松. 微生物转化在药学中的应用. 沈阳药科大学学报, 2006, 23(7):477-482.
[13] Xu MM, Wang JF, Xu C, et al. Microbial transformation of glycosides in traditional Chinese medicine: Mechanism and application. World Sci Technol Modernization Traditional Chin Med Materia Med, 2006,8(2):24-27. (in Chinese)徐萌萌, 王建芳, 徐春, 等. 微生物转化苷类中药的机理及应用.世界科学技术-中医药现代化, 2006, 8(2):24-27.
[14] Li AH, Yue SJ, Ma HB. Correlativity of three counting methods of fungal spore. J Microbiol, 2006, 26(2):107-110. (in Chinese)李爱华, 岳思君, 马海滨. 真菌孢子三种计数方法相关性的探讨.微生物学杂志, 2006, 26(2):107-110.
[15] Sun L, Huang HH, Liu L, et al. Transformation of verapamil by Cunninghamella blakesleeana. Appl Environ Microbiol, 2004, 70(5):2722-2727.
[16] Valentino F, Beccari M, Villano M, et al. Effect of culture residence time on substrate uptake and storage by a pure culture of Thiothrix(CT3 strain) under continuous or batch feeding. N Biotechnol, 2017,36:1-7.
[17] Siddiqui M, Ahmad MS, Wahad AT, et al. Biotransformation of a potent anabolic steroid, mibolerone, with Cunninghamella blakesleeana, C. echinulata, and Macrophomina phaseolina, and biological activity evaluation of its metabolites. PLos One, 2017,12(2):e0171476.
[18] Ahmad MS, Farooq R, Hussain N, et al. Three new analogues of androgenic drug mesterolone through biotransformation with Cunninghamella blakseleeana. J Mol Catalysis B Enzymatic, 2016,133(Suppl 1):S395-S399.
[19] Baydoun E, Atia-tul-Wahab, Mehmood H, et al. Microbial transformation of danazol with Cunninghamella blakesleeana, and anti-cancer activity of danazol and its transformed products. Steroids,2016, 105:121-127.
[20] Demyttenaere JCR, De Pooter HL. Biotransformation of citral and nerol by spores of Penicillium digitatum. Flavour Fragrance J, 2015,13(3):173-176.
[21] Ahmad MS, Yousuf S, Atia-Tul-Wahab, et al. Biotransformation of anabolic compound methasterone with Macrophomina phaseolina,Cunninghamella blakesleeana, and Fusarium lini, and TNF-α inhibitory effect of transformed products. Steroids, 2017, 128:75-84.
[22] Wu DX, Li JH, Wang HQ, et al. 11β-hydroxylation of 16α,17α-epoxyprogesterone by cunninghamella blakesleeana ATCC 8688a. J Chem Eng Chin Univ, 2012, 26(1):77-83. (in Chinese)吴冬香, 李久红, 王海清, 等. 短刺小克银汉霉菌 11β羟化环氧黄体酮研究. 高校化学工程学报, 2012, 26(1):77-83.
[23] Kuban M, Ongen G, Bedir E. Biotransformation of cycloastragenol by Cunninghamella blakesleeana NRRL 1369 resulting in a novel framework. Org Lett, 2010, 12(19):4252-4255.
[24] Fan HX, Zhou ZQ, Peng J, et al. A microbial model of mammalian metabolism: biotransformation of 4,5-dimethoxyl-canthin-6-one using Cunninghamella blakesleeana CGMCC 3.970. Xenobiotica, 2017,47(4):284-289.
[25] Wu LP, Bai LL, Han CF, et al. Microbiological transformation of ginsenoside Rb1 into C-K. Ginseng Res, 2016, 28(2):7-11. (in Chinese)武伦鹏, 白龙律, 韩春峰, 等. 微生物转化人参主要皂苷 Rb1为C-K的研究. 人参研究, 2016, 28(2):7-11.
