非诺贝特对胰岛素抵抗大鼠脂肪甘油三酯脂酶表达的影响
2018-04-26祝超瑜肖元元叶阳刘梦丹曾媛媛魏丽
祝超瑜 肖元元 叶阳 刘梦丹 曾媛媛 魏丽
[摘要] 目的 观察非诺贝特对胰岛素抵抗大鼠组织中脂肪甘油三酯脂酶(ATGL)表达的影响。 方法 将8周龄雄性SD大鼠随机分为普食组(NC组,n = 8)及高脂组(HFD组,n = 16),8周后再将HFD组随机分为高脂对照组(HFD-UT组)及非诺贝特治疗组(HFD-FT组)。检测各组大鼠生化指标,并用胰岛素耐量试验(ITT)、口服葡萄糖耐量试验(OGTT)判断大鼠的胰岛敏感性。通过Western blot方法检测脂肪、肝脏、肌肉组织中ATGL的表达情况。 结果 高脂饮食喂养后大鼠产生胰岛素抵抗,脂肪、肝脏、肌肉组织中ATGL蛋白较NC组分别降低,差异有高度统计学意义(P < 0.01),用非诺贝特治疗后,胰岛素敏感性增加,同时,脂肪、肝脏、肌肉组织中ATGL的表达较HFD-UT组增加,差异有统计学意义(P < 0.01或P < 0.05)。 结论 非诺贝特能促进胰岛素抵抗大鼠脂肪、肝脏、肌肉三大代谢组织中ATGL的表达。
[关键词] 高脂饮食;脂肪甘油三酯脂酶;胰岛素抵抗;非诺贝特
[中图分类号] R589.2 [文献标识码] A [文章编号] 1673-7210(2018)02(a)-0004-05
Effects of Fenofibrate on adipose triglyceride lipase in insulin resistant rats
ZHU Chaoyu XIAO Yuanyuan YE Yang LIU Mengdan ZENG Yuanyuan WEI Li
Department of Endocrinology and Metabolism, the Sixth People's Hospital, Shanghai Jiao Tong University Shanghai Diabetes Institute Shanghai Key Laboratory of Diabetes Mellitus Shanghai Clinical Center for Diabetes, Shanghai 200233, China
[Abstract] Objective To detect the effects of Fenofibrate on the expression of adipose triglyceride lipase (ATGL) in tissues of insulin resistant rats. Methods Eight-week old male SD rats were randomly divided into normal diet group (NC group, n = 8) and high fat diet group (HFD group, n = 16). After 8 weeks, the rats in the HFD group were divided into untreated (HFD-UT) group and Fenofibrate treatment (HFD-FT) group. The biochemical indices of all groups were detected, and the insulin sensitivity was detected by oral glucose tolerance (OGTT) and insulin tolerance (ITT). Western blot was used to assay ATGL protein in epididymal adipose, liver and muscle. Results High fat diet led to insulin resistance, ATGL in adipose tissue, liver and muscle in HFD-UT group were decreased compared with those of NC group, the differences were highly statistically significant (P < 0.01). After Fenofibrate treatment, the insulin sensitivity was improved, and the ATGL levels in adipose tissue, liver and muscle were increased compared with those of HFD-UT group, the differences were statistically significant (P < 0.01 or P < 0.05). Conclusion Fenofibrate can enhance the ATGL levels in adipose tissue, liver and muscle of insulin resistant rats.
[Key words] High fat diet; Adipose triglyceride lipase; Insulin resistance; Fenofibrate
脂肪甘油三酯脂酶(adipose triglyceride lipase,ATGL)是三酰甘油(TG)水解的限速酶[1]。ATGL主要在脂肪組织中产生,在肝脏、肌肉等代谢器官中也有表达。TG的异位沉积能破坏胰岛素信号的传导[2],而作为胰岛素作用的靶器官,脂肪、肝脏、肌肉三个组织中TG的代谢显得尤为重要,探讨ATGL在这三大组织中的作用将有助于进一步明确脂代谢异常在胰岛素抵抗过程中的作用。基因转录因子过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)在脂肪酸氧化代谢活跃的组织中,如脂肪、肝脏、骨骼肌、肾、小肠等,都有表达,主要参与脂肪酸的氧化及能量的消耗。PPARɑ受体激动剂类药物非诺贝特可改善高甘油三酯血症及炎性反应[3],有研究证明其通过降低血脂有改善胰岛素敏感性的作用[4],最新研究显示其有延缓脂肪肝的作用[5],但是其对改善组织中TG沉积的作用机制目前尚不清楚。笔者前期研究已经发现胰岛素抵抗大鼠ATGL在脂肪、肝脏、肌肉组织中的表达是下降的,为此,我们进一步使用非诺贝特治疗胰岛素抵抗大鼠,观察其在改善胰岛素抵抗的同时对组织中ATGL表达的作用。
1 材料与方法
1.1 实验动物
清洁级标准健康8周龄雄性SD大鼠共24只,由上海西普尔-必凯实验动物有限公司提供,合格证号:SCXK(沪)20080016。适应性喂养1周后随机分为普食组(NC组,n = 8)和高脂组(HFD组,n = 16)。8周后,将HFD组随机分为高脂对照组(HFD-UT组,n = 8)和非诺贝特治疗组(HFD-FT组,n = 8),HFD-FT组给予非诺贝特[雅培,美国,溶于0.9%生理盐水,100 mg/(kg·d)]灌胃,NC组和HFD-UT组同时予以生理盐水[10 mL/(kg·d)]灌胃。第9周开始每天下午5:00~6:00进行灌胃,每天1次,共4周。
1.2 实验材料及试剂
普通饲料,热量配比:糖类占总热量的55%,蛋白质占总热量的21%,脂肪占总热量的24%,热量约为3.8 kcal/g。高脂饲料,热量配比:糖类占总热量的20%,蛋白质占总热量的21%,脂肪(以猪油为主)占总热量的59%,热量约为5.2 kcal/g。均由中国科学院上海斯莱克实验动物有限公司提供。
羊抗鼠ATGL单克隆抗体(NOVUS,美国);兔抗鼠adiponectin单克隆抗体(Cell Signaling,美国);兔抗鼠β-actin多克隆抗体(Cell Signaling,美国);兔抗鼠Erk1/2多克隆抗体(Cell Signaling,美国)。
1.3 方法
1.3.1胰岛素耐量试验(ITT)和葡萄糖耐量试验(OGTT) 喂养12周末每组大鼠分别进行ITT和OGTT。禁食8 h,ITT按0.5 U/kg剂量腹部皮下注射胰岛素(优泌林R,美国礼来公司),分别于0、15、30、60、90、120 min尾静脉取血,以强生血糖仪测定血糖水平;OGTT按2 g/kg剂量予以50%葡萄糖灌胃,分别于0、30、60、90、120 min尾静脉采血测血糖,酶联免疫吸附测定(ELISA)法檢测OGTT各时点血胰岛素水平。
1.3.2 组织TG含量的计算 喂养12周实验结束后,乙醚麻醉处死大鼠,于5 min内取附睾脂肪、肝组织和肌肉组织,称重并立即置于液氮中。采用庚烷-异丙醇-吐温抽提法提取TG,由日立7600 2020自动生化仪测定。
1.3.3 Western blot检测ATGL蛋白的表达 称取一定重量的附睾脂肪、肝脏、肌肉组织,提取组织蛋白。取一定量的蛋白进行SDS-PAGE电泳,并用电转移法将蛋白转移至硝酸纤维素膜,脱脂奶粉封闭过夜,分别加入一抗、二抗孵育,最后应用ECL试剂盒显色反应,X线光片显影。将显影结果扫描后,用Image J软件分别对条带进行灰度值的测定,并以目的蛋白/内参蛋白的比值计算目的蛋白的相对表达量。
1.4 统计学方法
数据处理运用统计分析软件SPSS 13.0统计软件包运算。计量资料以均数±标准差(x±s)表示,检验数据正态性,多组间比较用方差分析,组间均数间比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果
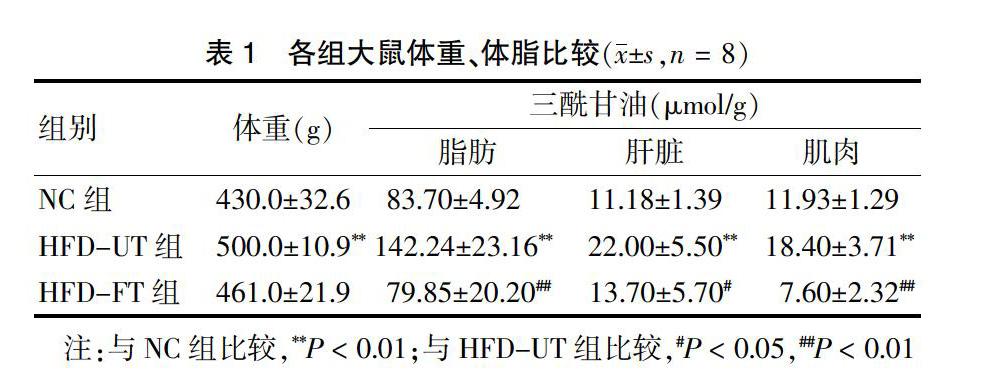
2.1 各组大鼠体重、体脂比较
HFD-UT组大鼠的体重明显高于NC组(P < 0.01),HFD-FT组体重较HFD-UT组有减轻,但差异无统计学意义(P > 0.05)。高脂喂养后,HFD-UT组脂肪组织增多,TG含量较NC组明显升高(P < 0.01);TG还在肝脏和肌肉沉积,含量均比NC组明显上升(均P < 0.01)。非诺贝特治疗后,HFD-FT组脂肪组织和肌肉TG较HFD-UT组显著下降(均P < 0.01),肝脏TG也有下降(P < 0.05)。见表1。
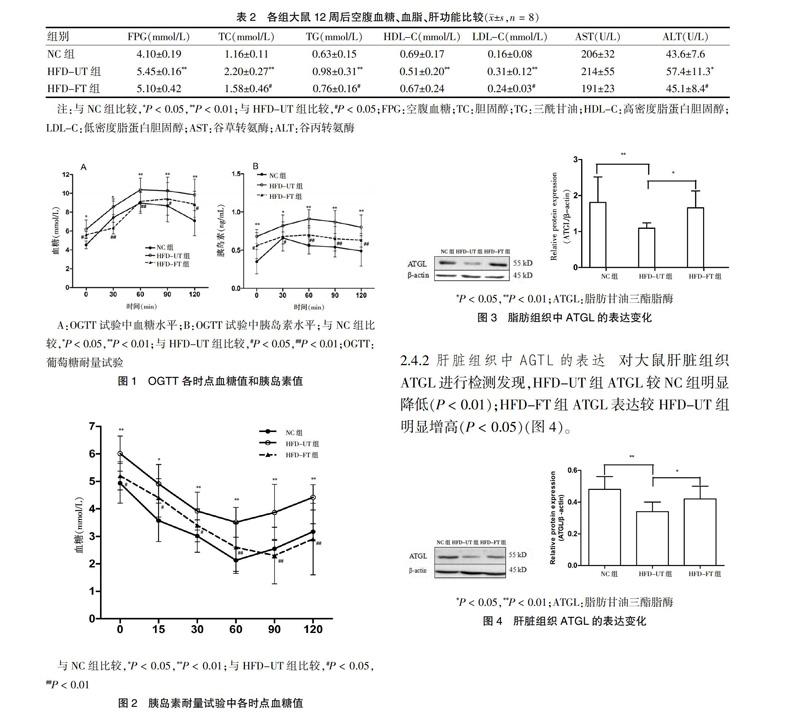
2.2 各组大鼠12周后空腹血糖、血脂、肝功能比较
12周治疗结束后,HFD-UT组血空腹血糖(FPG)明显高于NC组(P < 0.01);HFD-FT组FPG较HFD-UT组有轻微下降,但差异无统计学意义(P > 0.05)。HFD-UT组大鼠血清TC、TG、LDL-C水平较NC组明显增高(P < 0.01),HDL-C较NC组明显下降(P < 0.01),而HFD-FT组大鼠TC、TG、LDL-C均较HFD-UT组明显下降(P < 0.05),两组HDL-C水平差异无统计学意义(P > 0.05);同时,非诺贝特治疗后,HFD-FT组ALT较HFD-UT组明显下降(P < 0.05),但AST无明显变化(P > 0.05)。见表2。
2.3 各组大鼠胰岛素敏感性的比较
2周后,OGTT实验结果显示,与NC组比较,HFD-UT组各时点血糖值均显著升高(P < 0.05或P < 0.01);非诺贝特治疗后,HFD-FT组各时点血糖值均较HFD-UT组显著降低(P < 0.05或P < 0.01)(图1A);同时,HFD-UT组各时点胰岛素值均显著高于NC组(P < 0.05或P < 0.01),HFD-FT组各时点胰岛素值均显著低于HFD-UT组(P < 0.05或P < 0.01)(图1B)。进一步ITT实验,HFD组ITT各时点血糖值均显著高于NC组(P < 0.05或P < 0.01),与HFD-UT组比较,HFD-FT组空腹血糖、各时点血糖值均显著下降(P < 0.05或P < 0.01),进一步提示大鼠胰岛素抵抗模型成功建立,同时非诺贝特治疗后有效(图2)。
A:OGTT试验中血糖水平;B:OGTT试验中胰岛素水平;与NC组比较,*P < 0.05,**P < 0.01;与HFD-UT组比较,#P < 0.05,##P < 0.01;OGTT:葡萄糖耐量试验
2.4 各组大鼠组织中ATGL表达的差异
2.4.1 脂肪组织中ATGL的表达 喂养结束后,取大鼠附睾脂肪组织对ATGL蛋白进行检测发现,HFD-UT组ATGL较NC组明显降低,差异有高度统计学意义(P < 0.01);HFD-FT组ATGL表达较HFD-UT组明显升高(P < 0.05)(图3)。
2.4.2 肝臟组织中AGTL的表达 对大鼠肝脏组织ATGL进行检测发现,HFD-UT组ATGL较NC组明显降低(P < 0.01);HFD-FT组ATGL表达较HFD-UT组明显增高(P < 0.05)(图4)。
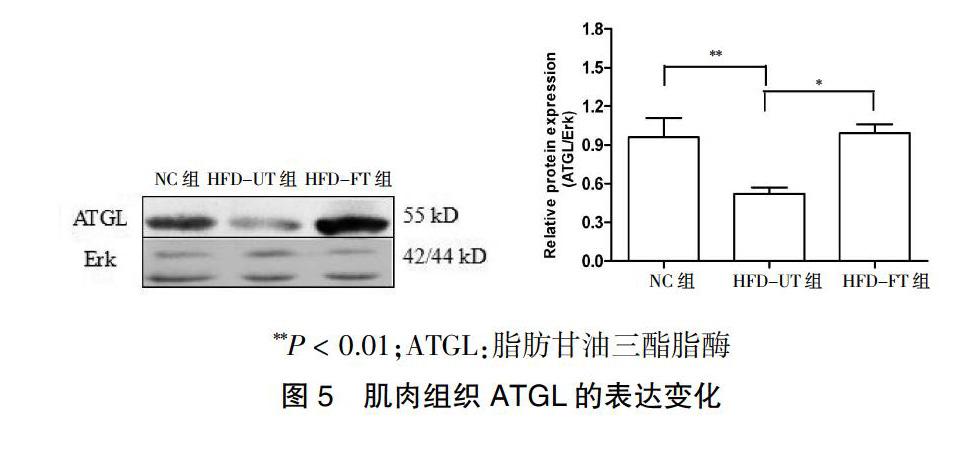
2.4.3 肌肉组织中AGTL的表达 对肌肉组织的ATGL检测结果发现,HFD-UT组ATGL较NC组显著降低,差异有高度统计学意义(P < 0.01);而HFD-FT组ATGL表达较HFD-UT组显著上升,差异有高度统计学意义(P < 0.01)(图5)。
3 讨论
高脂饮食使血中TG和游离脂肪酸(FFA)水平增高,增加炎性因子如肿瘤坏死因子α(TNF-α)、白介素6(IL-6)的表达,致氧化应激,诱发胰岛素抵抗[6],在肝细胞内堆积,引起肝细胞脂肪变性,在肌肉组织沉积,减轻肌肉组织对葡萄糖的摄取[7],另外增多的游离脂肪酸也可通过抑制胰岛素的信号转导,增加胰岛素抵抗[8]。笔者前期研究已经证实了高脂饮食大鼠出现胰岛素耐量减低,且糖耐量异常,出现胰岛素抵抗[9]。
ATGL的作用是将TG水解为甘油二酯和FFA[10]。小鼠ATGL基因敲除后表现为脂肪增多,出现明显的肥胖,同时肝脏、肌肉等多个组织均出现了TG的沉积,证明ATGL能促进TG在这些组织中的代谢并加速FFA的氧化[11]。
肝脏和肌肉组织的胰岛素抵抗是2型糖尿病的主要特点[12]。因此,ATGL除了在脂肪组织中有重要作用,在肝脏和肌肉组织中的表达变化也尤为重要。本研究结果发现,高脂饮食诱发大鼠形成胰岛素抵抗后,ATGL不仅在脂肪组织表达明显下降,在肝脏和肌肉组织中的表达也出现下降,该结果与国外研究报道的肥胖人群脂肪组织中ATGL水平表达下降的结果是一致的[13]。
非诺贝特作为PPARα受体激动剂,通过激活PPARα增强脂肪酸的氧化,降低血清中的TG,同时也能抑制TG在肝脏的聚集[14]。在肝脏,PPARα敲除小鼠会出现脂肪酸代谢障碍,进而形成肝脏脂肪沉积,引起肝脂肪变[15]。有研究发现,非诺贝特能通过降低细胞膜内二酰甘油含量增加脂肪酸氧化改善高糖饮食喂养的大鼠的肝脏脂质沉积[16],也有研究显示其通过激活高脂饮食喂养的大鼠肝脏AMPK的表达,促进脂肪酸氧化[17],同时也能恢复胰岛素信号传导通路,进而改善胰岛素抵抗,同时起到治疗肥胖及血糖异常的作用[18]。在脂肪组织中,非诺贝特能促进内脏脂肪组织氧化,起到缩小脂肪细胞体积并减轻胰岛素抵抗的作用[19]。在肌肉组织中,非诺贝特可以通过减轻内质网应激及炎性反应来改善胰岛素抵抗[20]。
本研究中非诺贝特在改善高脂饮食大鼠胰岛素抵抗的同时,又减轻了肝脏和肌肉中TG的沉积,提示PPARα激动剂可通过消耗脂肪改善包括肝脏、肌肉等部位的脂质沉积,进而增加胰岛素敏感性。本研究通过观察脂肪、肝脏、肌肉组织中ATGL表达的变化发现,非诺贝特治疗高脂喂养大鼠后,脂肪组织中ATGL增加的同时,肝脏和肌肉组织中ATGL的表达也出现增高,其中,在脂肪组织中增多较显著,其次是肌肉,肝脏组织增多不明显,推测非诺贝特对ATGL的作用程度与各组织中PPARα的表达水平相关。
非诺贝特对ATGL的作用有组织差异性,但是在本研究中,其在脂肪、肝脏、肌肉组织都促进ATGL蛋白的表达。另外,非诺贝特对肝脏和肌肉组织ATGL表达的改变是通过其作用于脂肪组织调控脂质的分布起到间接调节的作用,还是直接作用,目前还不清楚,尚需进一步研究阐明。
[参考文献]
[1] Zimmermann R,Strauss JG,Haemmerle G,et al. Fat Mobilization in Adipose Tissue Is Promoted by Adipose Trigl?鄄yceride Lipase [J]. Science,2004,306(5700):1383-1386.
[2] Hegarty BD,Furler SM,Ye J,et al. The role of intramuscular lipid in insulin resistance [J]. Acta Physiol Scand,2003,178(4):373-383.
[3] Ann SJ,Chung JH,Park BH,et al. PPARα agonists inhibit inflammatory activation of macrophages through upregulation of β-defensin 1 [J]. Atherosclerosis,2015,240(2):389-397.
[4] Ghani RA,BinYaakob I,Wahab NA,et al. The influence of fenofibrate on lipid profile,endothelial dysfunction,and inflammatory markers in type 2 diabetes mellitus patients with typica land mixed dyslipidemia [J]. J Clin Lipidol,2013,7(5):446-453.
[5] Van der Veen JN,Lingrell S,Gao X,et al. Fenofibrate,but not ezetimibe,prevents fatty liver disease in mice lacking phosphatidylethanolamine N-methyltransferase [J]. J Lipid Res,2017,58(4):656-667.
[6] Fratantonio D,Speciale A,Ferrari D,et al. Palmitate-induced endothelial dysfunction is attenuated by cyanidin-3-O-glucoside through modulation of Nrf2/Bach1 and NF-κB pathways [J]. Toxicol Lett,2015,239(3):152-160.
[7] Zhou L,Pan Y,Chonan R,et al. Mitigation of Insulin Resistance by Mangiferin in a Rat Model of Fructose-Induced Metabolic Syndrome Is Associated with Modulation of CD36 Redistribution in the Skeletal Muscle [J]. J Pharmacol Exp Ther,2016,356(1):74-84.
[8] Alam S,Mustafa G,Alam M,et al. Insulin resistance in development and progression of nonalcoholic fatty liver disease [J]. World J Gastrointest Pathophysiol,2016,15(2):211-217.
[9] 祝超瑜,劉晓华,章建梅,等.吡格列酮对肥胖大鼠脂肪甘油三酯脂酶的调控[J].中华内分泌代谢杂志,2012,28(6):509-511.
[10] Jenkins CM,Mancuso DJ,Yan W,et al. Identification,cloning,expression,and purification of three novel human calcium-independent phospholipase A2 family mem?鄄bers possessing triacylglycerol lipase and acylglycerol tra?鄄nsacylase activities [J]. J Biol Chem,2004,279(47):48968-48975.
[11] Haemmerle G,Lass A,Zimmermann R,et al. Defective lipolysis and altered energy metabolism in mice lacking adipose triglyceride lipase [J]. Science,2006,312(5774):734-737.
[12] Patel S,Jinjuvadia R,Patel R,et al. Insulin Resistance is Associated With Significant Liver Fibrosis in Chronic Hepatitis C Patients:A Systemic Review and Meta-Analysis [J]. J Clin Gastroenterol,2016,50(1):80-84.
[13] Jocken JW,Langin D,Smit E,et al. Adipose triglyceride lipase and hormone-sensitive lipase protein expression is decreased in the obese insulin-resistant state [J]. J Clin Endocrinol Metab,2007,92(6):2292-2299.
[14] Chan SM,Zeng XY,Sun RQ,et al. Fenofibrate insulates diacylglycerol in lipid droplet/ER and preserves insulin signaling transduction in the liver of high fat fed mice [J]. Biochim Biophys Acta,2015,1852(7):1511-1519.
[15] Montagner A,Polizzi A,Fouché E,et al. Liver PPARα is crucial for whole-body fatty acid homeostasis and is protective against NAFLD [J]. Gut,2016,65(7):1202-1214.
[16] Chan SM,Zeng XY,Sun RQ,et al. Fenofibrate insulates diacylglycerol in lipid droplet/ER and preserves insulin signaling transduction in the liver of high fat fed mice [J]. Biochim Biophys Acta,2015,1852(7):1511-1519.
[17] Motawi TM,Hashem RM,Rashed LA,et al. Comparative study between the effect of the peroxisome proliferator activated receptor-α ligands fenofibrate and n-3 polyunsaturated fatty acids on activation of 5′-AMP-activated protein kinase-α1 in high-fat fed rats [J]. J Pharm Pharmacol,2009,61(10):1339-1346.
[18] Feng XM,Gao X,Jia YM,et al. PPAR-ɑ Agonist Feno?鄄fibrate Reduces Insulin Resistance in Impaired Glucose Tolerance Patients with Hypertriglyceridemia:A Cross-Sectional Study [J]. Diabetes Ther,2017,8(2):433-444.
[19] Gao MM,Bu L,Ma YJ,et al. Concurrent Activation of Liver X Receptor and Peroxisome Proliferator-Activated Receptor Alpha Exacerbates Hepatic Steatosis in High Fat Diet-Induced Obese Mice [J]. PLoS One,2013,8(6):e65641.
[20] Dai F,Jiang T,Bao YY,et al. Fenofibrate improves high-fat diet-induced and palmitate-induced endoplasmic reticulum stress and inflammation in skeletal muscle [J]. Life Science,2016,157(6):158-167.
(收稿日期:2017-10-02 本文编辑:张瑜杰)
