血小板miR—96—5p在血小板储存过程中抗凋亡机制的研究
2018-04-26徐恒仕杨英崔恒祥
徐恒仕 杨英 崔恒祥
[摘要] 目的 研究血小板微RNA(microRNA)基因miR-96-5p在血小板储存过程中抗凋亡的机制,探讨血小板储存时间的影响因素。 方法 用定量PCR方法检测储存起始和储存至第5天的健康血液捐献者的单采血小板中的24种与凋亡相关的miRNAs的表达水平的变化,检测结果进行统计学分析,判断miRNA在调节血小板存活或者凋亡方面的作用。 结果 与储存起始比较,血小板储存至第5天miR-96-5p、miR-16-5p、miR-155-5p、miR-148a-5p和miR-296-5p的表达显著上升(P < 0.01),而miR-7-5p、miR-145-5p、miR-15a-5p、miR-25-3p以及miR-24-3p的表达显著下降(P < 0.01)。转染miR-96-5p抑制物至血小板72 h后,增加了细胞半胱氨酸蛋白酶-3(caspase-3)的活性,抑制了Bcl-2和Bcl-xl的表达,促进了Bax的积累和活性caspase-3的加工。 结论 miR-96-5p在血小板储存中可能发挥抗凋亡作用。
[关键词] microRNA;miR-96-5p;血小板;抗凋亡;caspase-3
[中图分类号] R446.1 [文献标识码] A [文章编号] 1673-7210(2018)02(a)-0013-04
Study of the mechanism of miR-96-5p in anti-apoptosis induced by storage in platelet
XU Hengshi1 YANG Ying1 CUI Hengxiang2
1.Department of Blood Transfusion, Shanghai Ninth People′s Hospital, Shanghai JiaoTong University School of Medicine, Shanghai 201999, China; 2.Shanghai Hanyin Medical Laboratory Ltd. Shanghai 202000, China
[Abstract] Objective To study the anti-apoptosis mechanism of miR-96-5p in platelet during the storage, and explore the factor affecting the platelet storage. Methods The expression changes of apoptosis related 24 miRNAs in apheresis platelets on the starting and 5 days of the storage was detected by quantitative real time PCR, and the results were statistically analyzed. The effect of miRNAs on survival and apoptosis of platelet. Results Compared with the starting of the storage, the expression of miR-96-5p, miR-16-5p, miR-155-5p, miR-148a-5p and miR-296-5p on 5 days of the platelet storage was significantly increased (P < 0.01), while the expression of miR-7-5p, miR-145-5p, miR-15a-5p, miR-25-3p and miR-24-3p was significantly decreased (P < 0.01). 72 h after transfected the miR-96-5p inhibitors into the platelet, the activity of caspase-3 was increased and the expression of Bcl-2 and Bcl-xl proteins was decreased, the process of Bax accumulation and active of caspase-3 was promoted. Conclusion miR-96-5p may play a role in the anti-apoptosis of platele storage.
[Key words] microRNA; miR-96-5p; Platelet; Anti-apoptosis; caspase-3
隨着医疗技术不断发展,临床用血不足的现象时常发生,特别是血小板更是如此,保存时间短(按现有保存方法,血小板可储存5 d),因此,改进血小板保存技术是破解这一难题的主要方法之一。作为血液中有形成分之一,血小板是从巨核细胞胞质裂解脱落下来的具有生物活性的小块胞质,在止血、伤口愈合、炎性反应、血栓形成及器官移植排斥等生理和病理过程中发挥重要作用。然而,在体外储存的血小板经过两个基本过程,进而决定其质量和生命:细胞凋亡和活化[1]。细胞凋亡通过两个主要途径,内源性(线粒体)途径和外在途径。研究表明,内源性途径调节血小板寿命[2]。血小板储存3 d或更长时间后,血小板线粒体呼吸功能和活化反应显著降低[3]。除了线粒体膜去极化引起的呼吸功能降低外,细胞色素C的释放,储存引起的DNA损伤都会引起血小板的凋亡。内源性途径由Bcl-2家族成员调节。Bcl-2家族有两组,分别为促进凋亡和抑制凋亡的家族成员。前者包括Bax和Bak,在凋亡中介导释放细胞色素C,促发凋亡级联。抗凋亡成员有Bcl-2、Bcl-xl、Mcl-1和Bcl-w等,通过阻止Bax和Bak活化而维持细胞活性[4]。
由于血小板缺乏功能核,基因的表达一般不受DNA转录或复制的调控,而是受到翻译水平的调节。最近的研究已证实血小板可表达不同种类的miRNAs[5-6],这些miRNAs是mRNA的关键翻译调控因子。Kannan等[7]报道了血小板的miRNAs在血小板的凋亡和储存中发挥关键作用的研究。
本文旨在研究血小板微RNA(microRNA)基因miR-96-5p在血小板储存过程中抗凋亡的机制,探讨血小板储存时间的影响因素,具体如下:
1 材料与方法
1.1 单采血小板的制备
单采血小板由上海市第九人民医院采集自健康的血液捐献者,男和女各6名。按照文献报道的方法开展实验[8]。采用偶联了CD-45、CD-71和CD-235的免疫磁珠(Invitrogen)去除白细胞、网织红细胞和红细胞,以获取血小板。
1.2 MicroRNA提取与qRT-PCR实验
利用Catch AllTM miRNA & mRNA first strand cDNA 试剂盒的miRNA抽提试剂盒(江苏昆山彭济凯丰生物公司),按说明书操作,提取血小板总RNA。提取的总RNA浓度利用Nanodrop分光光度计(Thermo)根据OD260数值来测定提取的RNA的浓度。采用mRNA first strand cDNA试剂盒(江苏昆山彭济凯丰生物公司),并按说明书展开逆转录实验。在开展逆转录前样品保存于-70℃。
总RNA在大肠埃希菌poly-A聚合酶催化下,在每个miRNA的3'-端产生poly-A尾。然后miRNA的第一条cDNA链用poly(T)接头引导,在42℃条件下催化1 h而成。再利用实时定量PCR法(qRT-PCR)测定(仪器为Mx3005P qPCR System) miRNA的第一条cDNA的含量。经过测试的成熟miRNA正义链序列(http://microrna. sanger.ac.uk)用作正向序列(见表1),所有的miRNA的表达检测所用的反向引物序列为:5′-GCGAGCACAGAATTAATACGACTC-3′。在qRT-PCR中,用5s rRNA作为内参照基因。5s rRNA正向引物序列为5'-TACGGCCATACCACCCTGAA-3';5s rRNA的反向引物序列为5'-TAACCAGGCCCGACCCTGCT-3'。PCR反应条件为:经过95℃ 8 min预热,加以下40个循环,即95℃孵育15 s,60℃孵育1 min。qRT-PCR结果用2-ΔΔCt法[ΔΔCt=(Ct靶基-Ct-Ct5s基因)分析。熔链曲线用于分析qRT-PCR的扩增特异性和质量。数据用Mxpro software(Mx3005P系统自带)分析。
1.3 血小板转染
特异性miR-96-5p抑制物和miRNA抑制剂对照购自上海吉凯基因。利用lipo 2000,参考说明书将miRNA-96-5p的抑制剂、对照抑制剂转染到血小板细胞,转染浓度为200 nmol/L。实验中设计未做转染的血小板作为空白对照组。血小板转染72 h后,收集细胞用于测定caspase-3的活性或者收集蛋白进行免疫印迹实验。
1.4 血小板凋亡评估实验
利用DEVD-AFC(AFC为7-氨基-4-三氟甲基香豆素)作为底物分析caspase-3的活性(货号K105-100,Biovision)。每组实验中,(1~5)×106血小板在冰上孵育10 min后,加入含有10 mmol/L二硫苏糖醇DTT的2×反应缓冲液。然后再加入5 μL的1 mmol/L浓度的DEVD-AFC底物,使得底物的终浓度为50 μmol/L。此后将上述细胞与底物混合液在37℃条件下孵育1~2 h。样品于96孔酶标板中,用含有400 nm激发光滤光片和505 nm波长的发射滤波片的酶标仪(SpectraMax M2,Molecular Devices Corporation,USA)测定。
1.5 免疫印迹实验
用Western blot法检测血小板转染了miR-96-5p抑制物,与相应对照物比较,Bax、Bcl-xl、Bcl-2和caspase-3等凋亡信号通路蛋白的变化。转染72 h后,取各组血小板(3~5)×107个,1200×g离心5 min,收集沉淀用PBS洗两次,用含有蛋白酶抑制剂的SDS裂解液冰上裂解10 min,12 000×g离心5 min,取上清液,经过BCA法定量蛋白浓度后,SDS-PAGE分离蛋白质。电泳后将蛋白质转移到甲醇处理过的硝酸纤维素膜或者PVDF膜上,然后依次加入50 g/L脱脂奶粉室温封闭1 h,加入相应的一抗。所有本研究用到的一抗都为Cell Signal Technology公司抗体,信息下:BAX一抗,货号:5023T;Bcl-xl一抗,货号:2764T;Bcl-2一抗,货号:4223T;caspase-3一抗,货号:9661T;所有一抗的稀释倍数为1:1000。负载蛋白的膜与一抗4℃孵育过夜,经洗膜后与酶标二抗(Abcam)或者IRDye?誖800CW偶联的相应的二抗(LI-COR Biosciences)孵育,最后在ECL(Pierce)化学发光成像系统中成像(Bio-Rad ChemiDoc XRS+)或者在Odyssey红外成像系统(LI-COR Bioscience odysseyTM)中读取结果。
1.6 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
2 结果
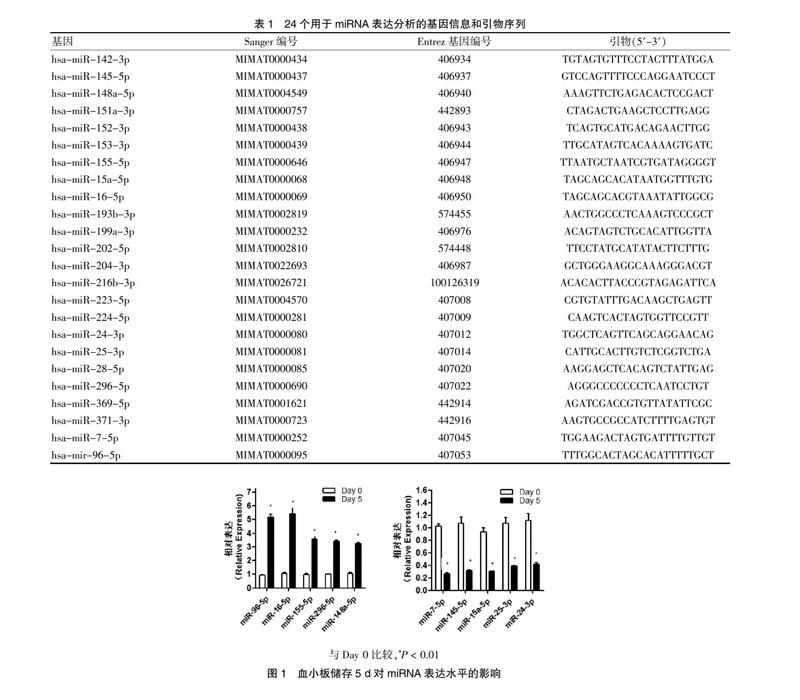
2.1 血小板储存5 d对miRNA表达的影响
在标准储存条件下储存的血小板,用qRT-PCR的方法,比较储存了5 d的血小板与储存0 d的血小板中24个与凋亡有关的miRNA的表达(见表1)[7]。本研究发现,在储存了5 d的血小板中,miR-96-5p、miR-16-5p、miR-155-5p、miR-148a-5p、miR-296-5p显著上升,与储存0 d比较,差异均有高度统计学意义(P < 0.01);而miR-7-5p、miR-145、miR-24-3p、miR-25-3p和miR-15a-5p显著下降,与储存0 d比较,差异均有高度统计学意义(P < 0.01),其中miR-96-5p和miR-16-5p的上升最為显著(P < 0.01)。见图1。
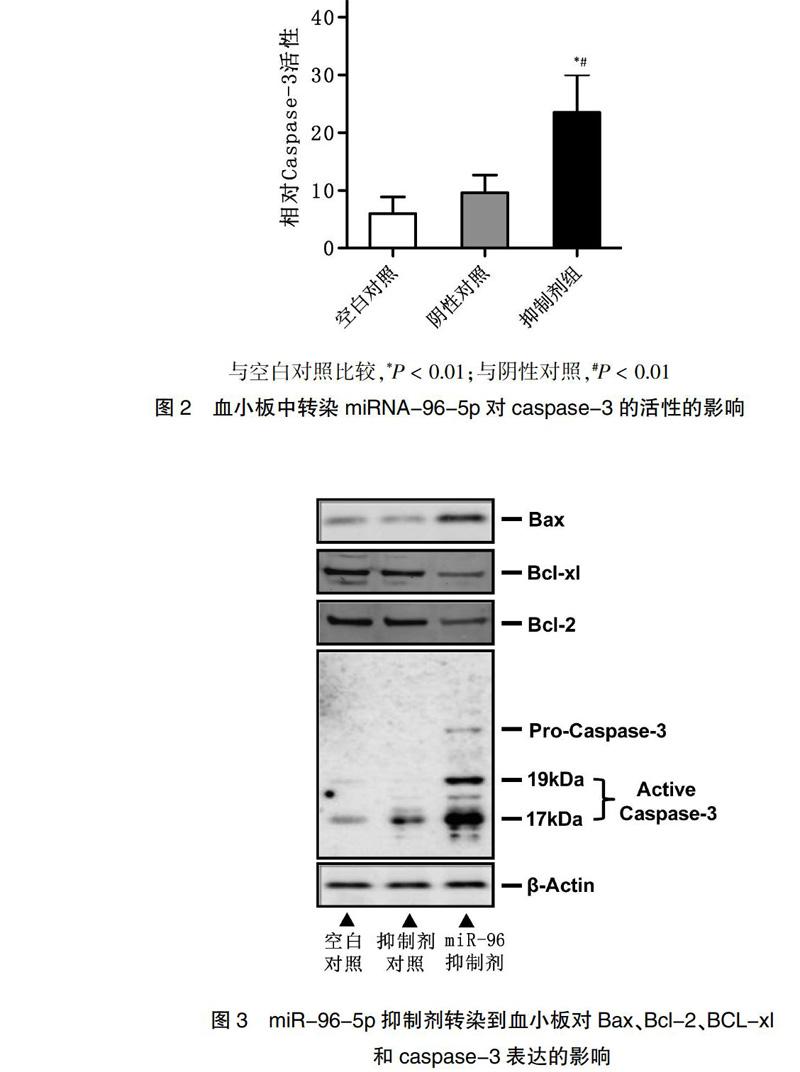
2.2 miR-96-5p抑制劑转染到血小板增加了血小板caspase-3活性
天冬酰胺特异酶切的半胱氨酸蛋白酶(caspases)与凋亡效应器,细胞色素C和Bcl-2蛋白家族间相互作用参与细胞凋亡的调控和执行,是影响细胞凋亡的重要因素。其中caspase-3在凋亡的执行阶段起作用。应用检测蛋白水解酶活性的手段可以比其他方法更早检测到凋亡。caspase-3可以裂解交联在底物DEVD上的荧光物质AFC使其释放再通过荧光比色法检测反应体系中的荧光强度间接反映蛋白酶的活性。
实验设置4组复孔,设置未经转染的血小板为空白对照组、转染miRNA抑制物对照物组为阴性对照、转染miR-96-5p的为抑制剂组。测定caspase-3活性[9]的结果表明,与miRNA抑制剂对照物比较,200 nmol/L miR-96-5p的抑制剂转染到血小板72 h后,caspase-3的活性显著上升(P < 0.01)(图2)。推断miR-96-5p在血小板中为促进细胞存活的因素,可能在血小板储存中发挥抗凋亡作用。
2.3 miR-96-5p抑制剂转染到血小板对Bax、Bcl-2、BCL-xl和caspase-3表达的影响
抗凋亡蛋白Bcl-2家族下降和促进凋亡的Bax蛋白增加是血小板凋亡常见事件。为进一步验证分子水平上miR-96-5p对凋亡通路的影响,将200 nmol/L的miR-96-5p的抑制剂和抑制剂对照分别转染到人单采血小板,转染后72 h收集血小板细胞,采用免疫印迹Western blot的方法分别检测各组细胞中Bcl-2通路相关蛋白Bax、Bcl-2、Bcl-xl和caspase-3的表达。实验结果显示,与抑制剂对照组细胞和空白细胞对照比较,miR-96-5p的抑制剂转染到血小板细胞减少了Bcl-2和Bcl-xl的表达,增加了Bax和caspase-3的表达(图3)。转染miR-96-5p抑制剂至血小板,减少了Bcl-2和Bcl-xl的表达,促进了Bax的表达和caspase-3的表达。上述结果表明,随着血小板储存时间的延长,其中的miR-96-5p表达显著增加,而miR-96-5p的这种增加可能有助于抑制血小板凋亡。
3 讨论
目前,血小板的储存采取的方法是(22±2)℃连续振摇保存,保存时间为≤5 d。在保存期间,血小板的生化指标逐渐发生变化,出现一系列形态、功能和代谢上的改变[3]。近年来,对血小板凋亡因素的研究提出了新的研究视角。血小板携带了大量的miRNA基因,研究血小板内miRNA功能和信号转导,在改进血小板保存中具有非常重要的理论和现实意义。
资料显示,一些miRNA,比如miR-326、miR-96-5p、miR-16、miR-155和miR-150等,随着血小板储存时间的延长而出现表达增加[8]。本研究增加筛查了部分新的与凋亡相关的miRNA,研究了其在血小板储存中的变化。结果显示,血小板存储至第5天,miR-96-5p、miR-16-5p、miR-155-5p、miR-148a-5p和miR-296-5p在所有的血小板样品中都出现增加现象。本研究发现miR-148a-5p和miR-296-5p是新发现的随着储存时间的延长而表达增加的miRNA。同时也发现了新的miRNA即miR-24-3p的表达随储存时间的延长而表达下降。
笔者对miR-96-5p在血小板储存中的作用做了进一步研究。资料显示,miR-96-5p在肿瘤的发生、发展过程中发挥重要作用[10-14]。在血小板中,采用miRNA的抑制物,研究miR-96-5p在血小板储存中对生存或者凋亡的影响。结果显示用miR-96-5p抑制物转染到血小板,能显著增加血小板的caspase-3的活性,抑制Bcl-2和Bcl-xl的表达,促进Bax的积累和活性caspase-3的加工。根据这些结果,推断miR-96-5p在血小板储存中起到促进存活,抑制血小板凋亡的作用。虽然FOXO1目前较多的被报道为miR-96-5p的直接调节靶基因[15-16],但miR-96-5p通过什么样的信号转导抑制血小板凋亡将值得进一步深入研究。
[参考文献]
[1] Mason KD,Carpinelli MR,Fletcher JI,et al. Programmed anuclear cell death delimits platelet life span [J]. Cell,2007,128(6):1173-1186.
[2] Zhang H,Nimmer PM,Tahir SK,et al. Bcl-2 family proteins are essential for platelet survival [J]. Cell Death Differ,2007,14(5):943-951.
[3] Perales JP,Figueredo R,Guan Y,et al. Increased platelet storage time is associated with mitochondrial dysfunction and impaired platelet function [J]. J Surg Res,2013,184(1):422-429.
[4] Gyulkhandanyan AV,Mutlu A,Freedman J,et al. Markers of platelet apoptosis:methodology and applications [J]. J Thr?鄄omb Thrombolysis,2012,33(4):397-411.
[5] Willeit P,Zampetaki A,Dudek K,et al. Circulating micro?鄄RNAs as novel biomarkers for platelet activation [J]. Circ Res,2013,112(4):595-600.
[6] McManus DD,Freedman JE. MicroRNAs in platelet function and cardiovascular disease [J]. Nat Rev Cardiol,2015, 12(12):711-717.
[7] Kannan M,Mohan KV,Kulkarni S,et al. Membrane array-based differential profiling of platelets during storage for 52 miRNAs associated with apoptosis [J]. Transfusion,2009,49(7):1443-1450.
[8] Yu S,Deng G,Qian D,et al. Detection of apoptosis-associated microRNA in human apheresis platelets during storage by quantitative real-time polymerase chain reaction analysis [J]. Blood Transfus,2014,12(4):541-547.
[9] 杜红俊,惠延年,王雨生,等.Caspase-3在柔红霉素诱导的人视网膜色素上皮细胞凋亡中作用[J].第四军医大学学报,2001,22(7):609-611.
[10] Vishwamitra D,Li Y,Wilson D,et al. MicroRNA 96 is a post-transcriptional suppressor of anaplastic lymphoma kinase expression [J]. Am J Pathol,2012,180(5):1772-1780.
[11] Yamada Y,Enokida H,Kojima S,et al. MiR-96 and miR-183 detection in urine serve as potential tumor markers of urothelial carcinoma:correlation with stage and grade,and comparison with urinary cytology [J]. Cancer Sci,2011,102(3):522-529.
[12] Yoshino H,Seki N,Itesako T,et al. Aberrant expression of microRNAs in bladder cancer [J]. Nat Rev Urol,2013, 10(7):396-404.
[13] Yan Z,Wang J,Wang C,et al. miR-96/HBP1/Wnt/beta-catenin regulatory circuitry promotes glioma growth [J]. FEBS Lett,2014,588(17):3038-3046.
[14] Feng J,Yu J,Pan X,et al. HERG1 functions as an oncogene in pancreatic cancer and is downregulated by miR-96 [J]. Oncotarget,2014,5(14):5832-5844.
[15] Guttilla IK,White BA. Coordinate regulation of FOXO1 by miR-27a,miR-96,and miR-182 in breast cancer cells [J]. J Biol Chem,2009,284(35):23 204-23 216.
[16] Haflidadottir BS,Larne O,Martin M,et al. Upregulation of miR-96 enhances cellular proliferation of prostate cancer cells through FOXO1 [J]. PLoS One,2013,8(8):e72 400.
(收稿日期:2017-09-24 本文編辑:任 念)
