发酵法制取刺梨果渣膳食纤维工艺优化及其特性分析
2018-04-26丁小娟赵泽伟顾苑婷丁筑红
丁小娟,孟 满,赵泽伟,顾苑婷,丁筑红
(贵州大学酿酒与食品工程学院,贵州贵阳 550025)
刺梨(RosaroxburghiiTratt.)系蔷薇科蔷薇属落叶灌木,因其果形似梨且表面密生小肉刺,故称刺梨,原产于我国西南部[1]。以刺梨为原料的产品有饮料[2]、果醋[3]、保健品[4-5]、药品[6-7]等。膳食纤维具有抗癌、抗氧化、降低胆固醇、改善胃肠健康、预防心血管疾病等作用[8-11]。刺梨加工利用方面多以生产刺梨果汁为主,而其花、叶、果肉、籽的营养及药用价值综合利用率低,刺梨果榨汁产生40%~50%的皮渣资源被严重浪费[12]。
目前,对刺梨营养成分及加工利用的研究报道较多,而利用混合菌种发酵刺梨果渣制备膳食纤维方面的研究鲜有报道。已被报道的混合发酵菌种有乳杆菌和双歧杆菌[13]、黑曲霉和枯草芽孢杆菌[14]、乳酸菌和绿色木霉[15]、米根霉、里氏木霉和黑曲霉[16]、保加利亚乳杆菌(Lactobacillusbulgaricus)和嗜热链球菌(Streptococcusthermophilus)[17]等。本实验以刺梨果渣为原料,利用前期筛选的嗜酸乳杆菌(GIM.1.208)、戊糖乳杆菌(CICC.22210)和生香酵母(Aroma-producing yeast)混合发酵,以期提高刺梨果渣总膳食纤维(TDF)含量,从而提高刺梨果渣膳食纤维利用率,为制备刺梨果渣SDF的工业化生产提供理论参考。
1 材料与方法
1.1 材料与仪器
刺梨果渣 贵州龙里所提供的刺梨(贵农5号品种),榨汁后去汁留渣,装入保鲜袋中密封保存于4 ℃的冰箱,备用;嗜酸乳杆菌(Lactobacillusacidophilus)GIM.1.208、戊糖乳杆菌(Lactobacilluspentosus)CICC.22210 贵州轻化工中心;生香活性干酵母 安琪酵母股份有限公司;α-淀粉酶、蛋白酶、葡萄糖苷酶 Megazyme International Ireland,Bray Business Park;2-(N-吗啡啉)乙磺酸/MES 上海源叶生物科技有限公司;TRIS 北京索莱宝科技有限公司。
MRS培养基 蛋白胨10.0 g,牛肉膏10.0 g,酵母粉5.0 g,葡萄糖5.0 g,乙酸钠5.0 g,柠檬酸钠0.05 g,吐温80 1.0 mL,K2HPO42.0 g,MgSO4·7H2O 0.2 g,MnSO4·7H2O 0.05 g,碳酸钙20.0 g,琼脂(1.5 g/100 mL),蒸馏水1000 mL,自然pH,121 ℃,0.1 MPa灭菌30 min,置于37 ℃培养24~48 h,用于乳酸菌扩大及斜面菌种培养。
立式压力蒸汽灭菌锅 江阴滨江医疗设备有限公司;SPX-150BⅢ型生化培养箱 天津市泰斯特仪器有限公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;GDE+CSF6膳食纤维测定仪 意大利VELP SCIENTIFICA公司。
1.2 实验方法
1.2.1 工艺流程 刺梨鲜渣→按料液比加水→灭菌→接种菌种→发酵培养→烘干(60 ℃)→粉碎(过60目筛)→膳食纤维测定
500 mL三角瓶中添加50 g刺梨果渣,按料液比1∶5 g/mL加入蒸馏水,用棉塞塞紧瓶口,煮沸灭菌10 min,待其冷却后于无菌操作台分别接入活化酵母菌与乳酸菌扩大培养的种子液,在自然pH条件下,将发酵液置于生化培养箱动态观察测定相关理化指标。
1.2.2 菌种的培养 生香酵母菌活化参照文献[18]并改进如下:在酵母菌中按质量比1∶20的量加入30 ℃蒸馏水,使其均匀分散,加入5%蔗糖,同时使水温保持在35~40 ℃,活化20~30 min。取出后待菌液降至室温进行接种。乳酸菌活化:MRS活化培养液121 ℃,0.1 MPa灭菌30 min,分别接入嗜酸乳杆菌GIM.1.208、戊糖乳杆菌CICC.22210乳酸菌的保藏培养物,37 ℃静止培养24~48 h备用。
1.2.3 单菌种发酵 嗜酸乳杆菌GIM.1.208、戊糖乳杆菌CICC.22210:发酵温度37 ℃;生香酵母:发酵温度28 ℃;分别以接种量10%、料液比1∶5、发酵48 h,分析膳食纤维组成含量。
1.2.4 混合菌种发酵 GIM.1.208/CICC.22210/生香酵母=1∶2∶1、1∶1∶2、2∶2∶1、2∶1∶2,接种量10%,发酵温度30 ℃和料液比1∶5 g/mL,分别用以上混合后的菌种发酵48 h,分析膳食纤维组成含量。
1.2.4.1 发酵温度对刺梨果渣膳食纤维的影响 称取25 g刺梨果渣置于250 mL三角瓶中,按料液比1∶5 g/mL,混菌比例1∶2∶1接种菌(接种量10%),控制发酵温度分别为28、30、32、34、36 ℃,发酵48 h,测定膳食纤维组分含量。
1.2.4.2 发酵时间对刺梨果渣膳食纤维的影响 称取25 g刺梨果渣置于250 mL三角瓶中,按料液比1∶5 g/mL,混菌比例1∶2∶1接种菌(接种量10%),发酵时间分别为12、24、36、48、60 h,发酵温度30 ℃,测定膳食纤维组分含量。
1.2.4.3 料液比对刺梨果渣膳食纤维的影响 称取25 g刺梨果渣置于250 mL三角瓶中,料液比分别为1∶2、1∶3、1∶4、1∶5、1∶6 g/mL,混菌比例1∶2∶1接种菌(接种量10%),温度30 ℃,发酵48 h,测定膳食纤维组分含量。
1.2.4.4 接种量对刺梨果渣膳食纤维的影响 分别称取相同质量的刺梨果渣置于三角瓶中,按料液比1∶5 g/mL,按混菌比例1∶2∶1分别接种6%、7%、8%、9%、10%,30 ℃发酵48 h,测定膳食纤维组分含量。
1.2.5 Box-Behnken中心组合实验设计 在单因素实验的基础上,每个因素选取三个对膳食纤维得率影响较大的水平,建立四因素三水平的Box-Behnken中心组合实验,以膳食纤维得率为响应值,各因素的三个水平采用-1、0、1进行编码,见表1。

表1 Box-Behnken实验设计因素水平表Table 1 Factors and levels of Box-Behnken design
1.2.6 测定方法
1.2.6.1 膳食纤维的测定 总膳食纤维(TDF)的测定:参照GB5009.88-2014;不可溶性膳食纤维(IDF)的测定:参照GB5009.88-2014;可溶性膳食纤维(SDF):SDF=(TDF-IDF)×100,其中100表示100 g样品中膳食纤维的百分含量。
1.2.6.2 膨胀力的测定 称取样品1.0000 g(m1),置于20 mL量筒中记录体积(V1),加入 10.00 mL蒸馏水(移液枪准确吸取)。充分摇匀后静置(24 h),记录膳食纤维膨胀增长后的体积(V2),膨胀力(mL/g)=(V2-V1)/m1。
1.2.6.3 持水力的测定 称取样品1.0000 g(n1),置于 100 mL 烧杯中,加蒸馏水75 mL,在(25±2) ℃下搅拌24 h,转移至离心杯中,设置1000 r/min,离心30 min,倾掉上清液,沉淀称重(n2:精确到0.0001),持水力(g/g)=(n2-n1)/n1。
1.2.6.4 持油力的测定 参考Sangnark[19]的方法,称取样品1 g(h1:精确到0.0001),置于离心管中,加入适量豆油,室温下静置1 h。用已知重量的尼龙网/布(h2:精确到0.0001)过滤收集沉淀,称取沉淀湿重(h3:精确到0.0001),持油力(g/g)=(h3-h2-h1)/h1。
1.3 数据处理

2 结果与分析
2.1 不同菌种发酵对刺梨果渣膳食纤维的影响
由图1可知,嗜酸乳杆菌1.208 SDF得率较高,达11.00%。与单一菌种相比,混合菌种A∶2B∶C发酵后果渣中SDF含量有所提高,不同比例混合菌种发酵果渣中SDF与TDF的得率显著不同(p<0.05)。结果显示刺梨果渣SDF得率发酵结果由大到小为:混菌比例1∶2∶1>嗜酸乳杆菌1.208>混菌比例2∶2∶1>混菌比例2∶1∶2>混菌比例1∶1∶2>戊糖乳杆菌22210>生香活性干酵母。虽然嗜酸乳杆菌1.208与混菌1∶2∶1差异不显著,但研究发现嗜酸乳杆菌与戊糖乳杆菌在特定条件下可产β-葡萄糖苷酶系,对膳食纤维有一定的降解作用。因此确定最优菌种为1∶2∶1,在此条件下,发酵效果最佳,果渣培养物中TDF、IDF及SDF的得率分别为52.80%、41.34% 和11.46%。
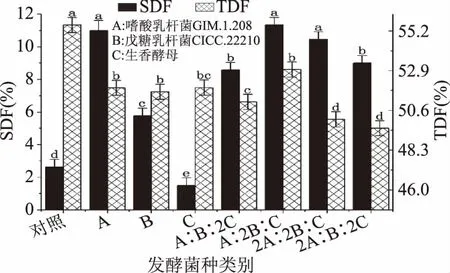
图1 不同菌种对膳食纤维的影响Fig.1 Influence of different strains on dietary fiber注:不同字母表示差异显著(p<0.05)。
相关研究表明,嗜酸乳杆菌与戊糖乳杆菌在特定发酵条件下有产β-葡萄糖苷酶系的功能,对膳食纤维有一定的降解作用[20]。菌株生长时利用原料中的淀粉、蛋白质,提高DF纯度,其产生的有机酸可断裂纤维素类大分子的糖苷键,降低纤维的聚合度,将部分IDF转化成可溶性多糖,提高SDF含量和产品的生理活性[21]。生香酵母具有独特产香特性[22-23]。因此,确定混菌(GIM.1.208∶CICC.22210∶生香酵母)比例1∶2∶1为发酵菌种。
2.2 混合菌种发酵条件的研究
2.2.1 不同发酵温度对刺梨果渣膳食纤维的影响 由图2可知,30 ℃时TDF得率最高达11.43%,当温度超过32 ℃时,TDF制取率随温度升高而减小;SDF得率在30 ℃时达到最大值,36 ℃时达到最小值,可能是处理时间过长会造成SDF结构的改变,被分解成更小的结构,造成部分SDF损失[24];温度超过菌体最适生长温度,抑制菌种生长,不利于发酵的充分进行[25]。因此,确定最佳发酵温度为30 ℃。
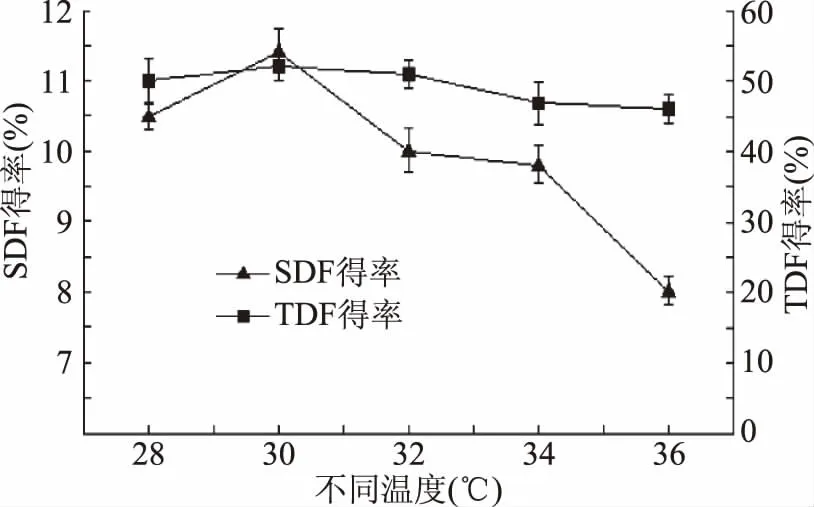
图2 发酵温度对膳食纤维的影响Fig.2 Influence of fermentation temperature on dietary fiber
2.2.2 不同发酵时间对刺梨果渣膳食纤维的影响 由图3可知,12~24 h时TDF得率呈下降趋势,24 h后呈上升趋势,48 h达最大;随着发酵时间的延长,SDF得率呈上升趋势,48 h达最大,48 h后SDF得率显著下降。可能是由于随时间增加使果胶裂解,并在水中被氢离子水解[24];后期由于菌种增长使发酵产物不断积累,体系pH持续下降,抑制菌体自身生长或产生菌体自溶,使菌体产酶效果下降进而导致发酵动力下降[26-27]。周笑犁等[28]用发酵法制备刺梨SDF最佳发酵时间为48 h,与本实验结果一致。因此,确定最佳发酵时间为48 h。

图3 发酵时间对膳食纤维的影响Fig.3 Influence of fermentation time on dietary fiber
2.2.3 不同料液比对刺梨果渣膳食纤维的影响 由图4可知,TDF得率无明显变化;而随着料液比的增加,SDF得率在料液比为1∶5 (g/mL)时,SDF得率达到最大,之后SDF得率呈下降趋势。料液比过大或过小都不利于乳酸菌与酵母混合菌体产酶代谢,进而影响SDF得率及刺梨果渣培养物的品质。因此,确定最佳料液比为1∶5 (g/mL)。
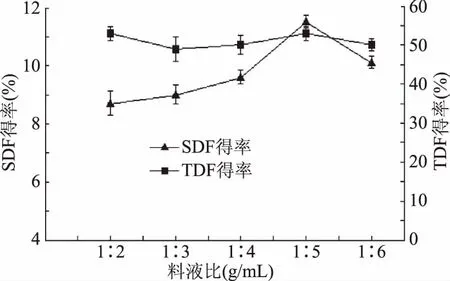
图4 不同料液比对膳食纤维的影响Fig.4 Influence of different material liquid ratio on dietary fiber
2.2.4 不同接种量对刺梨果渣发酵膳食纤维的影响 由图5可知,接种量为10%时,TDF得率较高,SDF得率有最大值,之后逐渐下降。原因可能是接种量过大会使菌种数量增多,消化分解快速结束,导致后期发酵动力不足,SDF得率下降[29]。因此,确定10%接种量较适宜。
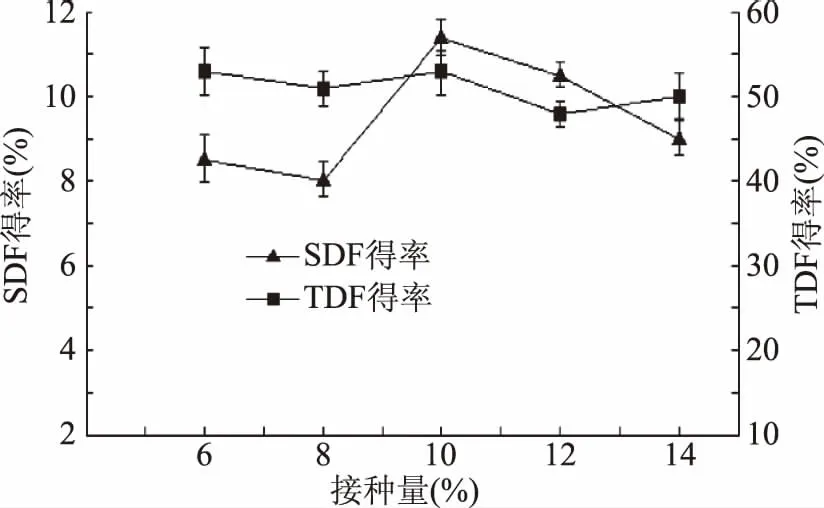
图5 不同接种量对膳食纤维的影响Fig.5 Influence of different inoculation quantity on dietary fiber
2.3 可溶性膳食纤维提取工艺回归模型的建立及方差分析
响应面法优化刺梨果渣中SDF提取的结果见表2。采用Design Expert 8.06软件,选用Box-Behnken模型,对表2中的数据进行回归分析,得到回归方程:

表2 Box-Behnken实验方案与结果Table 2 Box-Behnken experimental design and result
Y=11.52+0.026A+0.27B+0.25C+0.15D+0.29AB+0.030AC-0.27AD-0.12BC+0.085BD+0.25CD-0.75A2-0.78B2-0.56C2-0.36D2
模型的方差分析结果见表3。模型p<0.0001,模型极为显著,所选模型可靠。失拟项p=0.0852>0.05,差异不显著,方程对实验拟合程度较好。模型相关系数是0.9414,说明该模型能揭示94.14%的响应值变化。对回归方程系数进行显著性检验(表3),表明一次项B、C及二次项A2、B2、C2、D2因素各水平间均对SDF得率有极显著影响(p<0.01);一次项D及交互项AB、AD、CD对SDF得率有显著影响(p<0.05),其余对SDF得率影响不显著(p>0.05)。
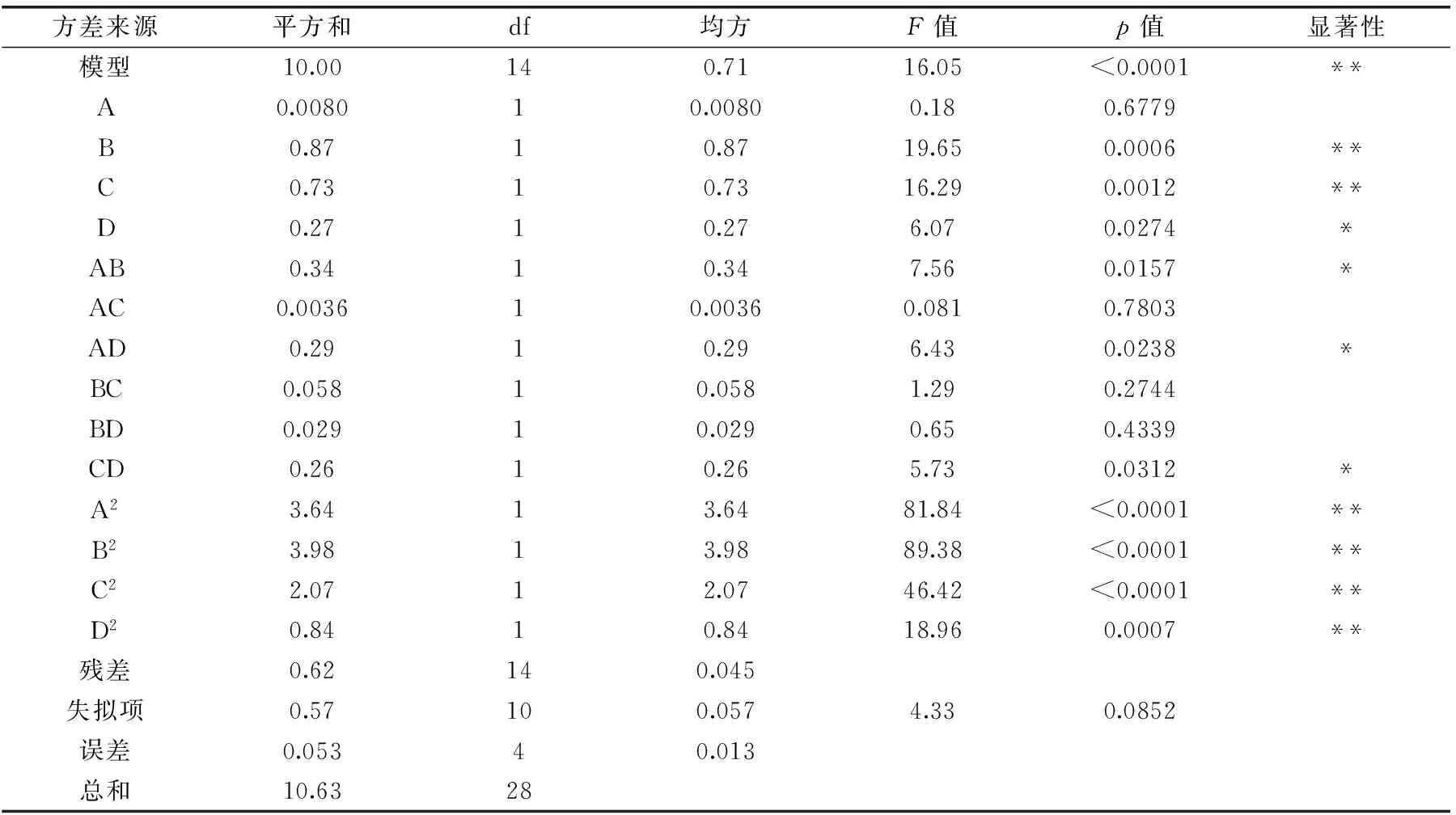
表3 响应面分析实验方差分析结果Table 3 Box-Behnken experimental design and results for response surface analysis
2.4 响应面分析与优化
考察交互项对提取率的影响,由图6~图11可知,当温度和时间一定时,随料液比的增大,SDF得率先增大后减小;随接种量的增大,SDF得率先增大后减小;两因素之间的交互作用对SDF得率的影响显著。当接种量和时间一定时,随温度的升高,SDF得率逐渐增大;随料液比的增大,SDF得率先增大后减小;两因素间的交互作用不显著。当温度和接种量一定时,随料液比的增大,SDF得率逐渐增大;随时间的增加,SDF得率逐渐增大;两因素间的交互作用对SDF得率影响显著。当时间和料液比一定时,随温度的降低,SDF得率先增大后减小;随接种量的增大,SDF得率先增大后减小;两因素间交互作用不显著。当料液比和温度一定时,随接种量的增加,SDF得率先增大后减小;随时间的增加,SDF得率先增大后缓慢减小;两因素间的交互作用不显著。当料液比和接种量一定时,随温度的升高,SDF先增大后减小;随时间的延长,SDF得率先增大后减小;两因素间交互作用显著。该结果与方差分析结果一致。
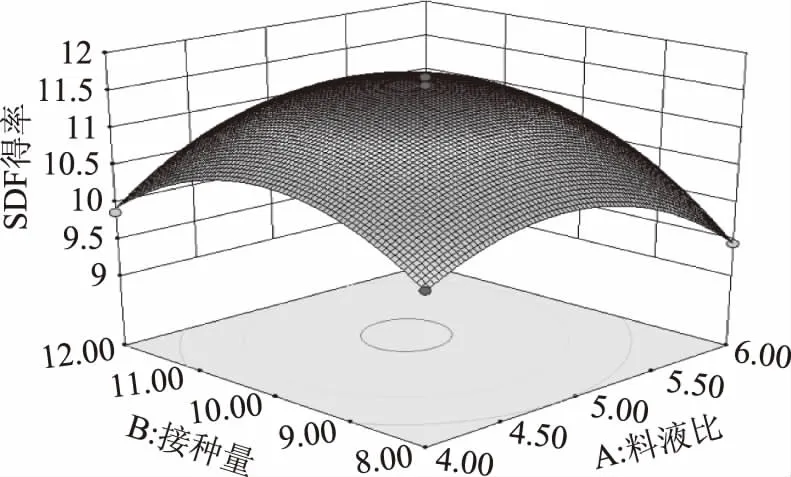
图6 料液比和接种量对SDF得率的影响Fig.6 Influence of material liquid ratio and inoculation quantity on SDF yield
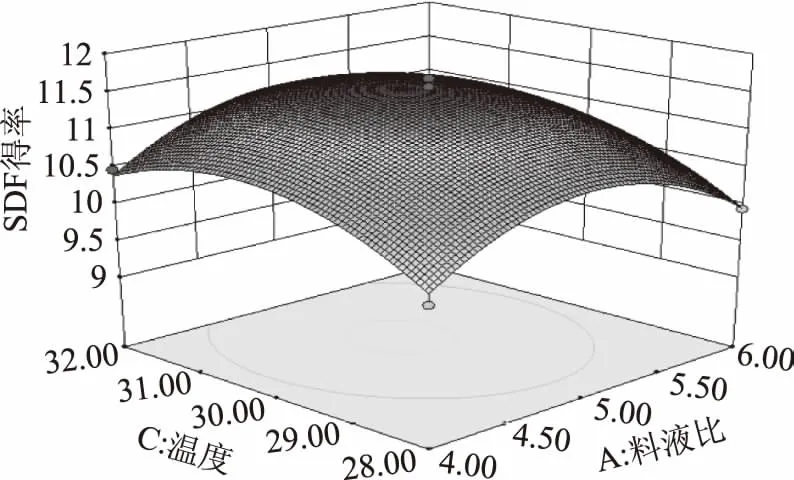
图7 料液比和发酵温度对SDF得率的影响Fig.7 Influence of material liquid ratio and fermentation time on SDF yield

图8 料液比和发酵时间对SDF得率的影响Fig.8 Influence of material liquid ratio and time on SDF yield

图9 接种量和发酵温度对SDF得率的影响Fig.9 Influence of inoculation quantity and temperature on SDF yield

图10 接种量和发酵时间对SDF得率的影响Fig.10 The influence of inoculation quantity and fermentation time on SDF yield

图11 发酵温度和发酵时间对SDF得率的影响Fig.11 The influence of fermentation time and temperature on SDF yield
经Design-Expert 8.06软件分析优化,得到发酵法制取刺梨果渣SDF最佳工艺参数为混合菌种(嗜酸乳杆菌GIM.1.208∶戊糖乳杆菌CICC.22210∶生香酵母)比例1∶2∶1、料液比1∶5 (g/mL)、接种量10.34%、温度30.55 ℃、时间51.89 h,此条件下SDF得率理论上是11.599%。根据实际将发酵条件调整为:料液比1∶5 (g/mL)、接种量10%、温度30 ℃、时间52 h,所得结果为11.590%,与理论值相差0.009,相对误差0.08%,实测值与理论值相差不显著,说明实验结果与模型拟合较好,建立此模型能够真实的反映各因素对SDF得率的影响,通过该模型优化能有效提高SDF得率。
2.5 发酵前后果渣特性分析
由表4可知,新鲜刺梨果渣中TDF含量达55.46%,SDF含量约为2.72%,可见刺梨果渣是获取膳食纤维的良好资源。发酵后刺梨果渣中SDF较原果渣高,其中SDF含量达11.59%,较原果渣提高76.53%。表明由于微生物的消化分解作用,消耗大部分营养物质,促使膳食纤维的含量显著提高[20]。乳酸菌是人类肠道中的益生菌[31],生香酵母具有独特的产香特性[32],经发酵处理后刺梨果渣膳食纤维理化性质得到改善,膨胀力和持水力分别为14.65 mL/g和16.71 g/g,不饱和脂肪和饱和脂肪持油力分别为4.54 g/g和2.12 g/g。蒋丽[15]采用乳酸菌和绿色木霉菌混合菌种为发酵剂,从柠檬果渣中提取膳食纤维膨胀力和持水力分别为13.21 mL/g和9.15 g/g,杨雪[30]发酵柑橘皮渣制备膳食纤维的持水力为7.21 g/g,膨胀力为9.65 mL/g,本研究结果均优于上述报道结果,表明发酵法处理果渣对膳食纤维理化特性中膨胀力、持水力和持油力的影响显著。

表4 发酵前后果渣特性分析Table 4 Comparision of character analysis before and after fermentation of pomace
3 结论
采用响应面法对刺梨果渣膳食纤维提取条件进行优化,建立膳食纤维得率的回归模型,由该模型优化的膳食纤维提取条件为:混合菌种嗜酸乳杆菌(GIM.1.208)、戊糖乳杆菌(CICC.22210)和生香酵母(Aroma-producing yeast)比例1∶2∶1、料液比1∶5、接种量10%、发酵温度30 ℃、发酵时间52 h,此条件下,刺梨果渣膳食纤维的平均得率为11.590%。高品质膳食纤维持水力不小于7 g/g,膨胀力应大于10 mL/g[16],本实验制备的水溶性膳食纤维持水力和膨胀力分别达到16.71 g/g、14.65 mL/g,符合高质量膳食纤维的要求。
刺梨果渣作为一种质优价廉的膳食纤维资源,利用混合菌种发酵不仅提高了SDF得率,而且可改善膳食纤维特性。且该法发酵时间短,操作简便,为推动刺梨果渣资源的充分利用,开发新型膳食纤维产品提供了实验基础。
[1]刘航,邵丽. 刺梨的开发价值及栽培技术要点[J]. 现代园艺,2013,74(23):121.
[2]Xing J H,Bo H,Zhang H J,et al. Study on technology and formula of walnut-roxburgh rose beverage[J]. Agricultural Science & Technology,2013,5(3):503-506.
[3]严晓月,刘星,李永福,等. 无籽刺梨酸奶含片工艺研究[J]. 食品与机械,2015,52(1):226-230.
[4]He J Y,Zhang Y H,Ma N,et al. Comparative analysis of multiple ingredients inRosaroxburghiiandR.sterilisfruits and their antioxidant activities[J]. Journal of Functional Foods,2016(27):29-41.
[5]Zeng F F,Ge Z W,Li L,et al. Antioxidant and tyrosinase inhibitory activity ofRosaroxburghiifruit and identification of main bioactive phytochemicals by UPLC-Triple-TOF/MS[J]. International Journal of Food Science and Technology,2017,52(13353):897-905.
[6]An H M,Yang M,Fan W G,et al. Analysis of main organic acid compositions inRosaroxburghiiTratt[J]. Scientia Agricultura Sinica,2011,44(10):2094-2100.
[7]Prasad P D,Gurav A,Zhu H,et al. Dietary fiber for the prevention of cardiovascular disease[M].Rodney A Samaan,2017:73-90.
[8]Goff H D,Nikolay R,Hrvoje F,et al. Dietary fibre for glycaemia control:Towards a mechanistic understanding[R]. Bioactive Carbohydrates and Dietary Fibre,Available online 12 July 2017.
[9]Marija L,Marijana M S,Ivana R,et al. Knowledge about dietary fibre and its health benefits:A cross-sectional survey of 2536 residents from across Croatia[J]. Medical Hypotheses,2017(105):25-31.
[10]Iain A B,Peter I C,Jeff P P,et al. Dietary fibre and weight loss:Where are we now?[J]. Food Hydrocolloids,2017(68):186-191.
[11]PCK,Cheung.Mini-review on edible mushrooms as source of dietary fiber:Preparation and health benefits[J]. Food Science and Human Wellness,2013,2(3-4):162-166.
[12]张瑜. 刺梨果渣高纤粉加工及品质特性研究[D]. 贵阳:贵州大学,2016.
[13]Ying X,Gong J,Goff H D,et al. Effects of pig colonic digesta and dietary fibres oninvitromicrobial fermentation profiles[J]. Bioactive Carbohydrates and Dietary Fibre,2013,1(2):120-130.
[14]孙婕,尹国友,王超,等. 混合发酵法制备韭籽粕水溶性膳食纤维[J].食品研究与开发,2017(11):95-99.
[15]蒋丽,雷激. 发酵法从柠檬果渣中制备膳食纤维的研究[J]. 中国酿造,2016,35(3):133-136.
[16]吴学凤,潘丽军,姜绍通,等. 发酵法制备小麦麸皮膳食纤维[J]. 食品科学,2012,33(17):169-173.
[17]李璐,徐灵芝,黄亮,等. 发酵法制备雷竹笋膳食纤维的工艺研究[J]. 中国酿造,2016(4):176-180.
[18]戚晓舟,宋晨光,凌飞,等. 不同菌株发酵沙棘果渣、沙棘叶、沙棘籽渣营养成分变化的研究[J]. 饲料工业,2016,7(6):22-27.
[19]Sangnark A,Noomhom A. Effect of particle size on funetionaL properties of dietary fiber prepared from sugareane bagasse[J].Food Chemistry,2003(80):221.
[20]李志华.产β-葡萄糖苷酶乳酸菌菌株的特性研究[D].延安:延边大学,2014.
[21]裘纪董,陈蕾蕾,王未名,等. 发醇法制备高品质膳食纤维的研究进展[J].中国食物与营养,2010(6):24-27.
[22]Li X,Kang Y J,Yu C,et al. Exponential feeding strategy of high-density cultivation of a salt-tolerant aroma-producing yeastZygosaccharomycesrouxiiin stirred fermenter[J]. Biochemical Engineering Journal,2016,18(2):18-23.
[23]Wilkowska A,Pogorzelski E. Aroma enhancement of cherry juice and wine using exogenous glycosidases from mould,yeast and lactic acid bacteria[J]. Food Chemistry,2017(237):282-289.
[24]肖盾,牛广财,朱丹,等. 发酵法制取沙果渣可溶性膳食纤维的研究[J]. 中国酿造,2010(3):166-170.
[25]王庆玲,朱莉,孟春棉,等. 微生物发酵法制备番茄皮渣膳食纤维工艺优化[J]. 粮食与油脂,2014,27(9):52-55.
[26]孙平,刘杰,郭苗苗,等. 发酵法提取小麦麸皮可溶性膳食纤维工艺研究[J]. 食品科技,2014,39(10):170-175.
[27]王静,何晓玲. 发酵法制取苹果渣中的可溶性膳食纤维[J]. 江苏农业科学,2013,41(3):255-258.
[28]周笑犁,谢国芳,何劲,等. 发酵法制备刺梨果渣可溶膳食纤维的工艺优化[J]. 食品工业科技,2008(1):102-106.
[29]令博,田云波,吴洪斌,等. 微生物发酵法制取葡萄皮渣膳食纤维的工艺优化[J]. 食品科学,2012,33(15):178-182.
[30]杨雪. 发酵法提高柑橘皮渣可溶性膳食纤维含量及产物性能的研究[D].南京:南京农业大学,2015.
[31]Hymes J P,Johnson B R,Barrangou R,et al. Functional analysis of an s-layer-associated fibronectin-binding protein in lactobacillus acidophilus ncfm[J]. Applied & Environmental Microbiology,2016,82(9):2676-2685.
[32]Amparo G,Raquel Q,Marizeth G,et al. High-throughput screening of a large collection of non-conventional yeasts reveals their potential for aroma formation in food fermentation[J]. Food Microbiology,2016(60):147-159.
