食品中单核细胞增生李斯特氏菌两种定量检测方法的比较
2018-04-26马慧娟李俐俐李新丽张厚森
马慧娟,徐 慧,李俐俐,刘 姝,贾 涛,李新丽,高 宏,张厚森
(江苏省理化测试中心,江苏南京 210046)
单核细胞增生李斯特氏菌(Listeriamonocytogenes,LM)是唯一能引起人畜共患病的主要致病菌,由于该菌具有耐高盐、高渗透压、低温和低水分的特点,因此其可在极端条件下生长且很难在食物链中被清除[1]。2002年,LM已被 WHO 列为四大重要的食源性致病菌之一[2]。据报道,近年来由LM引发的病例呈上升趋势[3-6],且由该菌感染引起的食物中毒导致的人畜患胃肠炎、脑膜炎、败血症以及流产和死胎等疾病的死亡率高达30%~70%[7-8]。随着人们生活节奏的加快,冷藏、速冻食品的消费量也迅速增加,但该类食品被LM感染会持续腐败[9],因此冷藏类食品的微生物检测必须引起重视。
目前,国内外对LM的检验方法主要包括传统培养检测和快速检测两大类,前者包括国际上的FDA-BAM、ISO 11290 等方法[10]。我国常用的是国标法,自1994年(GB/T4789.30-1994)发布以来一直作为食品卫生中LM检测的主要依据,截止2017年该法已进行了4次修订(GB/T4789.30-2003、GB/T 4789.30-2008、GB 4789.30-2010和GB 4789.30-2016),其中,与GB 4789.30-2010相比,GB 4789.30-2016《单核细胞增生李斯特氏菌检验》增加了“第二法 单核细胞增生李斯特氏菌平板计数法”和“第三法 单核细胞增生李斯特氏菌MPN 计数法”,进一步满足了LM的计数要求,并且方法的可操作性得到很大提升,有利于基础条件相对薄弱的实验室开展检测。快速检测法包括酶联免疫吸附测定法(ELISA)、酶联荧光分析法(ELFA)和侧流免疫法(Lateral Flow Immunoassay)等免疫学方法、生物传感器法、基于噬菌体的检测法及多重PCR、实时荧光PCR、核酸探针杂交技术和恒温扩增技术等分子生物学方法[11]。与传统的检测方法相比,免疫学方法具有速度快、可重复性好;生物传感器法响应时间慢,寿命短且灵敏度不高;而分子生物学方法检测快速、可重复性强、且可同时设置多参数检测,并能够实现自动化,但快速检测方法存在特异性低、检测结果假阳性率偏高、成本高等缺点,因此在食品卫生微生物的实际检验中,各单位部门和食品检测中心仍以传统培养检测方法为主。
本研究通过比较平板计数(Plate counting)法和稀释培养计数(Most probable number counting,MPN)法测定人工污染不同杂菌和LM的不同种类食品中LM的检出率而筛选出最佳检测方法,并比较不同食品在不同储存条件下LM的数量,进而探讨食品冰箱保存的最佳保存时间和方法,为家庭冰箱食品的保存条件提供参考性的建议。
1 材料和方法
1.1 材料与仪器
牛奶、凉拌菜和盐水鸭 采自南京市某超市,采集当天进行样品检测;单核细胞增生李斯特氏菌CICC21633和金黄色葡萄球菌(StaphylococcusAureus,SA)CICC21600 中国工业微生物菌种保藏管理中心;大肠埃希氏菌(Escherichiacoli,E.coli)25922 广东省食品微生物安全工程技术研究中心。
拍击式均质器 HBM-400B中国天津;李氏增菌肉汤(LB肉汤,批号:3105131)、李斯特氏菌显色培养基(批号:6103134)、李氏增菌液LB1(批号:6105150)、LB2配套试剂(批号:6105236)、PALCAM 琼脂(批号:3104527)、含0.6%酵母膏的胰酪胨大豆琼脂(TSA-YE,批号:3105514)、LM生化鉴定试剂盒(批号:5105133) 广东环凯生物科技有限公司。
1.2 实验方法
1.2.1 试样的制备及检测 将从南京市某超市采集的牛奶、凉拌菜和盐水鸭样品当天立即按照GB 4789.30-2016中的第一法进行定性检测,检测结果为LM阴性。样品的平板计数法和MPN计数法采用GB 4789.30-2016 中的第二法和第三法[13]。
1.2.2 菌种数量的获取 将LM、E.coli和SA分别接种于营养肉汤中,其中E.coli和SA混合接种于一份营养肉汤中,(36±1) ℃培养24 h;取1 mL菌液与9 mL的生理盐水混匀,10倍倍比稀释,进行平板计数[12],计数方法同GB 4789.2-2016[14]。
1.2.3 模拟杂菌含量低污染试样的检测 取LM检测均为阴性的牛奶、凉拌菜(在无菌条件下剪碎)和盐水鸭(在无菌条件下剪碎)试样,于沸水中煮10 min,每个样品分为平行4份,3份接种菌液,根据菌液浓度取不同的量分别加入含有25 mL牛奶、25 g凉拌菜和25 g盐水鸭的225 mL的LB肉汤中,使LM的终浓度分别约为600、100和20 CFU/mL,同时使E.coli和SA的数量之和分别约为60、10和2 CFU/mL,使目标菌(LM)和杂菌(E.coli和SA)数量比例约为10∶1,另1份不接菌,作为阴性对照。每个浓度做3个独立重复实验。
上述目标菌和杂菌的数量均为在做样品的同时取一定量的样品进行平板计数的结果,即取每个浓度的样品25 g(mL)分别加入225 mL LB增菌液和无菌生理盐水中,按照GB 4789.30-2010(第二法)、GB 4789.3-2016(第二法)[15]和GB 4789.10-2016(第二法)[16]分别做平板计数,计算LM、E.coli和SA的具体数量。
1.2.4 模拟杂菌含量高污染试样的检测 取LM检测均为阴性的牛奶、凉拌菜(在无菌条件下剪碎)和盐水鸭(在无菌条件下剪碎)试样,在沸水中煮10 min,每个样品分为平行4份,3份接种菌液,根据菌液浓度取不同的量分别加入含有 25 mL牛奶、25 g凉拌菜和25 g盐水鸭的225 mL的LB肉汤中,使LM的终浓度分别约为600、100和20 CFU/mL,同时使E.coli和SA的数量之和分别约为6000、1000和200 CFU/mL,使目标菌(LM)和杂菌(E.coli和SA)数量比例约为1∶10,另1份不接菌,作为阴性对照。每个浓度做3个独立重复实验。加目标菌和杂菌的数量计算方法同1.2.3。
1.2.5 冷冻和冷藏保藏污染试样的检测 取若干滴LM菌液加入牛奶、凉拌菜和盐水鸭中,混匀,分成2份,分别置于2~8 ℃和-20 ℃的冰箱中保存,取保存3、5、7 d的样品用MPN计数法进行测定。
1.3 统计方法
采用Excel 2003软件建立数据库,运用SPSS 17. 0统计软件进行数据分析。
2 结果与分析
2.1 无杂菌的染菌实验
无杂菌的不同食品染菌试样检测结果见表1,牛奶、凉拌菜和盐水鸭试样的染菌实验表明,平板计数法和MPN计数法测得的LM结果均接近于染菌的起始浓度。结果相差不超过0.5倍,结果均小于1个数量级。不同种类食品不同染菌量平板计数法测得的LM结果是初始染菌量的0~0.05倍,MPN计数法测得的LM结果是初始染菌量的0~0.5倍,在无杂菌污染时,平板计数法比MPN计数法的准确度更高一些。
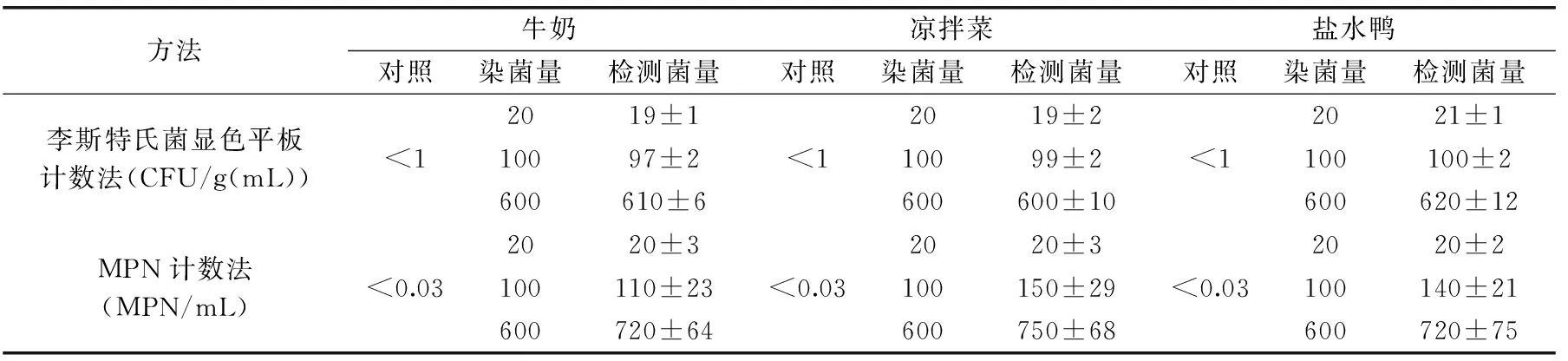
表1 无杂菌的不同食品染菌实验中LM的检测结果Table 1 Detection results of LM in different foods contamination tests with non content of miscellaneous bacterium
2.2 杂菌含量低的染菌实验
模拟杂菌含量低的试样检测结果见表2,牛奶、凉拌菜和盐水鸭试样的染菌实验表明,平板计数法测得的LM结果接近于染菌的起始浓度,结果相差0.6~1.2倍,小于1个数量级,其中盐水鸭试样测得的LM结果与染菌的起始浓度最接近,结果最高相差1.1倍;凉拌菜试样测得的LM结果与染菌的起始浓度相差0.9~1.1倍;牛奶试样测得的LM结果与染菌的起始浓度相差最大,结果相差0.6~1.2倍,试样除盐水鸭外,结果表明,LM染菌浓度越小(<100 CFU/g(mL)),检测菌量与染菌量的结果相差越大。MPN计数法检测LM结果远高于染菌的起始浓度,结果相差1.2~18倍,其中盐水鸭试样测得的LM结果与染菌的起始浓度相差最大,结果相差2.2~18倍;凉拌菜试样测得的LM结果与染菌的起始浓度相差最小,结果相差1.2~3.9倍;牛奶试样测得的LM结果与染菌的起始浓度相差2.2~7.5倍;所有试样检测结果表明LM染菌浓度越小(<100 CFU/g(mL)),检测菌量结果与染菌量的结果相差越小。

表2 杂菌含量低的不同食品染菌实验中LM的检测结果Table 2 Detection results of LM in different foods contamination tests with low content of miscellaneous bacterium
2.3 杂菌含量高的染菌实验
模拟杂菌含量高的试样检测结果见表3。牛奶、凉拌菜和盐水鸭试样的染菌实验表明,平板计数法检测LM结果远低于染菌的起始浓度,结果相差0.5~0.8倍,与杂菌含量低的平板计数法测得的0.6~1.2倍相比,测量结果的准确性略有降低。其中凉拌菜试样测得的LM结果与染菌的起始浓度相差最大,结果相差0.5~0.8倍;盐水鸭和牛奶试样测得的结果与染菌的起始浓度相差相对较小,结果相差0.6~0.8倍;且LM染菌的初始浓度越高(≥100 CFU/g(mL)),检测菌量与初始浓度相差越小。MPN计数法测得的LM结果与染菌的起始浓度相比,结果相差1.1~2.5倍,与杂菌含量低的MPN计数法测得的1.2~18倍相比,测量结果的准确性提高约7倍。其中盐水鸭试样测得的LM结果与染菌的起始浓度最接近,结果相差1.1~2.0倍;凉拌菜试样测得的LM结果与染菌的起始浓度相差1.4~1.8倍;牛奶试样测得的结果与染菌的起始浓度相差最大,结果相差1.5~2.5倍,且LM染菌的初始浓度越高(≥100 CFU/g(mL)),结果相差越大。
2.4 冷藏前后试样中单增李斯特氏菌数量的变化
由表4结果可知,2~8 ℃保存后的3种试样中LM的数量随着保存时间的增加均有不同程度的增加。牛奶样在保存3 d后LM的数量增长最多,比初始结果增加了4倍,之后增长速度减慢,7 d时增加了10.6倍;凉拌菜中的增长速度最慢,保存3、5 和7 d的LM数量分别增加了1.3、2.1和3.2倍;盐水鸭中的LM增长速度最快,3 d增加了2.6倍,5 d时增长量与牛奶中的相同,增加了6.4倍,7 d时的增长量为初始菌量的26倍。牛奶、凉拌菜和盐水鸭在经过不同冷藏保存时间后LM数量对比差异有统计学意义(p<0.05)。由于凉拌菜的初始染菌量与牛奶和盐水鸭不同,无法比较经过相同保存天数后的不同种类食品中LM数量增长是否有差异,但根据表4结果可知,LM的增长速度:凉拌菜<牛奶<盐水鸭。
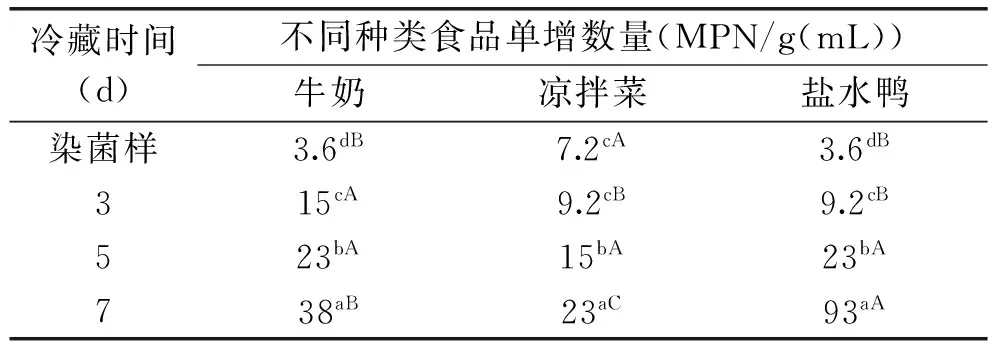
表4 冷藏保存时间对LM数量变化的影响Table 4 The effect of storage time on the variation of LM
2.5 冷冻前后试样中单增李斯特氏菌数量的变化
表5结果显示-20 ℃保存后的试样中LM的数量均有不同程度的增加。牛奶和凉拌菜冷冻3 d后,LM的数量与初始量相比无变化或变化很小,数量差异不具统计学意义(p<0.05),而盐水鸭中的LM数量增加了3倍,与初始对比差异显著(p<0.05)。冷冻保藏过程中,LM的数量在凉拌菜中的增长速度最慢,而盐水鸭中LM的数量增长最快;牛奶、凉拌菜和盐水鸭中LM数量在5 d时分别增长了11.9、3.2和11.9倍,而7 d时增长量分别为25.8、10.4和42倍,三种食品的LM数量在3与5、5与7 d及分别与初始水平相比均有统计学意义(p<0.05)。
三种食品分别在冷藏和冷冻条件下保存到7 d时,LM的数量均大幅度增加,尤其是盐水鸭中的增长量最大,推测熟肉中的蛋白质、维生素等营养物质含量高而有利于LM的生长。由于凉拌菜的初始染菌量与牛奶和盐水鸭不同,无法比较不同种类的食品在同样的保存天数LM数量增长是否有差异,但由表5中的结果可知,LM增长的速度:凉拌菜<牛奶<盐水鸭,与冷藏条件下LM食品种类增长一致。
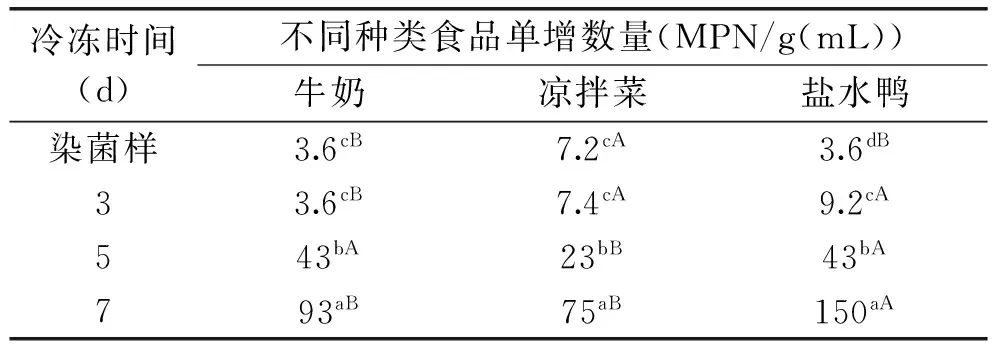
表5 冷冻保存时间对LM数量变化的影响Table 5 The effect on the variation of LM with time of forzen storage
3 结论
本文研究结果对比表明,在LM污染水平较高(≥100 CFU/g(mL)),杂菌含量低(LM含量与杂菌含量比为10∶1)的情况下,平板计数法优于MPN计数法,因此对食品中LM的定量检测较为适用,而在LM污染水平较低(<100 CFU/g(mL))杂菌含量高(LM含量与杂菌含量比为1∶10)的情况下,由于平板计数法没有前增菌和选择性增菌步骤,杂菌会严重干扰可疑LM菌落的识别和鉴定,不能准确进行LM的计数。在选择不同的检测方法时,如不能对食品中LM的数量进行把握,可同时进行两种定量检测方法检测,以期提高样品中LM检测的准确性。食品中LM数量随冷藏和冷冻保存时间的增加而增多,且保存3、5、7 d的同种食品中菌数对比差异显著(p<0.05),因此冷藏或冷冻于冰箱的食品应缩短存储时间而尽快食用,减少“冰箱病”的发生率。
[1]段霞,黄欣,黄岭芳,等. 双抗夹心ELISA方法检测食品中单核细胞增生李斯特氏菌[J]. 食品科学,2010,31(24):272-276.
[2]骆学农,曹晓瑜,才学鹏. 李氏杆菌研究进展[J]. 动物医学进展,2004,25(1):28-31.
[3]郭崇健,张兰荣,高翔,等.2例单核细胞增生李斯特菌病人的病原学分析[J]. 中国卫生检志,2015,25(3):356-357.
[4]冯延芳,冉陆,张立实. 2000-2009年中国李斯特菌病文献报告病析[J]. 疾病检测,2011,22(8):654-659.
[5]杨洋,付草,郭云昌,等. 2005 年中国食源性单核细胞李斯特菌耐药性分析[J]. 卫生研究,2008,37(2):183-186.
[6]阮明捷,游川,李书明,等. 1例单核细胞增生李斯特菌感染引起孕妇的双胎死亡的调查报告[J]. 性病学杂志,2015,16(3):353-354.
[7]Kerr NG,Lacey RW. Listeriosis:new problems with an old pathogen[J]. J of Hospital Infention,1988(12):247.
[8]沈晓盛,郑国兴,李庆,等. 食品中单核细胞增生李斯特菌的危害及其检测[J]. 食品与发酵工业 2004,30(8):87-91.
[9]金伟平,黄志强,刘群群,等. 顶空固相微萃取-气质联用法分析单增李斯特菌污染冷藏牛肉的挥发性物质[J]. 食品科学,2012,33(2):243-247.
[10]Law WF,Ab Mutalib NS,Chan KG,et al. An insight into the isolation,enumeration,and molecular detection ofListeriamonocytogenesin food[J]. Front Microbiology,2015(6):1227.
[11]李云霞,陈雯雯,顾晨荣,等. 单增李斯特菌的检测方法研究进展[J]. 上海师范大学学报:自然科学版,2015,44(6):687-693.
[12]郭倩倩. 多重PCR技术和重组DNA技术在水产品安全中的应用[D]. 上海:上海海洋大学,2010.
[13]中华人民共和国卫生部. GB 4789.30-2016 食品安全国家标准-食品卫生微生物学检验-单核细胞增生李斯特氏菌检验[S]. 北京:中国标准出版社,2016.
[14]中华人民共和国卫生部. GB 4789.2-2016 食品安全国家标准-食品卫生微生物学检验-菌落总数测定[S]. 北京:中国标准出版社,2016.
[15]中华人民共和国卫生部. GB 4789.3-2016 食品安全国家标准-食品卫生微生物学检验-大肠菌群计数[S]. 北京:中国标准出版社,2016.
[16]中华人民共和国卫生部. GB 4789.10-2016 食品安全国家标准-食品卫生微生物学检验-金黄色葡萄球菌检验[S]. 北京:中国标准出版社,2016.
