海蜇胶原蛋白肽的酶解制备工艺
2018-04-26李玉芬郑明星叶秀云
李玉芬,郑明星,叶秀云,林 娟
(福州大学福建省海洋酶工程实验室,福建福州 350116)
自由基的累积会造成机体严重损伤,与DNA损伤、心血管疾病、衰老和癌症等疾病息息相关。早期对机体内自由基的清除多采用一些合成类抗氧化剂,如丁羟甲苯和叔丁基羟基茴香醚等。但是由于这些合成类抗氧化剂对人体具有较强的毒副作用,我国政府已经限制了该类添加剂的用量。因此寻找天然、高效且无毒副作用的新型抗氧化剂是近几年的研究热点。一些研究表明,胶原蛋白肽对自由基具有良好的清除效果,是一种天然的抗氧化剂。Li等[1]使用不同蛋白酶酶解猪皮胶原蛋白,得到氨基酸序列为QGAR的抗氧化肽,具有较高的DPPH自由基清除能力、金属离子螯合能力和脂质过氧化抑制能力。胶原蛋白肽拥有独特的氨基酸组成,拥有多种生理功能活性[2-3],如降血压、抗黑色素、免疫活性、促进钙吸收和抗关节炎等,具有广阔的应用前景。
目前制备胶原蛋白肽最常用的方法是酶解法,其工艺主要包括单酶酶解法[4]和复合酶酶解法[5]。较为常用的提取用酶为胃蛋白酶[6]、中性蛋白酶[7]、碱性蛋白酶[8]和胰蛋白酶[9]等。研究发现,单一酶作用范围较小,只能使小部分的蛋白降解;而选用复合酶法进行水解,可有效增大底物的水解程度,可以使得更多的活性氨基酸残基暴露出来[10]。
本文以海蜇加工下脚料为原料提取胶原蛋白,在单因素实验的基础上,采用响应面法对海蜇胶原蛋白肽的单酶水解工艺进行优化,并进一步与复合酶水解工艺进行比较,确定海蜇胶原蛋白肽的最优制备工艺,为海蜇加工下脚料的综合利用提供理论依据。
1 材料与方法
1.1 材料与仪器
海蜇加工下脚料 已除盐的南蛰海蜇皮,海蜇体呈伞盖状,通体呈半透明,福建亿达食品有限公司;丙酮、碳酸氢二钠、Tris、浓盐酸(HCl)、福林试剂、谷胱甘肽、胃蛋白酶(1.58 U/mg)、胰蛋白酶(4.40 U/mg)、还原型谷胱甘肽 国药集团;风味蛋白酶(7.62 U/mg)、木瓜蛋白酶(13.73 U/mg)、中性蛋白酶(9.02 U/mg)、碱性蛋白酶(84.63 U/mg) Solarbio公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、血管紧张素转化酶(ACE)、马尿酰-组氨酰-亮氨酸(HHL)、马尿酸、Tyrosinase Sigma公司;DPPH Aladdin公司。
T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;HWS24电热恒温水浴锅 上海一恒科技有限公司;THZ-82恒温振荡器 国华企业;BC/BD-320HCN卧式冷藏冷冻转换柜 海尔集团;TP-114分析天平、UB-7pH计 DENVER INSTRVMENT;U-2910双光束分光光度计、CF16R-XI高速冷冻离心机 HITACHI;移液枪 Eppendorf;GL-3250C漩涡混合器 Qilinbeier;BL25H11搅拌机 广东美的生活电器制造有限公司。
1.2 实验方法
1.2.1 海蜇胶原蛋白肽的提取 将海蜇加工下脚料用清水冲洗,将除盐的海蜇用搅拌机搅碎20 min,过滤沥干;添加丙酮溶液没过海蜇,静置1 d,蒸馏水清洗至无异味,过滤沥干;置于0.1 mol/L磷酸氢二钠溶液中浸泡三次,每3 h更换一次溶液,蒸馏水清洗至中性,过滤沥干,4 ℃冰箱存放备用。
取一定质量的海蜇皮匀浆,加入一定体积相应pH的缓冲液至一定料液比,添加一定比例的蛋白酶,置于一定温度酶解一定时间;待反应结束后,将酶解液置于沸水浴中加热10 min使蛋白酶失活,13000 r/min离心10 min,取上清多肽液进行水解度(DH)和还原力(RP)测定。
1.2.2 缓冲液体系 Phosphate缓冲体系:pH(6.0、6.5、7.0、7.5、8.0)的缓冲液由0.1 mol/L的Na2HPO4·12H2O和0.1 mol/L NaH2PO4·2H2O配制而成。
Tris-HCl缓冲体系:pH(8.0、8.5、9.0)的缓冲液由0.1 mol/L的Tris和0.1 mol/L的HCl配制而成。
1.2.3 蛋白酶的选择 以DH和RP为指标,在酶添加量100 U/g、料液比1∶1 (g/mL)和酶解时间4 h条件下,比较六种不同蛋白酶在其最适酶解条件(见表1)下对海蜇蛋白的酶解效果,并选用最适的两种蛋白酶用于下一步实验研究。

表1 不同蛋白酶的最适酶解条件Table 1 Optimal enzymatic conditions of different protease
1.2.4 单因素实验
1.2.4.1 温度对酶解效果的影响 在酶添加量1.0%、酶解时间2 h、料液比1∶2 (g/mL)和pH7.0条件下,考察了不同温度(30、35、40、45、50、55 ℃)对胰蛋白酶和风味蛋白酶酶解效果的影响,测定酶解液的DH和RP。
1.2.4.2 pH对酶解效果的影响 在酶添加量1.0%、酶解时间2 h、料液比1∶2 (g/mL)和温度45 ℃条件下,采用两种不同缓冲体系(Phosphate缓冲体系和Tris-HCl缓冲体系)考察了不同pH(6.0、6.5、7.0、7.5、8.0、8.5)对胰蛋白酶和风味蛋白酶酶解效果的影响,测定酶解液的DH和RP。
1.2.4.3 料液比对酶解效果的影响 在酶添加量1.0%、酶解时间2 h、温度45 ℃和pH8.0(pH7.0)条件下,比较不同料液比[3∶1、2∶1、1∶1、1∶2、1∶3、1∶4、1∶5 (g/mL)]下胰蛋白酶(风味蛋白酶)的酶解效果,测定酶解液的DH和RP。
1.2.4.4 酶添加量对酶解效果的影响 在料液比1∶1 (g/mL)、酶解时间2 h、温度45 ℃和pH8.0(pH7.0)条件下,比较了不同酶添加量(1.0%、2.0%、3.0%、4.0%、5.0%、6.0%、7.0%)对胰蛋白酶(风味蛋白酶)酶解效果的影响,测定酶解液的DH和RP。
1.2.4.5 酶解时间对酶解效果的影响 在酶添加量3.0%(酶添加量4.0%)、料液比1∶1 (g/mL)、温度45 ℃和pH8.0(pH7.0)条件下,测定不同酶解时间(2、3、4、5、6、7 h)下胰蛋白酶(风味蛋白酶)酶解液的DH和RP。
1.2.5 酶解胶原蛋白的响应曲面实验
1.2.5.1 响应面实验设计 在单因素实验的基础上,以DH和RP为响应值,以蛋白酶的酶解温度、pH和料液比作为自变量进行响应曲面实验,在Box-Behnken中心组合实验进行设计,确定海蜇蛋白单酶最优酶解工艺。胰蛋白酶因素水平编码表见表2,风味蛋白酶因素水平编码表见表3。

表2 胰蛋白酶响应面实验设计因素水平编码表Table 2 Factors and levels of trypsase response surface experimental design

表3 风味蛋白酶响应面实验设计因素水平编码表Table 3 Factors and levels of flavourzyme response surface experimental design
1.2.6 复合酶酶解工艺研究
1.2.6.1 混合酶解 将两种蛋白酶A、B混合,分别在蛋白酶A和蛋白酶B的最适酶解条件下对胶原蛋白进行酶解,测定DH和RP,比较混合酶对胶原蛋白酶解效果的影响。
1.2.6.2 先后酶解 在蛋白酶A(蛋白酶B)最适的酶解条件下进行酶解,继而添加蛋白酶B(蛋白酶A),在蛋白酶B(蛋白酶A)最适的酶解条件下酶解,测定DH和RP比较先后酶解对胶原蛋白酶解效果的影响。
1.2.7 DH的测定 采用茚三酮法[11],按下式(1)计算DH。
式(1)
式中:DH:蛋白水解度,%;h1:每克原料水解液中游离氨基酸的含量,μmol/g;h0:每克原料溶液中游离氨基酸的含量,μmol/g;h2:对照溶液中游离氨基酸的含量,μmol/g。
1.2.8 RP的测定 参考Liu等[12]的方法,略有修改。在15 mL试管中,依次加入1 mL不同浓度的多肽样品、2.5 mL 0.2 mol/L的磷酸盐缓冲液(pH6.6)和2.5 mL 1%的铁氰化钾溶液;置于50 ℃水浴反应20 min,加入1 mL 10%的三氯乙酸终止反应;取上述溶液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1%的FeCl3溶液,于700 nm处测定其吸光值。吸光值越大表明样品的RP越高。以蒸馏水作为空白对照,同时以谷胱甘肽(GSH)作为阳性对照。其IC50值定义为相对空白组吸光值为0.5时,有效多肽浓度。
1.3 数据处理
利用Design-Expert 8.0软件进行方差分析。
2 结果与分析
2.1 蛋白酶的选择
由图1可知,不同蛋白酶酶解液的DH和RP存在一定的差异;碱性蛋白酶和风味蛋白酶酶解制备的水解液DH最高,分别为36.33%和43.67%,其次为胰蛋白酶(21.92%)和中性蛋白酶(19.17%),胃蛋白酶和木瓜蛋白酶酶解液的DH最低。胰蛋白酶酶解液的RP(0.246)最大,风味蛋白酶(0.122)次之,其余蛋白酶酶解液的RP均较低。可以看出,胰蛋白酶酶解液虽然DH不高,但是其RP是所有蛋白酶酶解液中最高的;而碱性蛋白酶酶解液恰恰相反,拥有较高的DH,其RP却只有0.086;这可能是因为与碱性蛋白酶相比,胰蛋白酶的酶切位点暴露出了更多的活性位点,从而使得水解液拥有更高的RP。综合比较了六种不用蛋白酶的酶解效果,在后续的实验中选取了具有最高RP的胰蛋白酶和最高DH的风味蛋白酶进行下一步单酶酶解工艺优化。

图1 不同蛋白酶的酶解效果比较Fig.1 Effect of different protease treatment on the hydrolysis of protein
2.2 胰蛋白酶酶解制备胶原蛋白肽的工艺优化
2.2.1 单因素实验 胰蛋白酶酶解制备胶原蛋白肽的单因素实验结果如图2~图6所示,温度对胰蛋白酶酶解液的DH和RP的影响趋势类似;随着反应温度的升高,酶解液的DH和RP也随之升高,在45 ℃时达到最大值(图2);在pH8.0时胰蛋白酶酶解液DH和RP均达到最大,偏离该pH,酶解液的DH和RP都呈小幅度的降低(图3);在一定范围内,随着液料比的减小,胰蛋白酶酶解液的DH和RP呈先增大后减小的趋势,在液料比为1∶1 (g/mL)时,DH和RP最大(图4);胰蛋白酶酶解液DH和RP都随酶添加量的增加而增大,在酶添加量大于3.0%时,DH的增大趋势趋于平缓,RP则保持在同一水平(图5);在一定范围内,胰蛋白酶酶解液DH和RP随酶解时间的延长而增大,在4 h之后,DH变化趋于平稳,而RP反而有所下降(图6)。最终确定最佳酶解条件为:酶解温度为45 ℃,pH为8.0,料液比为1∶1 (g/mL),酶添加量为3.0%,酶解时间为4 h。当酶解时间大于4 h,加酶量超过3.0%,胶原蛋白的DH和RP趋于稳定,由于单因素实验结果显示酶解温度、pH、料液比对实验结果的影响比时间和酶添加量对实验影响明显。因此在此基础上,进一步采用响应曲面法研究酶解温度、pH、料液比对DH和RP的影响。
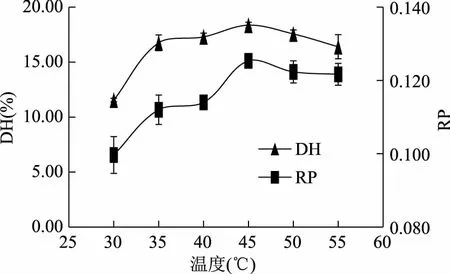
图2 不同温度酶解效果的影响Fig.2 Effect of different temperatures on the hydrolysis of protein

图3 不同pH对酶解效果的影响Fig.3 Effect of different pH values on hydrolysis of protein

图4 不同料液比对酶解效果的影响Fig.4 Effect of different ratios of material to solvent on hydrolysis of protein

图5 不同酶添加量对酶解效果的影响Fig.5 Effect of different proportion of enzymes on hydrolysis of protein

图6 不同酶解时间对酶解效果的影响Fig.6 Effect of different time on hydrolysis of protein
2.2.2 响应曲面实验设计 响应曲面实验设计及结果如表4所示。
利用Design-Expert 8.0软件对表4的实验结果进行回归分析,得到DH(Y1)和RP(Y2)的回归方程分别为:

表4 响应面实验方案及结果Table 4 Design matrix and the correspondingresults of RSM experiments
Y1=28.50-0.60X1+1.01X2-0.084X3-0.17X1X2+0.19X1X3+0.34X2X3-2.00X12-1.18X22-0.44X32
Y2=24.26-0.42X1+1.18X2-0.12X3-0.32X1X2+1.00X1X3+0.84X2X3-1.97X12-2.29X22-0.73X32
进一步对上述模型及回归方程进行方差分析,结果如表5所示。两种模型的p<0.01,失拟项均大于0.05,表明模型效应显著且具有较好的拟合度。对于DH,X1、X2、X2X3、X12、X22和X32均有极显著的影响(p<0.01),X3和交互项X1X2、X1X3在所取水平范围内对DH影响不显著(p>0.05);对于RP,X2、X1X3、X2X3、X12、X22和X32均有极其显著的影响(p<0.01),而X1有显著性差异(p<0.05),X3和交互项X1X2在所取水平范围内对RP影响不显著(p>0.05);由各项的F值可知,各因素对DH的影响程度次序与对RP的影响程度次序一致,依次为X2(pH)>X1(温度)>X3(料液比)。

表5 方差分析表Table 5 Analysis of variance
2.2.3 响应曲面分析与优化 由方差分析结果各项的F值可知,各因素对DH的影响程度次序与对RP的影响程度次序一致,因此主要对RP的三维响应面图和等高线图进行分析。以胰蛋白酶酶解液RP为响应值的三维响应面图及等高线图如图7所示。由图7可知,在一定范围内,随着各因素值的增加,胰蛋白酶酶解液RP均呈不同程度的先上升后下降的趋势。结合等高线图可知,pH对酶解液RP的影响较温度显著(图7a);温度对酶解液RP的影响较料液比显著(图7b);pH对酶解液RP的影响较料液比显著(图7c)。

图7 胰蛋白酶酶解液RP的响应面及等高线图Fig.7 Response surface and contourlines of reducing power of enzymatic hydmlysatcs注:a:温度和pH对RP的影响;b:温度和料液比对RP的影响;c:pH和料液比对RP的影响。
利用已建立的数学模型得出胰蛋白酶的最优酶解条件为:温度43.50 ℃、pH8.33和料液比0.50 g/mL,此时酶解液DH为28.76%,RP为0.24。根据实验条件,将最佳参数调整为:温度44 ℃,pH8.5,料液比0.50 g/mL,并在此条件下进行验证实验,得到DH为(28.26%±0.47%),RP为(0.247±0.002),与理论值有较好的拟合性。
2.3 风味蛋白酶酶解制备胶原蛋白肽的工艺优化
2.3.1 单因素实验 风味蛋白酶酶解制备胶原蛋白肽的单因素实验结果如图8~图12所示,在45 ℃时,风味蛋白酶酶解液的DH和RP最大,分别为24.96%和0.054(图8);在pH7.0时,风味蛋白酶酶解液的DH(25.29%)和RP(0.054)最大(图9);在1∶1 (g/mL)料液比时,拥有最高的DH(25.84%)和RP(0.061)(图10),风味蛋白酶酶解液DH和RP随酶添加量的增加而增大,在酶添加量4.0%之后,酶添加量的增加对DH和RP的影响不大(图11);风味蛋白酶酶解液DH在4 h之后时趋于平稳,RP随酶解时间的延长先升高后降低,在4 h时达到最大0.118(图12)。最终确定风胃蛋白酶最佳酶解条件为:酶解温度为45 ℃,pH为7.0,料液比为1∶1 (g/mL),酶添加量为4.0%,酶解时间为4 h,当酶解时间大于4 h,加酶量超过4.0%,胶原蛋白的DH和RP趋于稳定,由于单因素实验的优化结果显示,酶解温度、pH、料液比对实验结果影响较酶解时间、酶添加量影响大,因此在此基础上,进一步采用响应曲面法研究酶解温度、pH、料液比对DH和RP的影响。

图8 不同温度对酶解效果的影响Fig.8 Effect of different temperatures on the hydrolysis of protein

图9 不同pH对酶解效果的影响Fig.9 Effect of different pH on hydrolysis of protein
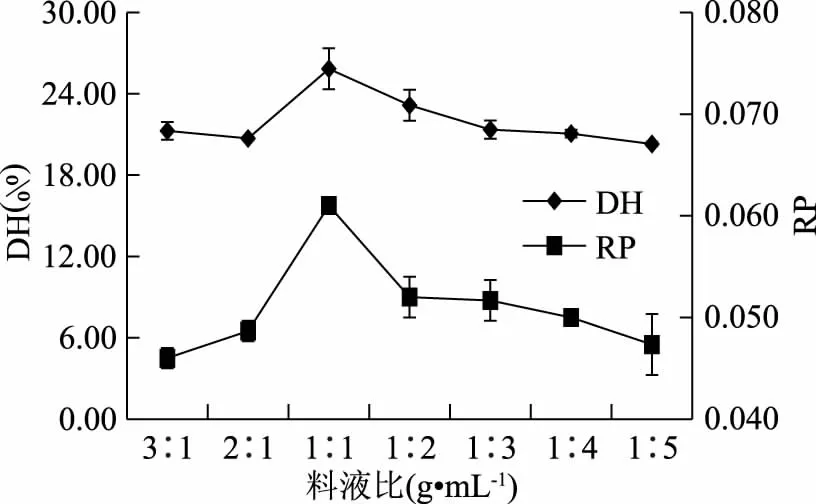
图10 不同料液比对酶解效果的影响Fig.10 Effect of different ratios of material to solvent on hydrolysis of protein

图11 不同酶添加量对酶解效果的影响Fig.11 Effect of different proportion of enzymes on hydrolysis of protein

图12 不同酶解时间对单酶酶解效果的影响Fig.12 Effect of different time on hydrolysis of protein
2.3.2 响应曲面实验设计 响应曲面实验设计及结果如表6所示。
利用Design-Expert 8.0软件对表6的实验结果进行回归分析,得到DH(Y3)和RP(Y4)的回归方程分别为:

表6 响应面实验方案及结果Table 6 Design matrix and the corresponding results of RSM experiments
Y3=47.96-1.16X1+0.98X2+1.78X3+0.045X1X2+0.37X1X3+0.015X2X3-5.16X12-0.94X22-1.65X32
Y4=13.18-0.12X1-0.32X2+0.20X3+0.28X1X2+0.27X1X3-0.13X2X3-0.48X12-0.83X22-0.38X32
对上述模型及回归方程进行的方差分析如表7所示。两种模型的p<0.01,失拟项均大于0.05,表明模型效应显著且具有较好的拟合度。对于DH,X1、X2、X3、X12和X32均有极其显著的影响(p<0.01),而X22有显著性差异(p<0.05),交互项X1X2、X1X3、X2X3在所取水平范围内均对DH影响不显著(p>0.05);由各项的F值可知,各因素对DH的影响程度次序依次为X3(料液比)>X1(温度)>X2(pH)。对于RP,X2、X12、X22和X32均有极其显著的影响(p<0.01),而X3、X1X2、X1X3有显著性差异(p<0.05),X1和交互项X2X3在所取水平范围内对RP影响不显著(p>0.05);由各项的F值可知,各因素对RP的影响程度次序与对DH的影响程度次序有差异,依次为X2(pH)>X3(料液比)>X1(温度)。在下文主要对RP的三维响应面图和等高线图进行进一步分析。

表7 方差分析表Table 7 Analysis of variance
2.3.3 响应曲面分析与优化 以风味蛋白酶酶解液RP为响应值的三维响应面图及等高线图如图14所示。在该实验范围内,随着各因素值的增加,风味蛋白酶酶解液的RP先增大后减小。结合等高线图可知,pH对酶解液RP的影响较温度显著(图14a);温度和料液比对酶解液RP影响的显著性差异不大(图14b);pH对酶解液RP的影响较料液比显著(图14c)。

图14 风味蛋白酶酶解液RP的响应面及等高线图Fig.14 Response surface and contourlines of reducing power of enzymatic hydmlysatcs
构建数学模型分析,得出风味蛋白酶的最优酶解条件为:温度44.10 ℃、pH7.39和料液比0.56 g/mL,在该条件下获得的酶解液DH预测值为48.32%,RP预测值为0.13。根据实验条件,将最佳参数调整为:温度44 ℃、pH7.5、料液比0.56 g/mL,并在此条件下进行验证实验,得到酶解液的DH为(48.26%±0.47%)、RP为(0.14±0.001),与理论值有较好的拟合性。
2.4 复合酶酶解工艺研究
在上述单酶工艺优化的基础上,比较两种蛋白酶不同组合方式(表8)的酶解效果,确定海蜇胶原蛋白的最优复合酶解工艺。
由表8可知,B+A的酶解类型所得的DH(71.56%±0.11%)和RP(0.341±0.001)比其他酶解类型所得的DH和RP均高,所以复合酶的最佳组合方式确定为:先于温度44 ℃、pH7.5、料液比0.56 g/mL和风味蛋白酶添加量4.0%条件下酶解4 h,再于温度44 ℃、pH8.5、料液比0.50 g/mL和胰蛋白酶添加量3.0%条件下继续酶解4 h,所获得水解液的DH和RP分别为:(71.56%±0.0076%)和(0.341±0.0101)。

表8 不同蛋白酶组合方式对海蜇蛋白酶解效果的影响Table 8 Effect of different combinations of proteases on hydrolysis of protein from jellyfish
3 结论
以DH和RP为指标,比较了6种常用蛋白酶对海蜇蛋白的酶解效果,确定胰蛋白酶和风味蛋白酶为最佳水解酶。采用单因素和响应面BBD分别对这两种蛋白酶的酶解工艺进行优化,在实际实验条件下确定胰蛋白酶的最优酶解条件为:温度44 ℃、pH8.5、料液比0.50 g/mL、酶添加量3.0%和酶解时间4 h;风味蛋白酶的最优酶解条件为:温度44 ℃、pH7.5、料液比0.56 g/mL、酶添加量4.0%和酶解时间4 h;进一步选取上述两种蛋白酶进行复合酶解实验,确定复合酶的最佳组合方式为:风味蛋白酶和胰蛋白酶先后酶解,所获得水解液的DH和RP分别为(71.56%±0.0076%)和(0.341±0.0101)。
[1]Li B,Chen F,Wang X,et al. Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry,2007,102(4):1135-1143.
[2]马华威. 双酶分步酶解制备鮟鱇鱼皮胶原蛋白肽及生物活性的研究[D]. 浙江:浙江海洋学院,2014.
[3]丁进锋,苏秀榕,李妍妍,等. 海蜇胶原蛋白肽的降血脂及抗氧化作用的研究[J]. 天然产物研究与开发,2012,24(3):362-365.
[4]刘尊英,李八方,曾名勇,等. 鳕鱼皮胶原蛋白胰蛋白酶控制水解动力学模型[J]. 食品科技,2008,33(2):75-77.
[5]朱俊颖,王耀松,赵黎明,等. 复合酶法制备高纯度鱼基质胶原蛋白肽[J]. 中国食品学报,2015,15(12):47-54.
[6]申锋,杨莉莉,熊善柏,等. 胃蛋白酶水解草鱼鱼鳞制备胶原肽的工艺优化[J]. 华中农业大学学报,2010,29(3):387-391.
[7]陈露. 鲤鱼鱼鳞胶原蛋白肽的制备工艺和分析[D]. 内蒙古:内蒙古农业大学,2013.
[8]闵瑞. 微波辅助酶解提取硫酸软骨素下脚料中胶原蛋白肽的工艺研究[J]. 粮食与食品工业,2016,23(3):51-54.
[9]东忠方,闫鸣艳. 安康鱼鱼皮胶原蛋白多肽酶法制备工艺研究[J]. 食品工业,2013,34(3):87-90.
[10]朱静静,潘道东,孙杨赢,等. 酶解法制备胶原蛋白肽及其抗氧化活性的研究[J]. 宁波大学学报:理工版,2016,29(4):26-32.
[11]蒋婧. 蛋白质水解度测定及其标准曲线绘制研究[J]. 广东轻工职业技术学院学报,2012,11(1):4-6.
[12]Liu J,Jin Y,Lin S,et al. Purification and identification of novel antioxidant peptides from egg white protein and their antioxidant activities[J]. Food Chemistry,2015,175:258-266.
