微波辅助提取橄榄苦苷及其抗氧化性能研究
2018-04-26王晓杰黄立新张彩虹谢普军邓叶俊
王晓杰,黄立新,*,张彩虹,2,谢普军,2,邓叶俊
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏南京 210042;2.中国林业科学研究院 林业新技术研究所,北京 100091)
油橄榄(Oleaeuropaea)为木犀科木樨榄属的常绿乔木,是世界上重要的经济作物。我国从1956年开始陆续引进不同品种的油橄榄[1]。油橄榄果实用于榨取橄榄油,而油橄榄叶则作为废弃物造成资源浪费和环境污染。油橄榄叶中富含多酚、黄酮、糖类、有机酸、皂苷、萜类等活性成分[2-3],近年来酚类物质等活性成分及其经济利用价值得到更多的关注。其中橄榄苦苷拥有较好的抗氧化、抗菌、抗肿瘤、降血糖能力[4-5]。谢普军等[6]测定干燥后橄榄叶中橄榄苦苷的含量为6.530 mg/g,高于橄榄果实中的0.042 mg/g。传统提取橄榄苦苷的热浸提法存在提取时间长,效率低,溶剂用量大等缺点[7],使得一些新式的提取方法逐渐应用到天然产物的提取中。
微波辅助提取是利用微波能来提高提取效率,利用水等极性物质产生局部过热,从物料的内部加速内溶物在溶剂中释放的一种新式提取方法[8-9]。微波萃取的溶剂通常为极性溶剂或者极性溶剂和非极性溶剂的混合物,例如水、乙醇、酸、碱等[10]。这类物质能够吸收微波,使自身的温度升高,从而加热內溶物,使分离速度加快提高萃取效率[11]。党建中等[12]的研究表明微波辅助提取橄榄苦苷时间极短,达到与超临界CO2萃取2 h同等效果,仅需3 min,但没有考察不同提取因素对橄榄苦苷得率的影响。本实验探索提取时间、提取温度、料液比、提取功率等因素对橄榄苦苷得率的影响,在单因素实验的基础上进行 L9(33)正交实验,确定最佳提取条件,可为油橄榄叶橄榄苦苷的提取研究提供借鉴。同时测定了最优提取条件下提取物的总多酚、总黄酮含量以及比较了三种干燥方式对油橄榄提取物抗氧化能力的影响。
1 材料与方法
1.1 材料与仪器
油橄榄叶(九峰6号,叶片较厚,灰绿色) 甘肃武都油橄榄中心;无水乙醇、正己烷、甲醇、乙酸乙酯、蒸馏水、氯化铝、碳酸钠 南京化学试剂有限公司;DPPH、Folin-Ciocalteu、没食子酸 美国西格玛试剂有限公司;芦丁 百灵威科技有限公司;2,6-二叔丁基-4-甲基苯酚(BHT) 西安沃尔森生物技术有限公司;橄榄苦苷(分析标准品,≥98%) 阿拉丁化学试剂有限公司。
电热恒温鼓风干燥箱 上海索普仪器有限公司;电子分析天平 赛多利斯科学仪器有限公司;旋转蒸发器、循环水式真空泵 上海东玺制冷仪器设备有限公司;紫外可见分光光度计 北京谱析通用仪器有限责任公司;真空干燥箱 上海一恒科学仪器有限公司;wizard 2.0型真空冷冻干燥机 美国VirTis公司;灵巧型粉碎机 上海隆拓仪器设备有限公司;高效液相色谱 日本岛津有限公司;MAS-Ⅱ型常压微波合成/萃取反应工作站 上海新仪微波化学有限公司。
1.2 实验方法
1.2.1 原料预处理 油橄榄叶自然风干至水分含量9.44%,用粉碎机粉碎,过60目筛,得到粒径小于0.2 mm的橄榄叶粉末,放入密封袋中,在室温下避光保存。
1.2.2 橄榄苦苷的提取 1 g橄榄叶粉放入50 mL的三颈圆底烧瓶中,与一定量的溶剂混合均匀,在转速为400 r/min、微波频率2450 MHz的条件下,取不同的提取时间、料液比、提取温度和提取功率进行微波提取橄榄苦苷实验。提取液趁热抽滤后,用等量正己烷萃取3次,浓缩提取物,用乙醇定容于100 mL容量瓶中。
1.2.3 标准曲线的制作
1.2.3.1 橄榄苦苷标准曲线的绘制 色谱柱以甲醇∶水(v/v,0.45∶0.55)为流动相,液相色谱的紫外检测波长、流速及柱温箱温度分别为1 mL/min、280 nm和30 ℃。所使用的色谱分离柱为C18ODS2,其规格为Φ4.6 mm×200 mm、填料粒径为5 μm。
取1.6 mg橄榄苦苷标准品,配制成1.0 mg/mL的标准溶液,分别进样4、8、12、16、20 μL的体积量。以橄榄苦苷的质量为横坐标,以峰面积为纵坐标,得橄榄苦苷标准曲线回归方程为Y=175548.9+282316.2X,R2=0.9949;橄榄苦苷对照品的质量在4~20 μg范围之内。
1.2.3.2 没食子酸标准曲线的绘制 对Yu等[13]的方法稍作修改,配制0.1 mg/mL的没食子酸标准溶液,避光保存;配制0.2 mol/mL的Folin-Ciocalteu溶液,避光保存。分别取0.0、0.2、0.4、0.6、0.8、1.0 mL的没食子酸标准溶液,加入1.0 mL的Folin-Ciocalteu试剂,混合均匀;加入2.0 mL的15%碳酸钠溶液,混合均匀;加水定容至10 mL,摇匀,避光静置反应90 min,用分光光度计测定760 nm处的吸光度。以没食子酸浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。标准曲线回归方程为Y=77.157X+0.0224,R2=0.9974;没食子酸对照品浓度在0.002~0.010 mg/mL范围之内。
1.2.3.3 芦丁标准曲线的绘制 引用郑媛媛等[14]的方法,测定油橄榄提取物总黄酮含量。以芦丁标准品浓度为横坐标,吸光度为纵坐标。标准曲线回归方程为Y=24.894X+0.0211,R2=0.9981。芦丁对照品浓度在0.01~0.05 mg/mL范围之内。
1.2.4 橄榄苦苷得率的计算 得率的计算公式为:Y(%)=C×V/1000/M×100,其中C为提取物中橄榄苦苷的浓度(mg/mL),V为提取液的体积(mL),M为原料的质量(1 g)。
1.2.5 单因素实验 在料液比1∶40 g/mL、时间2 min、温度50 ℃、提取功率600 W的情况下,考察乙醇浓度(55%、65%、75%、85%、95%)对橄榄苦苷得率的影响,取最优乙醇浓度,并依次考察提取时间(1、2、3、4、5 min)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、提取温度(20、30、40、50、60 ℃)、微波提取功率(400、500、600、700、800 W)对橄榄苦苷得率的影响。
1.2.6 正交实验设计 在单因素实验的基础上,确定影响橄榄苦苷含量最为关键的三个因素:提取温度、提取时间、料液比,采用 L9(33)正交实验,因素水平见表1,以橄榄苦苷得率为评价指标,最终获得微波提取橄榄苦苷优化工艺。

表1 因素水平表Table 1 Factors and levels table
1.2.7 热浸提提取 根据叶建中等[15]热浸提优化提取橄榄苦苷的实验,表明提取时间3 h可作为最佳提取时间,同时选取和微波辅助提取相同的料液比和乙醇浓度作为提取条件进行橄榄苦苷的提取实验。提取完成后,趁热抽滤,用等量正己烷萃取三次,用乙醇定容于100 mL的容量瓶中待测。
1.2.8 油橄榄叶提取物的干燥方法以及干燥后水分的测定 取1 g橄榄叶粉以最佳提取条件提取,重复提取6次,将6份提取液合并,并平均分为四份并标记为A、B、C、D,分别在旋转蒸发仪中(35 ℃)去除乙醇,收集水溶液,将除去乙醇的A溶液放入鼓风干燥机中在30 ℃的条件下干燥24 h,B溶液放入冷冻干燥机在-10 ℃、真空度1.48×10-4MPa下干燥24 h,C溶液放入真空干燥机中在30 ℃、真空度0.08 MPa的条件下干燥24 h。D溶液放入鼓风干燥机中在50 ℃的条件下24 h。采用105 ℃恒重法(烘箱干燥105 ℃,3 h)测定干燥产品的水分含量。分别称取干燥产品用甲醇配制成0.2、0.4、0.6、0.8、1.0 mg/mL的油橄榄叶提取物溶液。
1.2.9 DPPH自由基清除能力测试 根据 Brand-Williams[16]的方法,用甲醇溶液配制不同浓度的油橄榄叶提取物和0.5 mmol/L的DPPH溶液。取0.5 mL不同浓度的橄榄叶提取物溶液与2.5 mL的DPPH溶液混合均匀,在暗室反应30 min,在517 nm处测量吸光度值,实验以BHT作为对照。DPPH自由基清除率公式如下:
式中,A0为DPPH醇溶液的初始值;A1为加入橄榄叶提取物溶液后的吸光度值。
1.2.10 ABTS+·清除能力测定 对Re等[17]的方法稍作修改,配制4 mL ABTS+·储备液,其中过硫酸钾浓度为2.45 mmol/L,ABTS浓度为7 mmol/L。在黑暗处反应16 h,储备液用磷酸盐缓冲液(pH=7.4)稀释,稀释40~50倍,使其在734波长处吸光度为0.680~0.720之间。取0.05 mL1.0 mg/mL橄榄叶提取物加入4 mL ABTS+·测定液,振荡30 s,在734 nm波长处测定反应一段时间后的吸光度。ABTS+·自由基清除率公式如下:
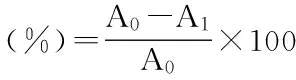
式中,A0为ABTS+·测定液的初始值;A1为加入橄榄叶提取物溶液后的吸光度值。
1.3 数据处理
2 结果与讨论
2.1 单因素实验
2.1.1 提取溶剂的选择 由图1可知,甲醇溶液提取效果最好,其次是乙醇,水的得率最低,此结果与谢普军等[18]不同溶剂的提取效果相似。原因可能是醇溶液的极性与橄榄苦苷的极性相近,根据相似相溶的原理,橄榄苦苷在醇溶液中有很好的溶解性[19]。其次,细胞质主要由脂类等物质构成,醇等脂溶性物质易于进出。考虑到用甲醇或乙醇提取橄榄苦苷得率相近以及甲醇的毒性,所以选用乙醇作为提取溶剂。
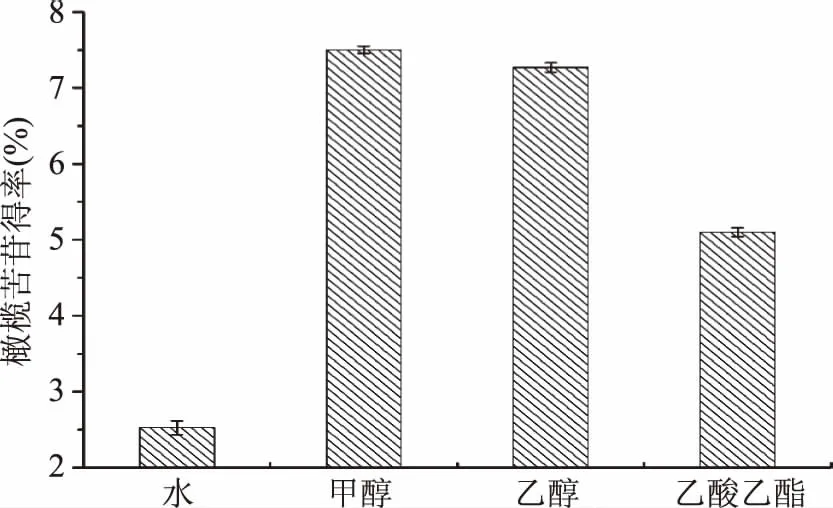
图1 提取溶剂对橄榄苦苷得率的影响Fig.1 Effects of solvent type on oleuropein yield
2.1.2 乙醇浓度的选择 由图2可知,随着乙醇浓度逐渐升高,橄榄苦苷得率先增加后减少,当乙醇浓度为75%时,橄榄苦苷的得率最高为7.93%。当乙醇浓度超过75%时,橄榄苦苷的得率开始下降,极可能的原因是75%的乙醇浓度的极性与橄榄苦苷的极性相近,橄榄苦苷更易在其中溶解。另外细胞膜主要由脂质、蛋白质构成,控制物质的进出,醇等脂溶性物质更易在细胞中进出[19]。
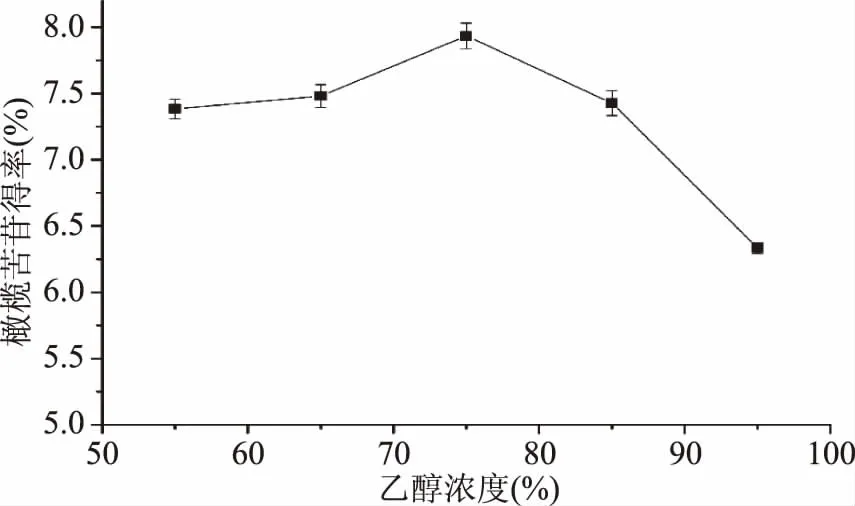
图2 乙醇浓度对橄榄苦苷得率的影响Fig.2 Effects of extraction time on oleuropein yield
2.1.3 提取时间的选择 由图3可知,橄榄苦苷得率随着时间的延长先增加后减少,当提取时间为2 min时,橄榄苦苷的提取率最高,可达8.08%,提取时间为3 min时,橄榄苦苷的得率为7.74%,两者的提取效果相近,说明微波提取在2 min左右完成提取,之后橄榄苦苷得率稍有下降并趋于平稳,从提取效果和时间成本综合考虑,2 min提取效果最好。
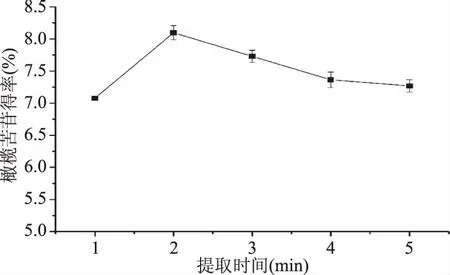
图3 提取时间对橄榄苦苷得率的影响Fig.3 Effects of extraction time on oleuropein yield
2.1.4 料液比的选择 由图4可知,随料液比增大,橄榄苦苷得率先是增加后趋于平稳。当料液比增加到1∶40时,橄榄苦苷提取得率达到8.25%。在达到1∶40的料液比之前,橄榄苦苷得率与料液比呈现正相关。随料液比的增大,溶剂中橄榄苦苷浓度降低,浓度差加大,橄榄苦苷不断从油橄榄叶片中溶解到溶剂中,橄榄苦苷得率增加,当料液比超过1∶40时,橄榄苦苷得率几乎没有变化。从节约资源和成本方面考虑,选择1∶40的料液比作为最佳料液比。

图4 料液比对橄榄苦苷得率的影响Fig.4 Effects of solid to liquid ratio on oleuropein yield
2.1.5 提取温度的选择 由图5可知,随提取温度升高,橄榄苦苷得率先增加后减少,提取温度为40 ℃橄榄苦苷得率为7.36%提取温度为50 ℃时,橄榄苦苷得率达到最高为7.51%,两者非常接近。在50 ℃之前,橄榄苦苷得率与提取温度呈现正相关,随温度升高,物质的传质传热加快,更多的橄榄苦苷在溶剂中溶解,橄榄苦苷得率增加。在50 ℃之后,橄榄苦苷得率几乎没有变化,从节约能源的角度考虑,选取提取温度50 ℃作为最佳提取温度。
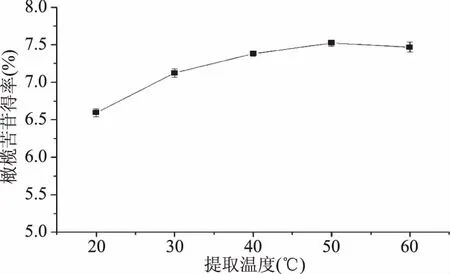
图5 提取温度对橄榄苦苷得率的影响Fig.5 Effects of extraction temperature on oleuropein yield
2.1.6 提取功率的选择 由图6可知,随提取功率升高,橄榄苦苷得率先增加后减少,在提取功率为600 W时,橄榄苦苷得率最高为8.02%。微波功率增加,达到预设温度的时间越短,在更多的时间内维持较高温度,传质效率提高,提取效果相对较好。当功率过大时,易于引起溶液剧烈蒸发,从而影响橄榄苦苷溶解。综合考虑,最佳提取功率为600 W。
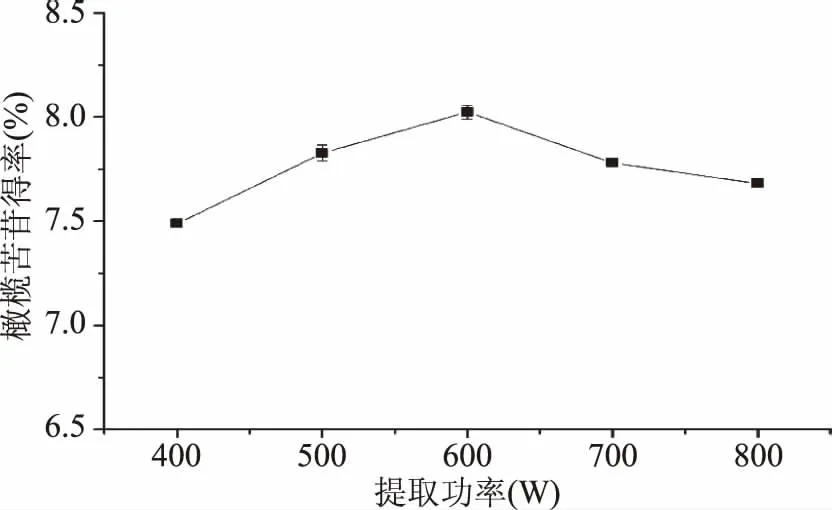
图6 提取功率对橄榄苦苷得率的影响Fig.6 Effects of extraction power on oleuropein yield
由单因素实验结果可知,单因素提取橄榄苦苷的优化条件为提取时间为2 min,料液比为1∶40,乙醇浓度为75%,提取温度为50 ℃,提取功率为600 W。从图1~图6中橄榄苦苷得率曲线浮动情况可以看出橄榄苦苷得率变化较大的影响因素为提取温度、提取时间、料液比。
2.2 正交实验
正交实验设计法对橄榄苦苷提取工艺进行三因素三水平优化设计,正交结果见表2,方差分析见表3。由极差和方差结果分析可知,三个因素对提取率的影响顺序是料液比>提取时间>提取温度,最佳工艺条件为A1B3C3,即提取温度40 ℃,提取时间3 min,料液比1∶50 g/mL。按所得最佳工艺条件进行实验验证,三次所得橄榄苦苷提取率平均值为(8.06%±0.06%)。
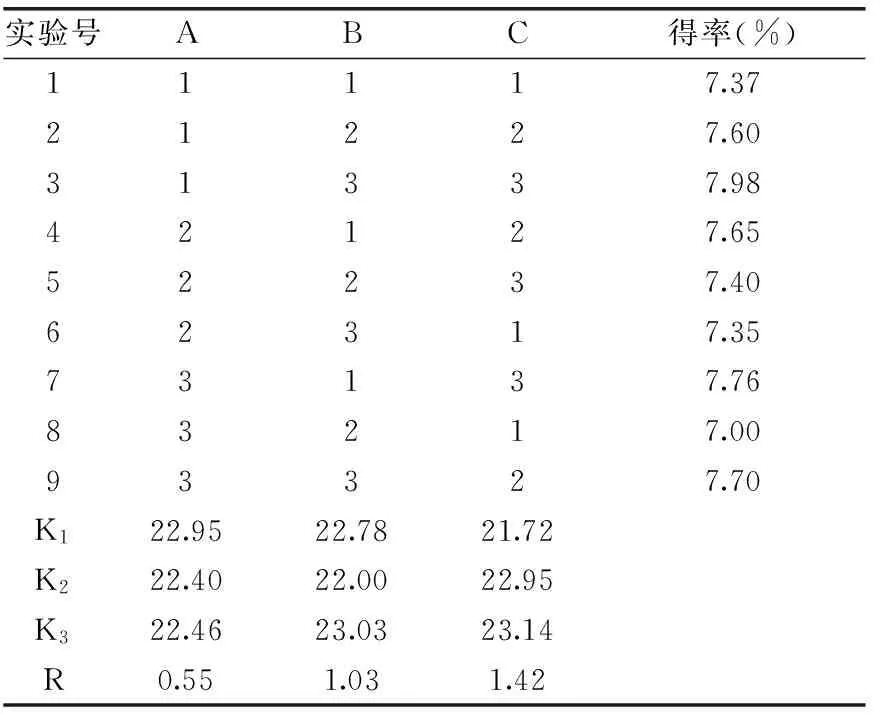
表2 正交实验设计及结果Table 2 Orthogonal array design arrangement and experimental results
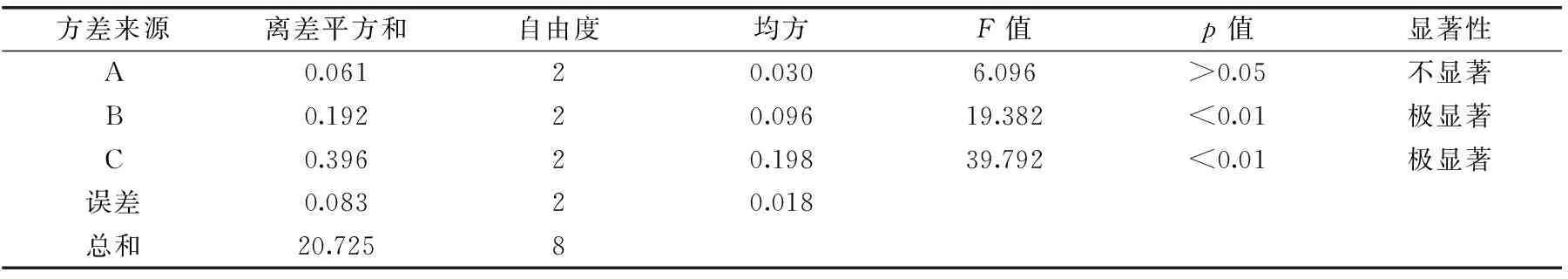
表3 正交实验方差分析表Table 3 Analysis of variance for the results of orthogonal test
2.3 与传统提取方法的比较
2.3.1 活性成分含量对比 从图7可以看出微波辅助提取活性物质的含量优于热浸提,微波辅助提取橄榄苦苷的含量为8.06%±0.06%,热浸提为6.61%±0.16%,微波辅助提取橄榄苦苷得率提高了21.94%,且微波所需时间仅为3 min,而热浸提则需要3 h。微波辅助提取总多酚和总黄酮含量分别为7.85%±0.01%和2.20%±0.11%,同样高于热浸提。因此,相对于传统提取方式,微波辅助提取提取时间短,能耗少,提取效率高等优点。
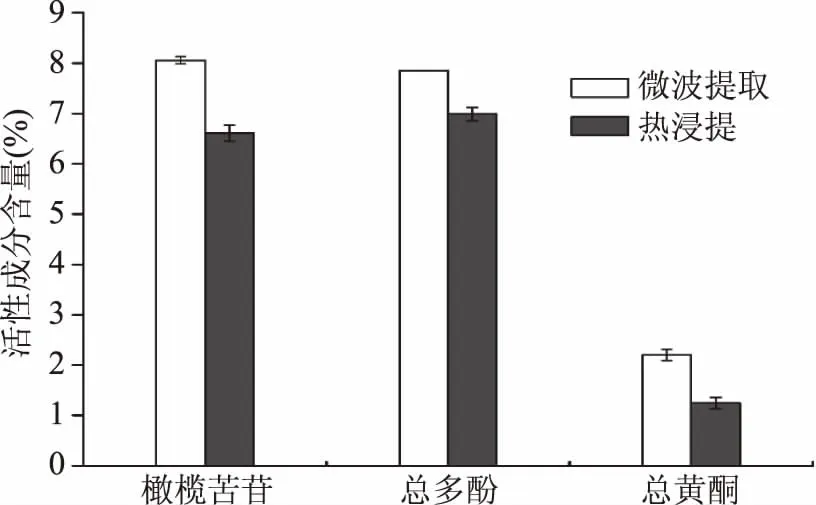
图7 不同提取方法活性成分比较Fig.7 Comparison of different extraction method on active components
2.3.2 抗氧化性能对比 分别取1.0 mg/mL油橄榄叶提取物按照1.2.9中的方法测定DPPH自由基清除能力,按照1.2.10中的方法测定ABTS+·清除能力。由图8可知,微波辅助提取DPPH自由基清除率为73.52%±1.06%,高于热浸提的55.99%±0.37%。微波辅助提取ABTS+·清除率为52.41%±0.58%稍高于50.85%±0.76%的热浸提。根据2.3.1,微波辅助提取总多酚和总黄酮的含量明显高于热浸提,而多酚和黄酮等活性物质有很好的自由基清除能力[20],因此相比于传统提取方法热浸提,微波辅助提取抗氧化性更显著。
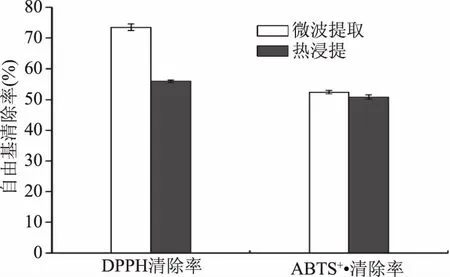
图8 不同提取方法抗氧化性能比较Fig.8 Comparison of different extraction method on antioxidant properties
2.4 不同干燥方式下橄榄苦苷提取物的DPPH自由基清除能力
橄榄苦苷提取物作为溶液体积过大,易变质,不利于保存,干燥成固体便于保存和运输,而且不同的干燥方式对于活性物质的抗氧化活性存在影响[21-22],由此探讨了三种干燥方式以及鼓风干燥两种干燥温度干燥产物的水分含量以及干燥产物对于DPPH自由基清除能力的影响。运用1.2.8中105°恒重法测四种干燥产物的水分含量为真空干燥6.11%、真空冷冻干燥5.91%、鼓风干燥(30 ℃)4.97%,鼓风干燥(50 ℃)4.72%。鼓风干燥(50 ℃)水分含量最少,其次是鼓风干燥(30 ℃),而从由图7可以看出,鼓风干燥(30 ℃)DPPH自由基清除能力要优于鼓风干燥(50 ℃),说明一部分抗氧化成分在高温条件下丧失活性[23]。随油橄榄叶提取物浓度增加,清除DPPH自由基的能力增强,其中鼓风干燥清除自由基能力最强,通过曲线拟合,鼓风干燥(30 ℃)、真空冷冻干燥、真空干燥和鼓风干燥(50 ℃)清除DPPH自由基的IC50值分别为0.65、0.69、0.71和0.83 mg/mL。真空冷冻干燥、真空干燥和鼓风干燥(30 ℃)的干燥产物DPPH自由基清除能力非常接近,说明三种干燥方式所保留的活性物质含量相近。综上所述,要较大程度地保留提取物的抗氧化活性应采取低温或真空冷冻的干燥方式。
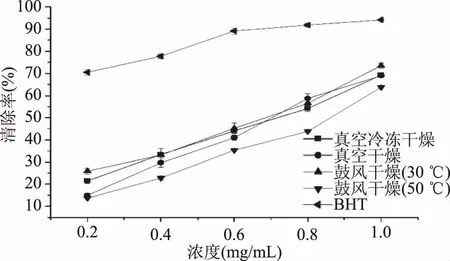
图9 不同浓度样品经不同方式干燥后的DPPH自由基清除效率Fig.9 Different samples on scavenging DPPH radical efficiency
3 结论
在单因素实验的基础上,采用三因素三水平正交实验确定了微波辅助提取橄榄苦苷的最佳提取工艺:乙醇浓度75%,料液比 1∶50 g/mL,提取温度40 ℃,提取时间 3 min,提取功率600 W。在此条件下,橄榄苦苷得率为8.06%±0.06%,总多酚含量为7.85%±0.01%,总黄酮含量为2.20%±0.11%。将传统提取方式热浸提与微波辅助提取进行比较,前者橄榄苦苷得率为6.61%±0.16%,而微波辅助提取的得率为8.06%±0.06%,说明微波辅助提取具有提取时间短、效率高、能耗少等优点,是天然活性成分提取的一种有效的提取手段。比较三种干燥方式以及鼓风干燥两种干燥温度DPPH自由基清除能力,真空冷冻干燥、鼓风干燥(30 ℃)、鼓风干燥(50 ℃)以及真空干燥的IC50值分别为0.69、0.65、0.83和0.71 mg/mL,说明低温或真空冷冻干燥能较大程度的保存提取物的活性。
[1]王贵禧,俞宁,邓明全,等. 中国油橄榄发展概况[J]. 林业实用技术,2000(1):18-19.
[2]朱静平. 油橄榄叶中活性成分初步分析[J]. 湖北农业科学,2012,51(15):3315-3317.
[3]王百川,付绍平,王丹,等. 超高压液相色谱-飞行时间质谱法分析国产油橄榄叶中酚类化合物[J]. 食品科学,2011,32(18):225-229.
[4]郝婷,崔建玲,赵桂琴,等. 橄榄苦苷提取分离和药理活性的研究进展[J]. 承德医学院学报,2010,27(1):69-72.
[5]吴遵秋,姜友军,苏光灿,等. 油橄榄叶中橄榄苦苷的体外抗氧化和抑菌活性[J]. 食品科学,2014,35(21):94-99.
[6]谢普军. 油橄榄叶高值化利用技术及机理研究[D]. 北京:中国林业科学研究院,2015.
[7]叶建中,高彩霞,周昊,等. 油橄榄中橄榄苦苷的提取及纯化工艺研究[J]. 生物质化学工程,2011,45(3):35-40.
[8]Kaufmann B,Christen P. Recent extraction techniques for natural products:Microwave-assisted extraction and pressurised solvent extraction[J]. Phytochemical Analysis,2002,13(2):105-113.
[9]Destandau E,Michel T,Elfakir C. Microwave-assisted extraction[M]. UK:RSC Publishing,Cambridge,2013.
[10]Eskilsson C S,Björklund E. Analytical-scale microwave-assisted extraction[J]. Journal of Chromatography A,2000,902(1):227-250.
[11]刘明言,王帮臣. 用于中药提取的新技术进展[J]. 中草药,2010,41(2):169-175.
[12]党建章,黄志立,张志安,等. 橄榄叶中橄榄苦苷不同提取方法的研究[J]. 深圳职业技术学院学报,2006,5(4):34-36.
[13]Yu X,Zhu P,Zhong Q,et al. Subcritical water extraction of antioxidant phenolic compounds from XiLan olive fruit dreg[J]. Journal of Food Science and Technology,2015,52(8):5012.
[14]郑媛媛,李辰,封士兰,等. 油橄榄叶中总黄酮含量测定方法探讨[J]. 光谱学与光谱分析,2011,31(2):547-550.
[15]叶建中,高彩霞,周昊,等. 油橄榄中橄榄苦苷的提取及纯化工艺研究[J]. 生物质化学工程,2011,45(3):35-40.
[16]Brand-Williams W,Cuvelier M E,Berset C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25-30.
[17]Re R,Pellegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology & Medicine,1999,26(9-10):1231-1237.
[18]谢普军,黄立新,张彩虹,等. 低温减压沸腾提取橄榄苦苷的工艺研究[J]. 中国中药杂志,2012,37(13):1946-1951.
[19]孙雅才. 细胞膜的不对称性与流动性[J]. 生物学通报,1986(8):16-18.
[20]罗成,周达,鲁晓翔. 天然产物抗氧化机理的研究进展[J]. 食品工业科技,2009(4):335-339.
[21]陈玮琦,郭玉蓉,张娟,等. 干燥方式对苹果幼果干酚类物质及其抗氧化性的影响[J]. 食品科学,2015,36(5):33-37.
[22]王丽威,金佳慧,于锦,等. 干燥方式对香菇酚类物质抗氧化活性的影响[J]. 食品工业科技,2015,36(9):132-135.
[23]曹立民,张瑾,陈明霞.制备条件对于生姜提取物抗氧化活性的影响.[J]. 食品工业,2001(4):36-38.
