饮用某白酒对大鼠肾上腺髓质细胞DβH、NET表达的影响
2018-04-26陈兴强梁文妹夏白娟李一欣李容瑢
陈兴强,梁文妹,夏白娟,李一欣,李容瑢,尹 丹,李 杰
(贵州医科大学组织学与胚胎学教研室,贵州贵阳550025)
中国是人口大国,经济的快速增长带动了酒类产品消耗量的上升,也使饮酒问题日益突出。全世界每年因不当饮用酒导致330万例死亡,占所有死亡数的5.9%[1]。不当饮用酒被WHO列入全球过早死亡和致残的主要危险因素之一,也是导致多种疾病和损伤病症的重要因素之一[2]。但也有报道,适量饮酒可降低心脏病的发作、动脉粥样硬化和某些类型卒中以及绝经期妇女骨质疏松的危险[3-4]。目前我国饮酒者已超过5亿人,人均酒精饮料消费呈每年递增13%,如何健康饮酒已是当务之急。
多巴胺-β-羟化酶(Dopamine beta Hydroxylase,DβH)位于肾上腺髓质细胞的嗜铬颗粒中,可以将多巴胺(Dopamine,DA)转化成去甲肾上腺素(Norepinephrine,NE),是儿茶酚胺(Catecholamine,CA)合成过程中的关键酶。NE在心血管功能调节、镇痛和情感调节中起到重要作用,DA可以调控心血管功能和影响精神活动[5]。酒精作为中枢神经系统的抑制剂,饮酒后欣快、兴奋表现与DβH水平有关[6]。位于外周神经系统的去甲肾上腺素转运蛋白(Norepinephrine transporter,NET)分布于交感神经节后纤维支配的组织,如心脏、肾上腺髓质、肝脏,是交感神经神经递质信号传导的重要环节,对维持心血管系统正常功能发挥着重要作用[7]。不同的心血管疾病均可伴有交感神经系统异常,而NET的功能变化可能在上述疾病的发生发展中起着重要作用[8-9]。酒类产品作为日常生活中的一种饮品,如何饮酒才能降低或消除其对健康的危害,已经成为众多学者关注的焦点,但关于饮酒对大鼠肾上腺髓质细胞DβH、NET的影响鲜见报道。本实验模拟正常人饮酒习惯,采用54%vol董香型白酒制作大鼠饮酒模型,采用免疫组织化学SABC法、蛋白免疫印迹法检测饮酒后不同剂量和不同时间下大鼠肾上腺髓质细胞中DβH、NET表达水平的变化,旨在为科学健康饮酒提供一定的基础实验依据。
1 材料与方法
1.1 动物分组及模型建立
将健康成年大鼠120只(180~220 g/只)适应性喂养1周后,随机分为正常对照组(normal control group,NCG)30只和实验组(experiment group,EG)90只。实验组随机分为4周组(4W)、8周组(8W)、12周组(12W)、16周组(16W)、20周组(20W)各18只大鼠,每组又分为3个剂量组,即低剂量组(Low dose group,LG,0.8 mL/kg·d)、中剂量组(Middle dose group,MG,1.6 mL/kg·d)及高剂量组(High dose group,HG,2.4 mL/kg·d)。各实验组大鼠分别于每日上午11点及下午5点给予相应剂量的54%vol董香型白酒灌胃1次,直至取材前1天,正常对照组正常喂养。
1.2 取材及标本处理
分别于各取材点麻醉大鼠后处死,取肾上腺组织,部分使用4%多聚甲醛固定,常规石蜡包埋,制作4 μm连续切片(3张/只,每张间隔56 μm),进行免疫组织化学染色;部分肾上腺组织入液氮20 min后,-80℃保存,以备用作蛋白质免疫印迹测定。
1.3 免疫组织化学SABC法
切片常规化蜡下行入水,常温10%甲醇-H2O2处理10 min,羊血清(1∶10)常温下封闭30 min,兔抗NET多克隆抗体(1∶100),兔抗DβH多克隆抗体(1∶150),4 ℃孵育过夜,羊抗兔IgG(1∶100)37 ℃孵育30 min,SABC复合物(1∶100)37 ℃孵育20 min,DAB(中杉金桥)显色,苏木精复染胞核约40 s,中性树脂封片。0.1%PBS缓冲液代替一抗作为阴性对照。
1.4 蛋白免疫印迹
取保存于-80℃的肾上腺组织100 mg,加入裂解液于玻璃匀浆器中研磨至匀浆状,12000 r/min、4℃下离心15 min取上清液,即得到蛋白上清液。采用BCA蛋白定量试剂盒,对所得蛋白上清液进行定量后,5×蛋白上样缓冲液制样,沸水煮5 min,-20℃保存备用,行SDS-PAGE电泳,转至PVDF膜,5%脱脂奶粉封闭,加入兔抗NET多克隆抗体(1∶500)或兔抗DβH多克隆抗体(1∶500),4℃孵育过夜,室温下二抗孵育1.5 h,TBST洗膜后加入化学发光底物(Millipore公司),经CLINX凝胶成像系统曝光,NET在69 kd处显示出特异性条带,DβH在63 kD处显示出特异性条带,以β-action的表达水平为内参,目的蛋白的表达量以目的蛋白与内参照蛋白平均光密度的对比值表示。
1.5 图像分析
随机取正常对照组及各实验组大鼠肾上腺切片,各取3例。在40倍物镜下,每例切片随机选取5个视野。用Image-Pro plus6.0图像分析系统检测肾上腺髓质细胞内NET、DβH阳性细胞的平均光密度。
1.6 统计学方法
采用SPSS 23.0统计学软件进行单因素方差分析(One-Way ANOVA),两两比较采用SNK及LSD法。数据以均值±标准差(±s)表示,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 免疫组织化学结果
光镜下,DβH、NET免疫反应阳性产物呈棕黄色或棕褐色细颗粒状,分布于肾上腺髓质细胞胞质中。与正常对照组比较,4W、8W、12W、16W及20W各实验组肾上腺髓质细胞内DβH、NET免疫染色位置及染色强度未见明显变化,见图1、图2。所有阴性对照组未见阳性反应细胞。
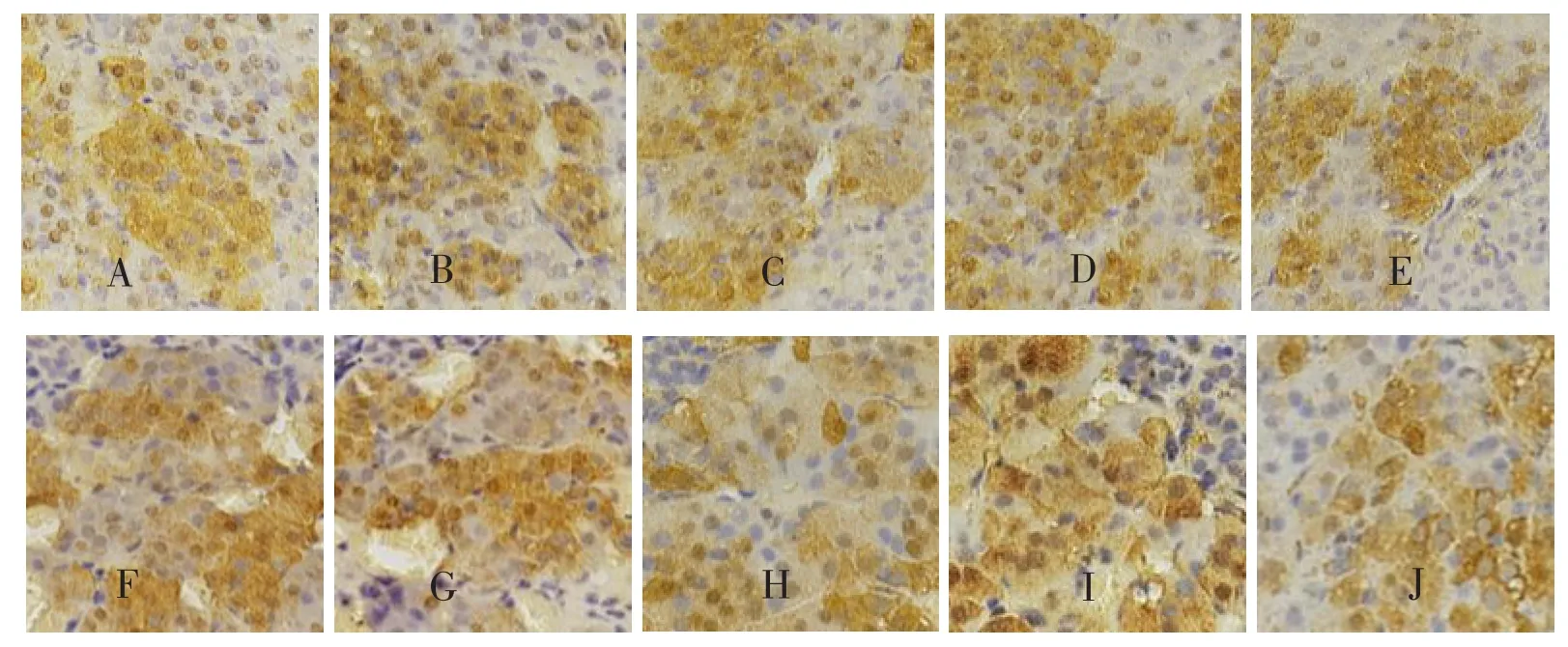
图1 各组大鼠肾上腺髓质DβH阳性细胞(SABC法,×400)
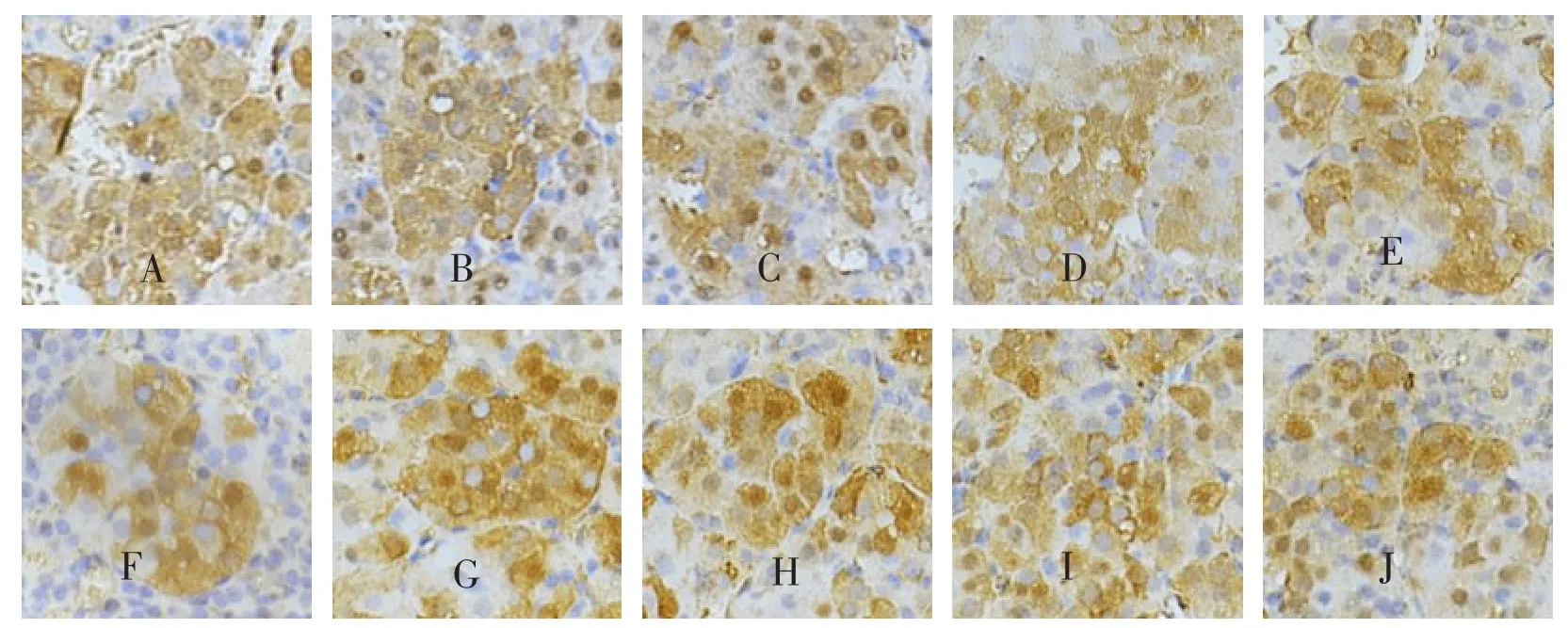
图2 各组大鼠肾上腺髓质NET阳性细胞
2.2 图像分析结果
与正常对照组相比,4W、8W、12W、16W和20W各实验组肾上腺髓质细胞内DβH阳性细胞的平均光密度值未见明显变化(P>0.05)。见表1。
与正常对照组相比,4W、8W、12W、16W和20W各实验组肾上腺髓质细胞内阳性细胞内NET平均光密度值未见明显变化(P>0.05)。见表2。
2.3 蛋白免疫印迹结果及分析
NET、DβH、β-action蛋白分别在69kD、63kD、42kD处显示出特异性条带(图3)。4W、8W、12W、16W及20W各实验组蛋白表达水平与正常对照组相比,差异无统计学意义(p>0.05),见图4、图5。
3 讨论
有研究指出适量饮酒能增强免疫系统功能,对于许多疾病有预防和治疗作用等[10]。但是过多的酒精摄入会带来一定的负效应。NE在肾上腺素交感神经系统的神经传递中起重要作用。NE信号升高与酒精、尼古丁、海洛因等多种药物滥用的发病机制相关[11]。亦有研究显示DβH在调节酒精相关行为和身体反应中起重要作用[12]。各种应激性刺激可使肾上腺嗜铬颗粒中DβH活性增高,DβH的活性可以反映肾上腺髓质的功能状态。DβH能有效地将DA转化为NE。当DβH活性降低时,DA/NE比例升高,强烈激活DA受体,从而不能负反馈调节NE合成[13]。临床研究表明,酒精摄入量与NE有关,急性酒精摄入会影响NE水平,表明NE可能在急性酒精中毒过程中发挥作用[11]。过量饮酒激发了个体的应激反应,激活体内的交感-肾上腺髓质系统,促使儿茶酚胺类物质的释放,最终引起心率增加、血压升高。NET属于单胺类Na+、Cl-依赖性转运蛋白,其功能是将神经元释放的NE再摄取回到突触前膜中,对调控突触间隙中NE浓度、终止神经冲动信号、维持受体对神经递质的敏感性极为重要[14]。有研究报道,在肾上腺髓质细胞中,NET只存在于去甲肾上腺素能细胞中[15]。酒精主要作用于单胺类转运体,通过阻止转运体对神经递质的重吸收,从而增强神经递质的兴奋作用[16]。
表1 各组大鼠肾上腺髓质DβH阳性细胞的平均光密度值 (±s)
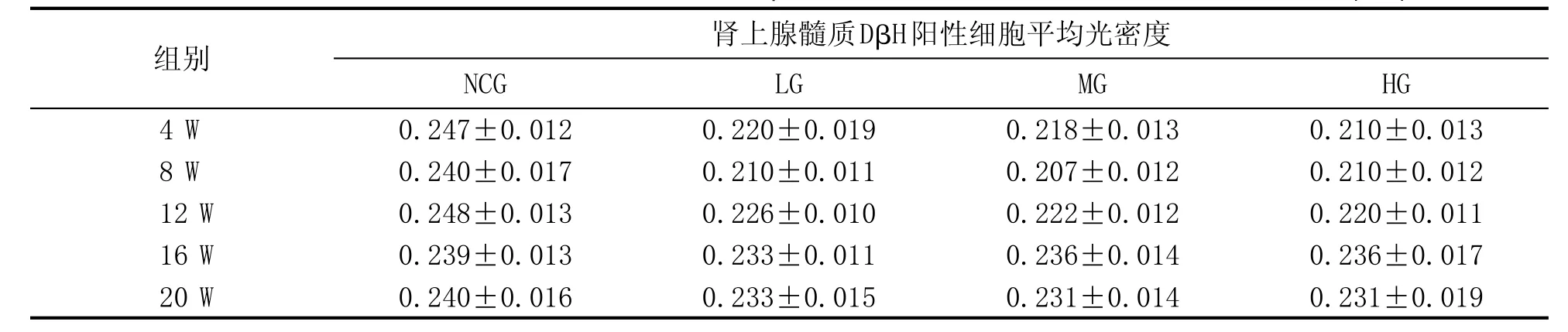
表1 各组大鼠肾上腺髓质DβH阳性细胞的平均光密度值 (±s)
组别4 W 8 W 12 W 16 W 20 W肾上腺髓质DβH阳性细胞平均光密度NCG 0.247±0.012 0.240±0.017 0.248±0.013 0.239±0.013 0.240±0.016 LG 0.220±0.019 0.210±0.011 0.226±0.010 0.233±0.011 0.233±0.015 MG 0.218±0.013 0.207±0.012 0.222±0.012 0.236±0.014 0.231±0.014 HG 0.210±0.013 0.210±0.012 0.220±0.011 0.236±0.017 0.231±0.019
表2 各组大鼠肾上腺髓质NET阳性细胞的平均光密度值 (±s)

表2 各组大鼠肾上腺髓质NET阳性细胞的平均光密度值 (±s)
组别4 W 8 W 12 W 16 W 20 W肾上腺髓质NET阳性细胞平均光密度NCG 0.269±0.016 0.263±0.013 0.267±0.013 0.270±0.013 0.254±0.013 LG 0.236±0.017 0.211±0.012 0.236±0.012 0.269±0.013 0.279±0.013 MG 0.226±0.013 0.229±0.013 0.247±0.012 0.258±0.014 0.287±0.014 HG 0.227±0.015 0.229±0.015 0.236±0.017 0.270±0.012 0.260±0.012
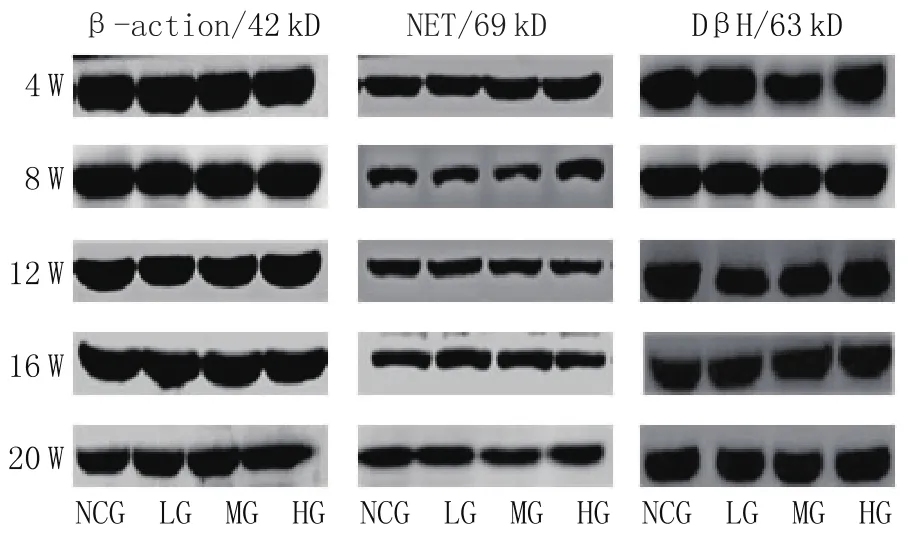
图3 各组肾上腺髓质蛋白表达
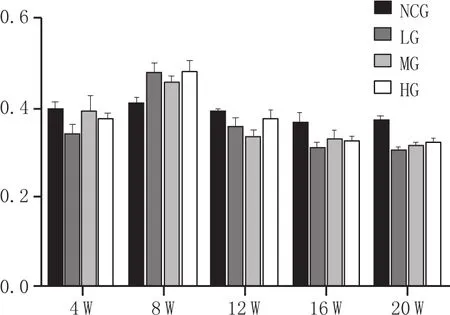
图4 正常对照组及不同剂量白酒灌胃各组大鼠肾上腺组织匀浆中DβH的表达

图5 正常对照组及不同剂量白酒灌胃各组大鼠肾上腺组织匀浆中NET的表达
本实验大鼠每次灌胃剂量分为低剂量组0.8 mL/kg·d、中剂量组 1.6 mL/kg·d及高剂量组2.4 mL/kg·d,通过单位换算,相当于正常成年人(60 kg)每日7.8 mL、15.6 mL及23.4 mL的饮酒剂量。在本实验设计的剂量下,用该白酒灌胃后,实验组动物肾上腺髓质细胞DβH、NET表达水平对比正常组没有显著改变。课题组前期研究成果亦表明,在该剂量下该白酒对大鼠肝细胞、胰岛B细胞的表达无明显影响[17-18]。提示在此剂量下用该白酒灌胃对大鼠肾上腺髓质细胞功能而言属于适量饮酒。
参考文献:
[1]BOSMAN S J,MARARA P,RATH S,et al.Curtailing unhealthy consumption of alcohol for sustainable development in India and South Africa[J].Indian journal of pharmacy practice,2016,9(2):77-85.
[2]World Health Organization.Global status report on alcohol and health,2014[M].World Health Organization,2014.
[3]KALLAA,FIGUEREDO V M.Alcohol and cardiovascular disease in the geriatric population[J].Clinical cardiology,2017,40(7):444-449.
[4]LARSSON S C,WALLIN A,WOLK A.Alcohol consumption and risk of heart failure:meta-analysis of 13 prospective studies[J].Clinical nutrition,2017.
[5]HOWES O D,MCCUTCHEON R,OWEN M J,et al.The role of genes,stress,and dopamine in the development of schizophrenia[J].Biological psychiatry,2017,81(1):9-20.
[6]COLOMBO G,MACCIONI P,VARGIOLU D,et al.The dopamine β-hydroxylase inhibitor,nepicastat,reduces different alcohol-related behaviors in rats[J].Alcoholism clinical&experimental research,2014,38(9):2345-2353.
[7]JORDAN J.Norepinephrine transporter function and human cardiovascular regulation[J].Catecholamine research in the 21st century,2013:193.
[8]NA K H,HO C J,CHUN-HYUNG K,et al.Altered expression of norepinephrine transporter and norepinephrine in human placenta cause pre-eclampsia through regulated trophoblast invasion[J].Clinical&experimental reproductive medicine,2013,40(1):12-22.
[9]REHM J,GMEL G.Aggregate time-series regression in the field of alcohol[J].Addiction,2015,96(7):945-954.
[10]李梦华,刘颖,李艳泽,等.适量饮酒与身体健康关系的研究进展[J].国际免疫学杂志,2016,39(4):417-420.
[11]FITZGERALD P J.Elevated norepinephrine may be a unifying etiological factor in the abuse of a broad range of substances:alcohol,nicotine,marijuana,heroin,cocaine,and caffeine[J].Substance abuse:research and treatment,2013,7:171-183.
[12]YANG B Z,BALODIS I M,LACADIE C M,et al.A preliminary study of DBH(encoding dopamine beta-hydroxylase)genetic variation and neural correlates of emotional and motivational processing in individuals with and without pathological gambling[J].Journal of behavioral addictions,2016,5(2):282-292.
[13]KATO K,FUSHUKU S,YAMAMOTO Y.Age-related changes in immunoreactivity for dopamine β-hydroxylase in carotid body glomus cells in spontaneously hypertensive rats[J].Autonomic neuroscience:basic&clinical,2017,205:50-56.
[14]SATOH N,TOYOHIRAY,TAKAHASHI K,et al.Effects of various pharmacological agents on the function of norepinephrine transporter[J].Journal of UOEH,2015,37(1):33-42.
[15]CLEARY S,BROUWERS F M,EISENHOFER G,et al.Expression of the noradrenaline transporter and phenylethanolamine N-methyltransferase in normal human adrenal gland and phaeochromocytoma[J].Cell&tissue research,2005,322(3):443-453.
[16]GASSER P J,DAWS L C.Editorial for the special issue:monoamine transporters in health and disease[J].Journal of chemical neuroanatomy,2017,83-84:1-2.
[17]王燕林,梁文妹,李容瑢,等.某54度食用白酒对大鼠肝细胞TNF-α表达及凋亡的影响[J].贵阳医学院学报,2017,42(6):661-665.
[18]李容瑢,李一欣,夏白娟,等.适量饮用贵州某食用白酒对Ⅰ型糖尿病小鼠胰岛β细胞的影响[J].解剖学杂志,2017,40(2):141-144.
