毛细管电泳法测定不同体细胞数的原料乳的蛋白组成及含量
2018-04-25任发政郭慧媛
张 明,任发政,方 冰,张 昊,郭慧媛
(1.北京工商大学食品学院,北京 100048;2.中国农业大学北京食品营养与人类健康高精尖创新中心,北京 100083;3.中国农业大学,食品科学与营养工程学院,教育部北京市共建功能乳品重点实验室,北京100083;4.河北省畜产食品工程技术中心,河北三河 065200)
原料乳中含有少量体细胞,包括巨噬细胞(35%~79%),淋巴细胞(16%~28%),多形核中性白细胞(3%~26%)和乳腺组织脱落的上皮细胞(2%~15%)[1-2]。体细胞数即每毫升乳中所含的体细胞总数,是衡量奶牛乳房健康状况和原料乳品质的一项重要指标。
体细胞数量(Somatic Cell Count,SCC)的高低对原料乳蛋白质组成和含量有明显影响。由于来自血液中的白细胞中包含了多种蛋白水解酶,如组织蛋白酶B、C、D及L等[3],直接导致乳中乳清蛋白和酪蛋白含量的剧烈变化。而蛋白质组分的变化也直接影响到原料乳的加工特性。研究表明,原料乳中SSC的增加会导致干酪产量的降低,延长凝乳时间,降低凝乳稳定性;原料乳的SSC的增加引发的酪蛋白水解反应会使得液态奶产生苦味[1]。因此,明确原料乳SCC数量与蛋白质含量组成之间的相互关系,对指导企业原料乳的收购至关重要[4-5]。然而,电泳法、高效液相色谱法等传统蛋白分析方法普遍存在,但存在分离效率差、分辨率低等问题,无法对原料乳主要的蛋白质进行有效的分离和定量测定。
毛细管电泳是一类以毛细管为分离通道、以高压直流电场为驱动力的新型液相分离技术。牛乳中主要的蛋白组成[6],甚至乳清蛋白、乳球蛋白、酪蛋白及其重要降解产物para-κ-酪蛋白[7-9]均可经由毛细管区带电泳方法鉴别。本研究首先建立了乳蛋白的毛细管电泳分析方法;并采集了不同SCC数量原料乳,分析不同SCC数量的原料乳蛋白质含量、组成的变化规律。
1 材料与方法
1.1 材料与仪器
原料乳 来自北京三元集团绿荷渠头牧场的32头荷斯坦乳牛;α-乳白蛋白(α-La)、β-乳球蛋白(β-Lg)、α-酪蛋白(α-CN)、β-酪蛋白(β-CN)和κ-酪蛋白(κ-CN)标准品及二硫苏糖醇 美国Sigma公司;尿素 纯度大于99.5%,美国Amresco公司;大豆分离蛋白(纯度大于90%) 河南正兴食品添加剂有限公司;水解胶原蛋白(纯度大于95%) 郑州蓝天生物科技有限公司。
FossMatic 5000体细胞分析测定仪 丹麦Foss公司;P/ACE MDQ毛细管电泳仪及未涂层毛细管柱 美国Beckman公司;低温离心机 美国Thermo Scientific 公司;超纯水仪 ELGA Lab Water公司;KH5200DB型超声波清洗器 昆山禾创超声仪器有限公司;精密酸度计 北京哈纳科仪科技有限公司。
样品缓冲液:40 mmol/L磷酸二氢钠,0.1% DTT,6 mol/L尿素,用NaOH溶液调节pH至8.0,定容。用0.45 μm水系滤膜对配制好的溶液进行过滤,20 kHz超声10 min,备用。
电泳缓冲液:20 mmol/L磷酸二氢钠,0.05%羟丙基甲基纤维素,6 mol/L尿素,用磷酸溶液调节pH至2.75,定容。用0.45 μm水系滤膜对配制好的溶液进行过滤,20 kHz超声10 min,备用。
1.2 实验方法
1.2.1 原料乳样品的采集及制备 将待测牛乳样品在4 ℃条件下4000 r/min离心20 min除去脂肪,取一定体积的下层脱脂乳,与样品缓冲液按体积比1∶4混合,室温放置1 h后用0.45 μm的水系滤膜过滤,备用。
1.2.2 原料乳的分类 利用体细胞分析测定仪测定每头牛所产牛乳的体细胞数。根据测定结果,将原料乳按照体细胞数含量分为四组:小于3万个/mL、20~25万个/mL、55~60万个/mL及100~130万个/mL。
1.2.3 毛细管区带电泳分离条件 参照文献[10],非涂层毛细管(60 cm×50 μm,有效长度:50 cm),羟丙基甲基纤维素为添加物,设置柱温为35 ℃,紫外检测波长为214 nm,选择pH2.75的磷酸盐缓冲液为样品缓冲液及上样缓冲液,压力进样方式为1.0 psi、10 s,分离电压设为25 kV。
1.2.4 牛乳样品及标准品的毛细管电泳测定 取处理好的牛乳样品1 mL于进样瓶中,按照优化好的电泳条件进行测定,每个样品重复测定两次。毛细管使用前的活化以及实验过程中毛细管的清洗程序如下[8]。
毛细管使用前的活化程序:调节压力至20 psi,先后用0.1 mol/L NaOH溶液、0.1 mol/L HCI溶液和超纯水冲洗10、5和2 min。
样品测定开始前,毛细管的冲洗程序为:调节压力至70 psi,先后用超纯水、0.1 mol/L NaOH溶液、超纯水、电泳缓冲液分别冲洗1、2、2和5 min。
样品测定结束后,毛细管的冲洗程序:调节压力至70 psi,用0.1 mol/L NaOH溶液冲洗10 min,再调节压力至50 psi,先后用0.1 mol/L HCI溶液和超纯水冲洗10和2 min。
1.2.5 牛乳蛋白毛细管区带电泳图谱的建立 将实验样品按照优化好的电泳条件进行测定,得到各自的电泳图谱,并按以下步骤对电泳图谱进行处理:对获得的一系列电泳图谱进行评价并得到牛乳蛋白毛细管区带电泳对照图谱;选择各谱图中峰共有率不低于70%的作为确定指纹峰的依据;采用牛乳蛋白标准品对电泳图谱中的主要乳清蛋白(α-乳白蛋白和β-乳球蛋白)和酪蛋白(α-、β-和κ-酪蛋白)进行标定;并结合已有的文献报道[1,8],确定出这几种蛋白峰之外的电泳峰所代表的乳蛋白种类。
2 结果与讨论
2.1 牛乳蛋白标准曲线及方法评价
各牛乳蛋白标准品的毛细管电泳图谱如图1所示,五种牛乳的主要蛋白组分中,α-La、β-Lg和κ-CN纯度较高,呈现单一主峰;而α-CN主要包含三个组分αs2-CN、αs1-CN及αs0-CN,根据产品标准品说明书及三种蛋白的性质分析,确定迁移时间15.6 min的成分为αs2-CN、迁移时间16.8 min的成分为αs1-CN,迁移时间17.5 min的成分为αs0-CN;β-CN主要包含三个组分β-CN B、βA1-CN和βA2-CN,根据产品标准品说明书及三种蛋白的性质分析,确定迁移时间18.5 min的成分为β-CN、迁移时间19.3 min的成分为βA1-CN,迁移时间20.3 min的成分为βA2-CN。随后,原料乳的检测也能够清晰分辨以上9个主要的蛋白组分(图1)。

图1 牛乳蛋白标准品与原料乳的电泳图谱Fig.1 Electrophoregrams of bovineprotein standards and raw milk注:1:α-La;2:β-Lg;3:αs2-CN;4:αs1-CN;5:αs0-CN;6:κ-CN;7:β-CN B;8:β A1-CN;9:β A2-CN,图2同。
将不同浓度的乳蛋白标准品建立特征峰面积与浓度间的回归方程,并进行重现性和回收率实验,结果见表1。五种牛乳中主要蛋白组分的相对迁移时间及峰面积的相对标准偏差均小于5%,加标回收率均在88%~102%之间,表明方法的精密度和准确度较好。

表1 各蛋白标准品的回归方程、相关系数、线性范围及对应的重复性和回收率Table 1 The regression equation,correlation coefficient,linear range,repeatability and recovery of each protein standard
2.2 不同SSC原料乳的蛋白组成分析
2.2.1 不同SSC数量的原料乳的毛细管电泳分析 采集得到的不同SSC数量的原料乳的毛细管电泳谱图见图2。从图2中可以看出,随着SSC数量的增加,1~9号样品峰的大小有不同程度的变化,尤其是β-CN(7号峰)和βA1-CN(8号峰)出现了显著的下降;而且随着SCC的提升,也有新电泳峰的出现,主要集中在3个迁移时间,分别为10~12 min(组分A)、15~16 min(组分B)和23~27 min(组分C),这些组分可能是由SSC所携带的plasmin等蛋白酶的水解作用生成[11]。
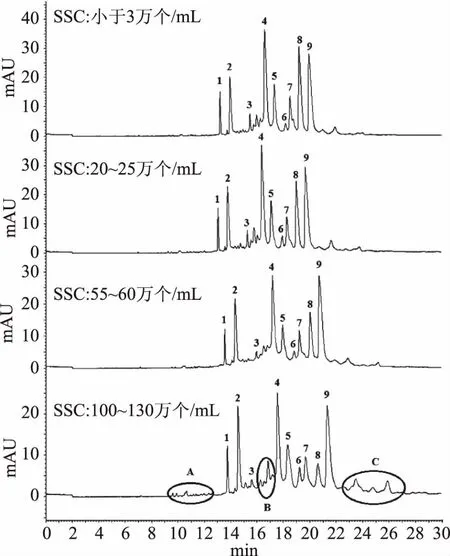
图2 不同体细胞数原料乳样品的电泳图Fig.2 Electrophoregrams of raw milk with different somatic cell count
2.2.2 不同SSC数量的原料乳总蛋白含量变化 不同SSC的原料乳中总蛋白含量变化如图3所示,分别用Foss乳成分及体细胞分析仪和毛细管区带电泳谱图中的峰面积来表征。常用的Foss乳成分及体细胞分析仪测定得到的总蛋白含量结果表明,不同SSC的原料乳间总蛋白含量并无显著变化(p>0.05)。然而,用本文建立的毛细管区带电泳法的结果表明,乳中总蛋白含量随着SSC的增加有上升趋势,当SSC增加到100万个/mL以上时,开始有显著性差异(p<0.05),这一结果与Santos等[1]的报道一致。

图3 不同体细胞数的原料乳中总蛋白含量Fig.3 Total protein contents of raw milk with different somatic cell count
2.2.3 不同SSC数量的原料乳蛋白组成变化 不同SSC的原料乳的毛细管电泳谱图中各特征峰对应的峰面积变化如表2所示。结合表2可知,随着体细胞数的增加,β-CN B和βA1-CN两种蛋白的相对含量显著降低(p<0.05);α-La、αs2-CN和βA2-CN的相对含量没有显著性变化(p>0.05);β-Lg、αs1-CN、αs0-CN、κ-CN的相对含量显著增加(p<0.05)。

表2 电泳图中各组分峰占总峰面积的比例Table 2 The peak area proportions of each component in electrophoregrams
2.2.4 不同SSC数量的原料乳乳清蛋白和酪蛋白的比例的变化 乳清蛋白和酪蛋白的比例是决定原料乳加工方式的重要依据。根据图2中各个蛋白组分的含量结果,分析了不同SCC数量的原料乳中乳清蛋白和酪蛋白的变化规律,结果如表3所示。随着SSC的增加,主要乳清蛋白的含量呈上升趋势,这与已有研究结果一致[3]。同时,酪蛋白占总蛋白的比例随牛乳体细胞数的增加显著降低,这是因为在高体细胞数牛乳中存在相应的蛋白水解酶,能将酪蛋白水解[1]。酪蛋白的水解及乳清蛋白的增加导致总酪蛋白与乳清蛋白的比例逐渐降低(表3),这一比值的改变不仅影响乳蛋白的结构,还会影响乳制品的宏观物性如酸奶的凝胶质量等。研究指出,随着酪蛋白与乳清蛋白比例的升高,酸奶凝胶的硬度和黏度均有所降低,酸奶的颗粒变粗糙。相同固形物含量的酸奶,随着酪蛋白与乳清蛋白比例的降低,酸奶的硬度和持水力均有所增加[12]。

表3 主要乳清蛋白和总酪蛋白占总蛋白的比例Table 3 The proportions of the main whey protein and casein
3 结论
本文利用毛细管电泳法测定了不同SSC的原料乳的蛋白组成及含量,结果表明:当SSC增加到100万个/mL以上时,总蛋白的含量才会显著增加(p<0.05),但不同体细胞数的原料乳中,蛋白组分及含量均不同。随着SSC的增加,α-乳白蛋白、αs2-酪蛋白和βA2-酪蛋白的含量无显著差异(p>0.05),β-CN B和βA1-CN两种蛋白的相对含量显著降低(p<0.05),β-乳球蛋白、αs1-酪蛋白、αs0-酪蛋白、κ-酪蛋白含量均显著增加(p<0.05)。鉴于蛋白质种类及含量的变化均会引起后续加工环节的品质差异,本文建立的毛细管区带电泳方法可以作为牛乳蛋白品质测定的一种快速、可靠的检测方法,为后续加工环节的原料选择提供依据。
[1]Santos MV,Ma Y,Barbano DM. Effect of somatic cell count on proteolysis and lipolysis in pasteurized fluid milk during shelf-life storage[J]. Journal of Dairy Science,2003,86(8):2491-2503.
[2]Yamasaki A,Yoshimura Y,Isobe N. Changes in the concentrations of somatic cell counts,lingual antimicrobial peptide and lactoperoxidase activity in milk at periovulatory period in dairy cows[J]. Animal Science Journal,2017,88(3):484-488.
[3]Le Roux Y,Laurent F,Moussaoui F. Polymorphonuclear proteolytic activity and milk composition change[J]. Veterinary Research,2003,34(5):629-645.
[4]Rauh VM,Sundgren A,Bakman M,et al. Plasmin activity as a possible cause for age gelation in UHT milk produced by direct steam infusion[J]. International Dairy Journal,2014,38(2):199-207.
[5]杨永新,王加启,卜登攀,等. 不同体细胞数牛乳中乳蛋白的比较蛋白质组学研究[J]. 中国农业科学,2011,44(12):2545-2552.
[6]Ding XJ,Yang YY,Zhao S,al. Analysis of alpha-lactalbumin,beta-lactoglobulin A and B in whey protein powder,colostrum,rawmilk,and infant formula by CE and LC[J]. Dairy Science & Technology,2011,91(2):213-225.
[7]Rauh VM,Sundgren A,Bakman M,et al. Plasmin activity as a possible cause for age gelation in UHT milk produced by direct steam infusion[J]. International Dairy Journal,2014,38(2):199-207.
[8]Thiagode OM,Brenda LSPorto,Maria JVB,et al. Capillary zone electrophoresis for fatty acids with chemometrics for the determination of milk adulteration by whey addition[J]. Food Chemistry,2016,213(15):647-653.
[9]Hutterer K,Dolník V. Capillary electrophoresis of proteins 2001-2003[J]. Electrophoresis,2003,24(22-23):3998-4012.
[10]Czerwenka C,Müller L,Lindner W. Detection of the adulteration of water buffalo milk and mozzarella with cow’s milk by liquid chromatography-mass spectrometry analysis ofβ-lactoglobulin variants[J]. Food Chemistry,2010,122(3):901-908.
[11]Hamed H,Trujillo AJ,Juan B,et al. Interrelationships between somatic cell counts,lactation stage and lactation number and their influence on plasmin activity and protein fraction distribution in dromedary(Camelusdromedaries)and cow milks[J]. Small Ruminant Res,2012,105(1-3):300-307.
[12]孙颖. 酪蛋白与乳清蛋白比例对乳蛋白结构的影响[D]. 哈尔滨:东北农业大学,2009.
