优化冰冻血小板制备条件的初步研究
2018-04-25孙瑜翁美芝熊莉徐翠玲付文霞袁虾樊立荣吴红李国良
孙瑜,翁美芝,熊莉,徐翠玲,付文霞,袁虾,樊立荣,吴红,李国良
(江西省血液中心,江西 南昌 330000)
对因血小板缺失导致的出血性疾病,输注血小板是特异性的治疗方法[1-4],但应急情况下新鲜血小板来源不足,且保存条件有利于细菌生长,直接限制了临床应用。为更好的满足临床需求,各国均在研究延长血小板保存期限的方法,我国1989年便有文献[5]报导应用DMSO保存浓缩血小板。但冰冻血小板的制备操作过程严格,贮存条件高,解冻后血小板容易出现絮状物,影响质量,甚至报废,为提高冰冻血小板的保存质量,保护受血者利益,我中心根据相关文献尝试使用不同浓度的二甲基亚砜(dimethylsulphoxide,DMSO),选择不同条件制备冰冻血小板,并选择不同温度融化冰冻血小板,以期寻找出最适合制备冰冻血小板的方法。现汇报如下:
1 材料与方法
1.1 献血者选择 随机选择我中心无偿献血者,年龄(18~47周岁),男18例,女30例,遵循知情同意原则抽取本人全血400ml,制备手工血小板。
1.2 仪器与设备 赫立氏6000i离心机 (美国热电公司),血小板振荡仪(苏州医用仪器厂),-80℃深低温冰箱,(三洋),速冻机(多美达),循环水浴箱(潍坊普华),全自动血细胞计数仪(希森美康)
1.3 试剂 DMSO(Lot:USP4F1S,德国 WAK),生理盐水(Lot:160302 31A,上海输血技术有限公司)
1.4 方法
1.4.1 手工血小板的制备 使用富浆法制备手工血小板,离心程序为 1200g×9min,22℃;3000g×4min,22℃,保留60g终产品置于血小板保存袋中,并将每袋血小板以无菌接管机分成20gX2袋,余下的作为浓缩血小板对照组,均置于血小板振荡仪中振荡保存;
1.4.2 75%DMSO的配制 由DMSO原液与0.9%NaCl以3:1的体积比在无菌条件下配制,配好后置于-50℃冰箱保存,使用前取出,无须室温平衡。
1.4.3 冰冻血小板的制备
1.4.3.1 使用DMSO原液制备冰冻血小板 在百级无菌室内,以加药件按1ml/min的速度缓慢将DMSO原液加入血小板悬液深部,边加边振(频率60次/min),充分混匀,使终浓度为5%,振荡8min后-80℃冰冻保存;
1.4.3.2 使用75%DMSO制备冰冻血小板:按公式“血小板净重(g)×0.071”计算,即得终产品内DMSO达5%浓度所需的75%DMSO体积,用前取出75%DMSO,以注射器直接加入血小板袋内,边加边振(频率无要求),直接摇均,使之终浓度为5%,迅速置-80℃保存;
1.4.4 冰冻血小板的融化 从-80℃深低温冰箱中取出冰冻血小板,迅速置于38℃水浴或或流动自来水中融化。
1.4.5 实验分组 将48例献血者制备的共96袋冰冻血小板随机分成2组,每组24例48袋,每组均按冰冻液与融化条件中固定其一的原则,共分4大组;组1与组2为配对组,使用同一人的冰冻血小板;组3与组4为配对组,使用同一人的冰冻血小板,详见表1。

表1 冰冻血小板实验分组(n=96)
1.5统计学方法 使用excel2007[6-8]进行统计分析。数据以平均数士标准差(x±s)表示;计量资料的统计分析选择t检验,以配对t检验行两两配对组比较;计数资料统计分析选择χ2检验。
2 结果
2.1 冰冻前、解冻后血小板的质量检测均合格,冰冻保存过程中各项指标检测达到质量标准。
2.2 血小板回收率 (%Recovery)(复苏后血小板计数/冰冻前血小板计数),血小板平均体积(MPV)、血小板分布宽度(PDW)的比较见表2。
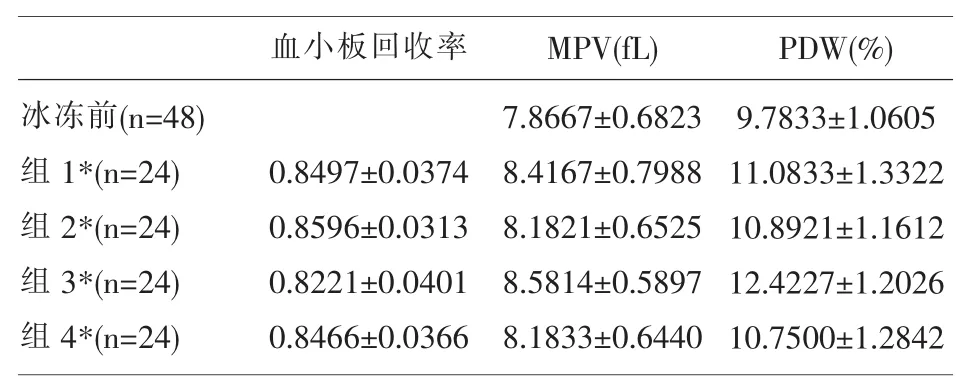
表2 浓缩血小板冰冻前、后血小板回收率、MPV、PDW的比较(x±s)
2.3 絮状物的出现
2.3.1 本实验中,流动自来水融解时有1袋(1/48)出现絮状物(χ2=9.5174,P>0.05)。
2.3.2 本中心制备的冰冻单采血小板中出现絮状物的概率见表3。

表3 不同浓度的DMSO对冰冻单采血小板复苏后絮状物的影响
3 讨论
DMSO作为低温保护剂有许多优点[9],如可静脉输注,安全剂量0.92g/kg体重,制备的冰冻血小板无需洗涤,复温后可直接输注[10],该试剂已广泛应用于干细胞保存中。在冰冻血小板的使用上,5%的DMSO的终浓度在安全剂量范围内,但目前,冰冻血小板尚未大量使用[11],国内《全血与成分血质量要求》(GB18469-2012)中也未提出该产品的具体质控指标,如何通过大量数据的积累,使冰冻血小板的质量规范尽早出台,缓解我国因人数巨大而导致的血小板的临床供需矛盾已成为血站成分制备的一个研究热点。
本次实验没有以血小板直接计数来判断冰冻效果,而是选择了复苏后血小板的回收率作为衡量指标,因本实验随机选择无偿献血者作为实验对象,而非单采献血者,对其制备后的血小板含量无明确要求,血小板回收率更能反映制备效果,且更有可比性。
随机分组冰冻血小板,浓缩血小板冰冻前、后血小板回收率、MPV、PDW的比较均显示两个对照组的差异有统计学意义,有趣的是,四个组与冰冻前相比,其差异也有统计学意义,所以无法据此判断到底哪一种方法更为理想。但根据许多文献[12,13]显示,冰冻血小板复苏后,至少血小板回收率的指标在冰冻前与解冻后均无显著性差异,我们的实验结果可能由以下原因导致:一、样本量过小;二、48袋血小板的浓缩、分袋、冰冻与解冻由若干工作人员完成,手法有差异;三、浓缩血小板的红细胞混入量高于单采血小板,在制备冰冻解冻血小板时对计数有影响。仅就本次实验中的血小板回收率的均数与标准差而言,75%DMSO制备的冰冻血小板回收率较好,但也仅在85%左右徘徊,这符合国外学者认为的冻存与解冻过程中,一般有15%-40%的血小板损失的结论[14]。
冷冻血小板融解后出现絮状物一般有两大因素:⑴纤维蛋白析出和血小板损伤[15]。⑵DMSO注入过快产生高热量,灼伤血浆蛋白,导致絮状物析出。但是,75%的DMSO制备后置入-50℃的冰箱内保存,在制备冰冻血小板需加样方取出,该温度可有效平衡DMSO的水合放热,避免血浆蛋白的变性与血小板的激活,有效防止絮状物的产生。结合本次实验的絮状物出现的绝对值和统计分析情况,75%的DMSO制备的冰冻血小板与38℃水浴复苏冰冻血小板絮状物的产生更少。因此,75%的DMSO更适合制备的冰冻血小板。
[1]郭永建.输血医学若干进展趋势[J].中国输血杂志,2011,24(12):1105-1107.
[2]Kumar A,Mhaskar R,Grossman BJ,et al.Platelet transfusion:a systematic review of the clinical evidence[J].Transfusion,2015,55(5):1116.
[3]林姝婷,赖冬,龙敏.血小板与冷沉淀联合输注在大出血临床治疗中应用的Metal分析[J].中外医学研究,2016,26(14):1-4.
[4]任广辉,丁海,刘俊卯,等.重度血小板减少门脉高压症脾切除术中预防性输注血小板疗效及输注时机的探讨 [J].疑难病杂志,2017,16(11):1109-1112.
[5]刘景汉,韩玉凤,李茨芬,等.二甲基亚砜冷冻保存血小板[J].解放军医学杂志.1989.14(2):106-108.
[6]盛洁,胡建华.Excel软件的统计功能在卡方检验中的应用[J].医学信息,2008,21(1):28-31.
[7]张尔强.巧用Excel做t检验[J].中国医科大学学报,2003,32(3):222.
[8]刘玉振,邢培清,王海玲,等.利用Excel作配对t检验的方法[J].中国卫生统计,2004,21(5):306.
[9]刘作斌,徐亦青,张佐云,等.冷冻保护剂二甲基亚砜的毒副作用及应用剂量研究 [J].中国人民解放军军医进修学院学报,1990,11(1):31-34.
[10]刘景汉,王青梅,李茨芬.血小板低温保存实验与临床应用研究[J].解放军医学杂志,1998,23(4):293-294.
[11]Reid TJ,GaoD.Symposium on cryopreservation ofhuman platelets:an overview,Cryobiology,1999,38(3):177-179.
[12]姚勇,蒋红周,张健,等.机采血小板低温冰冻保存与常规液态保存的主要参数比较[J].临床输血与检验,2015,17(6):515-517.
[13]吴命华,谭曼虹,付红梅,等.冰冻血小板制备研究[J].医学临床研究,2010,27(9):1685-1687.
[14]Towell BL,Levine SP,Knight WA,et al.A comparison of frozen and fresh platelet concentrates in the support of thrombocytopenic patients[J].Transfusion,1986,26(6):525-530.
[15]丁国良,赵树华,王珍,等.冻存血小板中出现絮状物的原因分析[J].临床输血与检验,2004,6(2):114-116.
