细胞形态学联合血液指标鉴别诊断骨髓增生异常综合征与巨幼细胞性贫血
2018-04-25陈蓉艳李佐勇秦雪君赖雯斓林青
陈蓉艳 ,李佐勇 ,秦雪君 ,赖雯斓 ,林青
(1、福建中医药大学附属人民医院检验科,福建 福州 350004;2、闽江大学,福建 福州 350121)
骨髓增生异常综合征 (Myelodysplastic syndromes,MDS)是一组起源于造血髓系定向干细胞或多能干细胞的异质性克隆性疾病,主要特征是无效造血、血细胞形态学上的病态发育以及外周血细胞减少、高危演变为急性髓系白血病(AML)。WHO将其归为髓系造血系统恶性肿瘤。巨幼细胞性贫血(Megaloblastic anemia,MA)是由维生素B12和(或)叶酸缺乏,使细胞DNA合成障碍,导致细胞核发育障碍。本病患者骨髓中粒系、红系、巨核系三系细胞出现巨幼变为其特征,为良性贫血。MDS和MA都属于造血系统性疾病,临床表现不典型难以鉴别。本研究根据2016年WHO分型新标准,从临床特点、常用的血液指标以及细胞形态学对MDS和MA进行分析及鉴别。
1 资料与方法
1.1 一般资料 回顾性分析本院2012年5月至20l7年8月期间26例MDS患者,其中男14例(53.8%),女 12 例(46.2%),年龄 27~84 岁,中位年龄69岁。MDS患者中24例(92.3%)以面色苍白、头昏乏力的贫血症状入院,2例(7.7%)以发热的感染症状入院,部分伴有皮肤青紫、厌食、体重下降、四肢酸痛。根据2016年WHO的分型标准划分MDS亚型,2016年以前的病例结合临床特点及形态学、遗传学、分子生物学资料重新进行分型,其中伴单系病态造血 MDS(MDS-SLD)2 例(7.7%),伴多系病态造血 MDS(MDS-MLD)7 例(26.9%),伴单系病态造血 MDS-RS(MDS-RS-SLD)2 例(7.7%),伴多系病态造血MDS-RS(MDS-RS-MLD)3例(11.5%),伴孤立性 5q-异常 MDS1 例(3.8%),伴原始细胞过多 MDS(MDS-EB-1)5 例(19.2%),伴原始细胞过多MDS(MDS-EB-2)6例(23.1%)。选取同期MA患者28例进行分析,其中男16例(57.1%),女12例(42.9%),年龄 22~86岁,中位年龄 68.5岁。MA患者中28例(100%)以面色苍白、头昏乏力的贫血症状入院,部分伴口腔溃疡、腹痛、胸闷气喘、咳嗽咳痰、发热。其中15例进行了骨髓涂片细胞学检查。MDS组、MA组研究对象在性别构成、年龄方面的差异均无统计学意义(P>0.05)。
1.2 检测方法 RBC、Hb、MCV、RDW 采用 EDTAK2抗凝全血,应用日本希森美康全自动血液分析仪SYSMEX XN-9000测定。乳酸脱氢酶(LDH)采用血清标本在美国雅培生化分析仪CY-16000上进行检测,血清铁蛋白(SF)、维生素 B12(B12)采用血清标本在美国贝克曼库尔特DXI800免疫分析仪上测定。样本的检测严格按照试剂盒说明书执行,每次检测室内质控均在控。
血涂片、骨髓涂片采用瑞吉染色,使用普鲁士蓝染色方法对骨髓涂片进行铁染色。所有患者外周血和骨髓涂片由两名检验医师独立评估。为了准确评估细胞形态,骨髓涂片计数500个有核细胞,外周血计数200个有核细胞。高倍镜下计数细胞,油镜下观察形态,每张涂片的各种病态造血均在油镜下观察记录,对红系、粒系、巨核系中的单系细胞异常程度做进一步的评价(红系、粒系计数100个单系细胞,巨核细胞计数30个单系细胞),>10%为病态造血存在。环形铁粒幼细胞 (IWGMMDS)为至少5个铁粒幼颗粒环绕1/3核周的幼红细胞[1]。将MDS组中的病态造血发生率与MA组进行比较。同时通过全面分析全片细胞,按照2016年WHO分型标准划分MDS亚型。
1.3 统计学分析 采用SPSS 21.0软件对两组数据进行统计学分析,计量资料采用独立t检验,结果以(x±s)表示,计数资料采用 χ2检验,结果以计数(百分比)表示。P<0.05为差异有统计学意义。
2 结果
2.1 对MDS组与MA组血常规数据进行了统计学分析,发现RBC、MCV差异具有显著性意义 (P<0.05)(见表 1)。 对血清 SF、LDH、VitB12 进行了统计学分析分析,发现LDH、VitB12水平的差异具有显著性意义(P<0.05)(见表 2)。

表1 两组常用的血常规指标结果比较
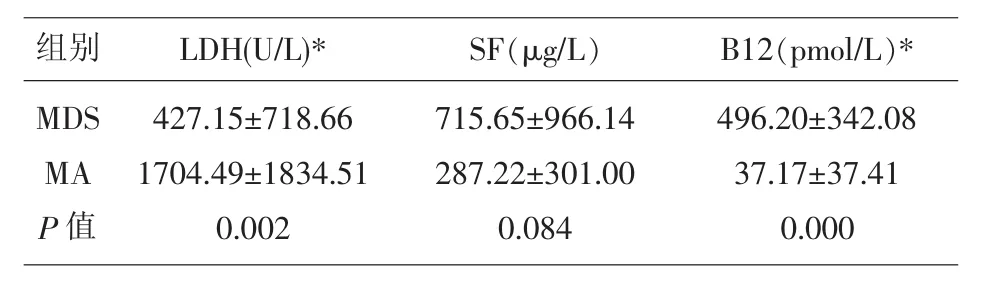
表2 两组常用的生化指标结果比较
2.2 MDS组与MA组的外周血细胞形态中原始细胞、巨红细胞检出的差异具有显著性意义。此外,MA组外周血涂片中均未检出原粒细胞和假性Pelger异常粒细胞,而MDS可检出(见表3,图1)。
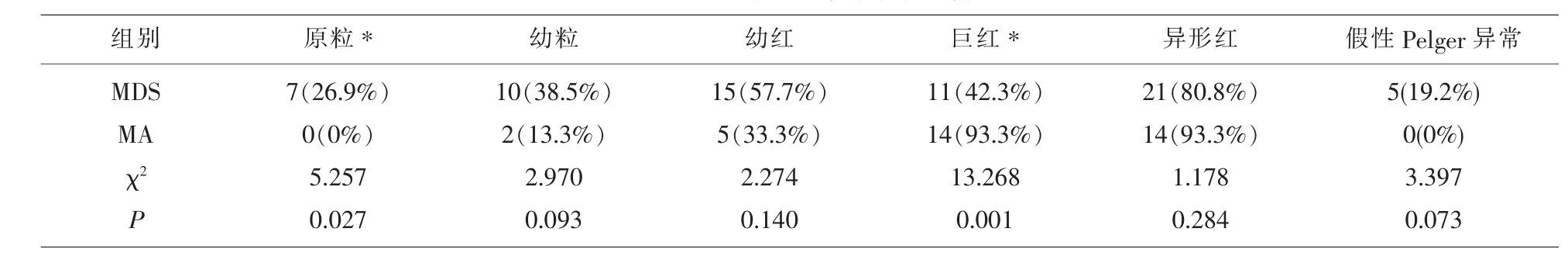
表3 两组外周血涂片结果比较
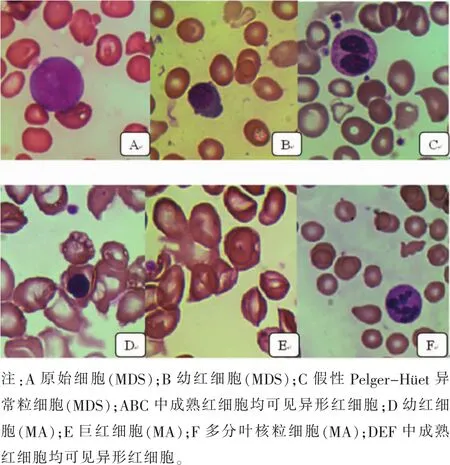
图1 外周血涂片细胞形态比较(瑞吉染色,×1000)
2.3 MDS组与MA组的骨髓细胞形态中的原始细胞(≥5%)、核浆发育不平衡、(类)巨幼变幼红细胞、环形铁粒幼细胞、小巨核细胞、单圆核巨核细胞的检出差异具有显著性意义。此外,不论粒系、红系还是巨核系,MDS和MA都会出现病态≥10%的情况,二者差异不具有显著性意义(见表4、表 5、表 6,图 2)。
3 讨论
2016年WHO提出第5版MDS分型标准,精炼了血细胞形态学上的病态发育及血细胞减少的评价,认为血细胞减少对分型作用很小,且MDS患者细胞显示出的病态造血常与血细胞减少无关,在成人MDS命名中去除了 RCUD(RA、RN、RT),改为MDS加伴单系病态造血、多系病态造血、环形铁粒幼细胞、原始血细胞过多或del(5q)细胞遗传学异常[2]。鉴别MDS和其他伴血细胞减少和病态造血的疾病(如巨幼细胞性贫血),仍是MDS诊断中最大的难题之一[3,4]。
MDS组和MA组的RBC和Hb差异表现不同,MA组的RBC比Hb明显减少,而MDS组的RBC、Hb减少相对平行。从病因上分析,MA因细胞核发育障碍致红细胞数量减少为主;MDS为克隆性疾病致红系受抑制,红细胞数量和血红蛋白浓度减低相对平行。MCV值差异从形态上来分析,MDS患者红细胞可表现为不同体积,通常在参考值范围内;而MA组以大红细胞为主,MCV增大。二组RDW值均增高,MA组的病变红细胞易出现巨红细胞溶血所致的破碎红细胞,而MDS组的病变红细胞表现为大细胞、正细胞、小细胞,二组红细胞大小差异均增大。
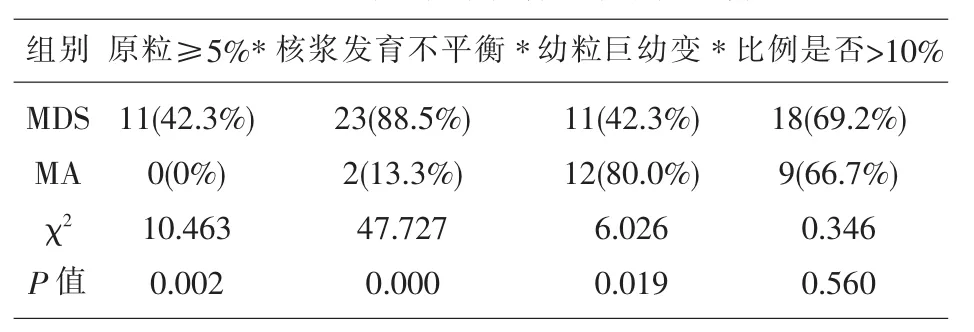
表4 两组骨髓粒系发育异常指标比较
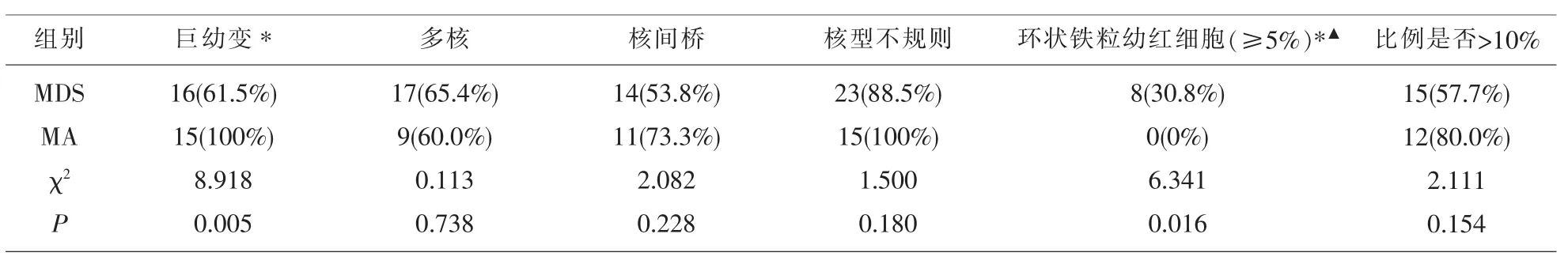
表5 两组骨髓红系发育异常指标比较

表6 两组骨髓巨核系发育异常指标比较

图2 骨髓三系发育异常比较(瑞吉染色,×1000)
MDS作为白血病前期疾病,SF增高的原因与恶性肿瘤类似,无效的红细胞生成使红细胞内铁外运增加,同时红细胞生成减少、铁利用降低导致铁过载,导致血清铁蛋白增高,同时铁过载又可诱导基因突变[5]。MA患者则由于骨髓细胞增生紊乱,红细胞系统增生与破坏加速,导致血清铁蛋白增高。B12作为MA的诊断指标广为人知,特别需注意,有可能出现MDS伴发B12缺乏的情况,在本研究中有一例B12缺乏,最初诊断为MA,经治疗后贫血未纠正,后经骨髓形态学及病理诊断为MDS。LDH存在于机体所有组织细胞胞质内,MDS和MA增高的血清LDH来源不同,MDS主要由于细胞发生基因突变,导致能量代谢障碍和细胞损伤,引发血清LDH(来自肿瘤细胞)增高,而MA的幼红细胞浆内LDH水平较成熟红细胞高,原位溶血后出现血清LDH(来自幼红细胞)增高,后者增高的程度极显著。
原始细胞不会出现在MA外周血中,在骨髓涂片中比例不高于5%,且不会出现胞体核型不规则及Auer小体。假性 Pelger-Hüet异常粒细胞是MDS特异性表现[6,7],扩大样本量将提高其诊断价值。由于严重贫血,二者的幼红细胞易从血髓屏障逸出,骨髓中(类)巨幼变红细胞脱核后形成巨红细胞,病变红细胞胞膜不稳定易被挤压破碎形成异形红细胞,故在MDS和MA中三种红细胞均可检出,而巨幼红细胞在MA中比MDS更加有意义[8]。粒系的核浆发育不平衡更常见于MDS,表现为胞核染色质疏松,可见核仁,而胞浆会出现成熟的特异性颗粒,是肿瘤细胞增生紊乱及异常活跃的表现[7]。在红系病态中,环形铁粒幼细胞是MDS高特异性的病态表现。巨幼红细胞在MDS和MA中形态表现的差异也有助于鉴别诊断,MA的巨幼红细胞一致表现为“核幼浆老”,以早中幼红细胞为主,而MDS的类巨幼红细胞在体积增大的同时可表现为“核幼浆老”、“核老浆幼”或“核浆发育相对平衡”多种状态,以晚幼红为多见。小巨核细胞在巨核病态中具有很高的特异性,其胞体小,约周边的髓系细胞大小,核浆比高,核染色质浓集,一般无核仁,胞质嗜碱性较强,边缘常有不规则的毛刺样或小泡样突起,大单圆核巨核细胞(体积较大的单个椭圆异形核巨核细胞)是5q-综合征的特征性形态[7]。
MA在各系总病态造血的比例常>10%,可误诊为MDS,尤其是MDS-MLD亚型。病态造血的形态学改变也可以存在于健康人和非克隆性疾病患者中,其阈值设在10%是否合理存有争议。一项日本德国共同研究对不伴原始细胞过多的MDS(5q-综合征除外)进行分析,研究者建议将40%设为巨核系病态的阈值[9]。在另一个研究中,4位检验者根据WHO分型标准对病态进行评价,他们对粒系病态的判断一致率适中,对红系及巨核系病态的判断一致率低,而将各系病态的阈值从10%提高到20%,一致率提高了[10]。
综上,本研究认为联合外周血和骨髓细胞形态学和血常规数据RBC、Hb、MCV及LDH、B12有利于鉴别诊断MDS和MA。MDS组在细胞形态学上出现原始细胞(外周血)、原始细胞≥5%(骨髓)、假性Pelger-Hüet异常粒细胞、环形铁粒幼细胞、小巨核细胞具有较高的特异性。MA组的RBC比Hb明显减少、MCV增大、LDH显著增高,B12减低;而MDS组的RBC、Hb减少相对平行、MCV通常在参考值范围内、LDH增高不显著、B12通常增高。
骨髓染色体核型分析、基因诊断是MDS与MA鉴别诊断的重要环节[11,12],2016年WHO分型中提出确切MDS核型异常,这些核型异常与MDS的诊断和预后关系密切,初诊的MDS病例完善一份骨髓染色体核型很重要。近年来MDS发现了大量的突变基因,其中,TP53突变和MDS疾病的侵袭性相关,在伴del(5q)的患者中表现为对药物“来那度胺”不敏感,重现性剪切体基因SF3B1突变和环形铁粒幼细胞相关,提示和预后良好相关[2,13],2016年WHO在MDS-RS分型上出现了相应改变,在检出SF3B1基因时,环形铁粒幼细胞大于5%,即可诊断为MDS-RS[2]。在本研究中,有2例环形铁粒幼细胞比例在5~15%的病例,将进一步修正诊断和判断预后。
[1]尚红,王毓三,申子瑜.全国临床操作规程[M].第4版.北京:人民卫生出版社,2015:33-34.
[2]Arber DA,Orazi A,Hasserjian R,et al.The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J].Blood,2016,127(20):2391-2405.
[3]Gondek LP,DeZern AE.I walk the line:how to tell MDS fromother bone marrow failure conditions[J].Curr Hematol Malig Rep,2014,9(4):389-399.
[4]韩慧,杨山虹,黄福达,等.160例贫血患者细胞形态学诊断结果分析[J].实验与检验医学,2015,33(1):113-114.
[5]Kew MC.Hepatic iron overload and hepatocellular carcinoma[J].Liver Cancer,2014,3(1):31-40.
[6]Goasguen JE,Bennett JM,Bain BJ,et al.Proposal for refining the definition of dysgranulopoiesis in acute myeloid leukemia and myelodysplastic syndromes[J].Leuk Res,2014,38(4):447-453.
[7]Invernizzi R,Quaglia F,Della Porta MG.Importance of classical morphology in the diagnosis of myelodysplastic syndrome[J].Mediterr J Hematol Infect Dis,2015,7(1):e2015035.
[8]董海波,谢品浩,袁翠英,等.病态造血在骨髓增生异常综合征诊断中的意义[J].检验医学与临床,2016,13(5):685-688.
[9]Matsuda A,Germing U,Jinnai I,et al.Improvement of criteria for refractory cytopenia with multilineage dysplasia according to the WHO classification based on prognostic significance of morphological features in patients with refractory anemia according to the FAB classification[J].Leukemia,2007,21:678-686.
[10]Parmentier S,Schetelig J,Lorenz K,et al.Assessment of dysplastic hematopoiesis:lessons from healthy bone marrow donors[J].Haematologica,2012,97(5):723-730.
[11]Malcovati L,Papaemmanuil E,Ambaglio I,et al.Driver somatic mutations identify distinct disease entities within myeloid neoplasms with myelodysplasia[J].Blood,2014,124(9):1513-1521.
[12]Van't Veer M,Haferlach T.Should clinical hematologists put their microscopes on eBay?[J].Haematologica,2014,99(10):1533-1534.
[13]Malcovati L,Karimi M,Papaemmanuil E,et al.SF3B1 mutation identifies a distinct subset of myelodysplastic syndrome with ring sideroblasts[J].Blood,2015,126(2):233-241.
