猪圆环病毒3型PCR检测方法的建立及其应用
2018-04-25茅爱华俞正玉郭佳慧袁万哲赵攀登温立斌范宝超朱雪蛟胡屹屹郭容利何孔旺
肖 琦 ,茅爱华 ,汪 伟 ,俞正玉 ,郭佳慧 ,2,袁万哲 ,赵攀登 ,温立斌 ,范宝超 ,李 彬 ,朱雪蛟,胡屹屹,郭容利,曲 梦,5,杨 倩,何孔旺
(1.江苏省农业科学院兽医研究所 农业部兽用生物制品工程技术重点实验室,南京210014;2. 扬州大学兽医学院,扬州225009;3. 河北农业大学动物医学院,保定071001;4. 河南牧业经济学院动物医学院,郑州450046;5.西藏大学农牧学院,林芝860000;6. 南京农业大学动物医学院,南京210095)
猪圆环病毒(Porcine circovirus,PCV)是一种环形单链DNA病毒,属于圆环病毒科、圆环病毒属成员[1],已知的猪圆环病毒(PCV)包括猪圆环病毒1型(Porcine circovirus type 1,PCV1)和猪圆环病毒2型(Porcine circovirus type 2,PCV2)。PCV1最初被认为是PK-15细胞培养物的污染物,对猪是非致病性的[2];与PCV1不同,猪感染PCV2可引起猪圆环病毒病(Porcine circovirus disease,PCVD)或称猪圆环病毒相关疫病(Porcine circovirus associated disease,PCVAD),临床表现主要有断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)、繁殖障碍、猪皮炎肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)、先天性震颤(Congenital tremors,CT)、猪呼吸道疾病综合征(Porcine respiratory disease complex,PRDC)、肠炎、增生性和坏死性肺炎(Proliferative and necrotizing pneumonia,PNP)等,该病呈全球分布,自20世纪末爆发以来,已给世界养猪业造成巨大的经济损失[3]。2015年6月,美国北卡罗来纳州一个商品猪场的母猪爆发猪皮炎肾病综合征(PDNS)和繁殖障碍,应用宏基因组测序和PCR没有检测到PCV2、PRRSV等已知病毒,但发现了一种基因组长度为2000 bp新的环状DNA病毒,被命名为PCV3[4]。Palinski等[4]应用荧光定量PCR从具有PDNS症状母猪的流产胎儿中检出高拷贝的PCV3。Phan等[5]在心脏和多种全身炎症的猪中也检测到了PCV3。回溯性流行病学调查结果表明,PCV3于2010~2016年间已经在美国猪场普遍存在[4,5]。2017年,Ku等[6]首先报道在中国猪群中也存在PCV3感染,在所检测的辽宁省、江西省等10个省市样品中均可检测到PCV3。本实验旨在建立一种快速、特异、灵敏度高的PCV3 PCR检测方法,并利用该方法对2014~2017年收集的临床病料进行检测,以了解江苏省猪群PCV3的感染情况。
1 材料和方法
1.1 材料
1.1.1 毒株 猪圆环病毒1型(PCV1)、猪圆环病毒2型(PCV2)、猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪伪狂犬病病毒(Pseudorabies virus,PRV)、猪细小病毒(Porcine parvovirus,PPV)为本实验室保存毒株。
1.1.2 临床样品 共1438份样品,采自江苏省2014~2017年267个规模化猪场,其中发病猪组织样品938份、健康猪组织样品500份。-40℃保存备用。
1.1.3 主要试剂 TIANDZ柱式病毒DNAout试剂盒购自北京天恩泽公司;普通2×mix、2000 bp DNA Marker购自广州东盛生物科技有限公司;金牌Mix(green)购自南京擎科生物科技有限公司;琼脂糖购自台湾生工生物工程服务有限公司;pMD19-T载体购自宝生生物工程(大连)有限公司;DNA凝胶回收试剂盒、质粒提取试剂盒购自康宁生命科学(吴江)有限公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 引物设计与合成 运用的Primer Premier 5.0软件,根据GenBank中已登录的PCV3全基因序列设计1对特异性引物PA2F和PA2R,扩增目的片段预期大小为932 bp。PA2F:5'-CAGCTGTGG GCCTCCTAATGAAT-3';PA2R:5'-CCCCCGT GGCTTGAAATACAG-3'。引物委托南京金斯瑞生物科技有限公司合成。
1.2.2 临床样品处理及核酸提取 称量25.0 mg病料组织,放入破碎管中,加入1.0 mL浓度为0.01 mol/L的无菌PBS(pH7.2)及3颗钢珠,在均质破碎仪上破碎2~3次,反复冻融3次,4℃ 8000×g离心2 min,收集上清,用TIANDZ 柱式病毒DNAout试剂盒,按说明书的方法提取样品DNA模板。
1.2.3 PCV3阳性质粒的制备 以1.2.2提取的样品DNA为模板,用引物PA2F和PA2R进行PCR反应,将大小为923 bp的目的片段切胶回收,连接pMD19-T载体进行TA克隆,构建pMD19-PCV3重组质粒,送南京金斯瑞生物科技有限公司测序鉴定。将鉴定含有PCV3目的片段的质粒作为PCV3阳性质粒。
1.2.4 PCR的建立及条件优化 分别设定退火温度(51.5℃~64.5℃)、延伸时间(60 s~75 s)、引物量(0.5 μL~1 μL)、模板量(1 μL~3 μL)几个变量,对PCR检测方法进行优化,获得最佳反应条件。
1.2.5 PCR产物测序鉴定 选取经1.2.3建立的PCR方法检测为阳性的部分样品,将PCR产物切胶回收,TA克隆后,送南京金斯瑞生物科技有限公司测序,测序结果用DNAStar软件与GenBank中登录的PCV3基因序列进行比对分析,确定PCR扩增片段的特异性。
1.2.6 PCR特异性试验 用1.2.3建立的PCR方法分别扩增PCV1、PCV2、CSFV、PRRSV、PRV和PPV,并以PCV3阳性质粒和ddH2O依次作为阳性和阴性对照,检测该PCR方法的特异性。
1.2.7 PCR敏感性试验 测PCV3阳性质粒的浓度,并依次做10倍梯度稀释,每个稀释度取1μL作为PCR反应模板,进行PCR扩增,测定最低检出浓度,评估该PCR方法的敏感性。
1.2.8 临床样品PCR检测 利用建立的PCR方法对2014~2017年本研究室收集的临床发病猪样品及健康猪样品共1438份进行回顾性检测,分析不同年份猪场及样品中的PCV3的感染情况。
2 结果
2.1 PCV3阳性质粒的制备 用引物PA2F和PA2R对病料DNA进行扩增,得到与预期相符的932 bp的目的条带(图1)。经切胶回收TA克隆后,将pMD19-PCV3重组质粒送测序,测序结果与NCBI公布的PCV3/CN/Hubei-618毒株的同源性达到99.8%,说明构建的PCV3阳性质粒正确。

图1 PCV3 PCR扩增Fig.1 PCR ampli fi cation of PCV3 genome
2.2 PCR反应的建立及条件优化 经条件优化,确定最佳反应体系为25.0 μL:上游引物1.0μL,下游引物1.0 μL,模板1.0 μL,2×mix 12.5 μL,无菌ddH2O 9.5 μL;最佳反应条件:94℃预变性5 min,95℃变性30 s、53.6℃退火30 s、72℃延伸65 s,扩增35个循环,72℃延伸7 min。
2.3 PCR特异性试验 利用建立的最优PCR反应条件,对PCV1、PCV2、CSFV、PRRSV、PRV、PPV进行扩增。结果表明,建立的PCR方法只能扩增出PCV3样品中的特异性目的片段,而对PCV1、PCV2、CSFV、PRRSV、PRV、PPV均扩增不出目的片段。虽然PRV出现非特异性目的条带,但大小低于500 bp,而且比较弱,不影响PCV3的结果判定(图2)。表明该PCR方法特异性较好。
2.4 PCR敏感性试验 用建立的最优化PCR反应条件,对不同稀释度的PCV3阳性质粒进行PCR扩增。结果表明,用普通2×mix可检测到的最低质粒浓度为10 copy/μL;用金牌Mix(green),偶可检测到1 copy/μL(图3)。表明该方法具有较好的敏感性。
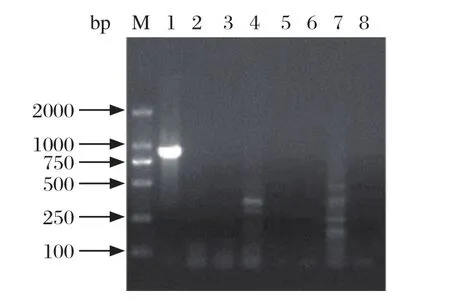
图2 PCR特异性检测结果Fig.2 Speci fi city test of PCR
2.5 临床样品PCR检测及序列分析 在938份临床发病猪样品中,检出PCV3阳性样品65份,阳性检出率为6.93%;500份健康猪样品仅检出3份PCV3阳性,阳性检出率为0.6%,临床发病猪样品中PCV3的检出率明显高于健康猪。从年份上看,2014年的病料中PCV3的阳性检出率为1.92%,2015年为3.08%,2016年为5.26%,2017年为12.67%(表1)。在样品来源的267个猪场中,检出PCV3阳性猪场35个,猪场阳性率为13.11%。2014年和2015年猪场阳性率较低,分别为4.55%和5.13%;2016年升高到12.09%;2017年达到25.00%(表2)。16份PCV3阳性样品的PCR扩增序列与PCV3/US/SD2016株的同源性为98.4%~99.6%,与PCV3/CN/Hubei-618株的同源性为99.0%~99.8%,16株病毒之间的同源性为98.3%~100%(表3)。
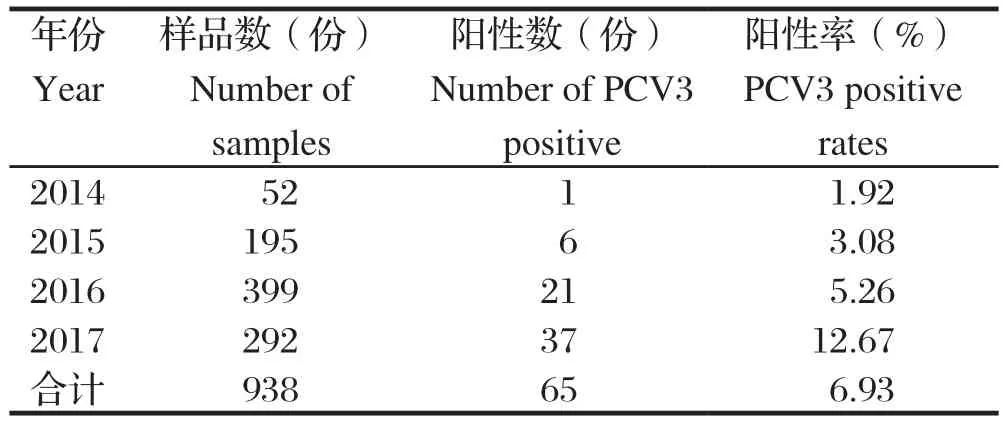
表1 2014~2017年病猪临床样品PCV3检测结果统计表Table 1 PCV3 test statistics of diseased pig clinical samples from 2014 to 2017

表2 2014~2017年猪场PCV3阳性统计表Table 2 PCV3 positive rate of pig farms from 2014 to 2017
3 讨论
本研究建立了检测PCV3的PCR方法。经临床样品检测,证明该方法特异性强、敏感性高、重复性好,可以作为一种操作简便、费用低廉的检测方法,从而得以推广应用。在试验过程中,我们比较了多对引物(包括已报道的引物[4]),PCR结果显示,本方法中所使用的引物扩增效率高,阳性条带更清晰,且杂带少,更适用于临床样品中PCV3的核酸检测。本方法用普通2×mix可检测到的最低质粒浓度达到10 copy/μL,而用金牌Mix(green)甚至偶可检测到1 copy/μL,高于徐朋丽等[7]报道的方
法。PCR特异性试验中,对PCV1、PCV2、CSFV、PRRSV、PRV、PPV均扩增不出目的片段,而PRV会出现较弱的大小约为350 bp的非特异性条带,但由于其大小明显小于PCV3扩增片段,不会干扰PCV3的结果判定。

表3 16份PCV3阳性样品的PCR扩增序列同源性比较Table 3 Comparison of amplif i cation sequences of 16 PCV3 positive samples
江苏省2014~2017年的临床发病猪及健康猪样品的PCR检测结果显示,病猪(PMWS/PRDC/腹泻)PCV3的检出率明显高于健康猪,表明PCV3可能与这些疫病的发生有一定的关系。从时间上看,2014年,江苏猪群中PCV3猪场阳性率和样品阳性率分别只有4.55%和1.92%,其后,阳性率逐年递增,至2017年分别达到25.00%和12.67%。该结果与Wang等[8]的报道基本一致。PCV3的这种流行趋势值得高度重视。
Fan等[9]和Shen等[10]分别对中国PCV3毒株的全长序列与PCV3/US/SD2016株进行了同源性分析,结果显示中国PCV3/CN/Hubei-618、PCV3/China/GD2016毒株与PCV3/US/SD2016株的同源性分别为99.1%~99.6%和97.4%~98.5%。本研究对16个样品的PCV3扩增片段进行了序列测定,同源性比较结果显示,所测各毒株之间的核苷酸序列同源性为98.3%~100%;与PCV3/US/SD2016株的同源性为98.4%~99.6%;与PCV3/CN/Hubei-618株的同源性为99.0%~99.8%。不同年份的毒株之间的同源性差异无明显规律性。表明PCV3毒株之间存在一定的变异,但其变异与地域及年份并无直接关系。
参考文献
[1] Mankertz A, Caliskan R, Hattermann K,et al. Molecular biology of Porcine circovirus: analyses of gene expression and viral replication[J]. Vet Microbiol, 2004, 98(2): 81-88.
[2] Tischer I, Rasch R, Tochtermann G. Characterizati on of papovavirus and picornavirus-like particles in permanent pig kidney cell lines[J]. Zentralbl Bakteriol Orig A, 1974,226(2): 153-167.
[3] Opriessnig T, Meng X J, Halbur P G. Porcine circovirus type 2 associated disease: update on current terminology,clinical manifestations, pathogenesis, diagnosis, and intervention strategies[J]. J Vet Diagn Invest, 2007, 19(6):591-615.
[4] Palinski R, Piñeyro P, Shang P,et al. A Novel Porcine Circovirus Distantly Related to Known Circoviruses Is Associated with Porcine Dermatitis and Nephropathy Syndrome and Reproductive Failure[J]. J Virol, 2016,91(1). pii: e01879-16.
[5] Phan T G, Giannitti F, Rossow S,et al. Detection of a novel circovirus PCV3 in pigs with cardiac and multisystemic inflammation[J]. Virol J, 2016, 13(1):184.
[6] Ku X, Chen F, Li P,et al. Identification and genetic characterization of porcine circovirus type 3 in China[J].Transbound Emerg Dis, 2017, 64(3): 703-708.
[7] 徐朋丽, 张鸿鑫, 张宇, 等. 猪圆环病毒3型PCR检测方法的建立及应用[J]. 中国预防兽医学报, 2017, 39(9): 727-730.
[8] Wang J, Zhang Y, Wang J,et al. Development of a TaqMan-based real-time PCR assay for the specific detection of porcine circovirsu 3[J]. J Virol Methods,2017, 248:177-180.
[9] Fan S, Ku X, Chen F,et al. Complete genome sequence of a novel porcine circovirus type 3 strain, PCV3/CN/Hubei-618/2016, isolated from China[J]. Genome Announc, 2017, 13, 5(15). pii: e00100-17.
[10] Shen H, Liu X, Zhang P,et al. Genome characterization of a porcine circovirus type 3 in South China[J].Transbound Emerg Dis, 2018, 65(1): 264-266.
