膜周部室间隔缺损经导管介入封堵后早期并发症危险因素的分析
2018-04-25易岂建计晓娟吕铁伟
严 帆 易岂建 计晓娟 吕铁伟 何 爽 李 谧
经导管介入封堵术是目前治疗膜周部室间隔缺损(VSD)的一线方案之一,已在我国得到广泛开展。由于膜周部VSD在解剖位置上接近传导束、主动脉瓣及三尖瓣,术后有发生心律失常(尤其是完全房室传导阻滞)、瓣膜反流的风险[1]。既往研究表明,小年龄、低体重是先天性心脏病介入封堵术后不良事件的重要危险因素[2,3],而距离主动脉瓣过近、封堵器过大、偏心型封堵器是膜周部VSD介入封堵术后的重要危险因素[4-6]。然而,目前对于膜周部VSD介入封堵术后并发症危险因素的研究多集中于心律失常,对瓣膜反流和残余分流等其他并发症的相关研究较少。本研究通过回顾性分析近年来在重庆医科大学附属儿童医院(我院)行膜周部VSD介入封堵术患儿的临床资料,探讨术后总并发症以及心律失常、瓣膜反流和残余分流的危险因素。
1 方法
1.1 病例纳入标准 2015年10月1日至2017年10月1日在我院行膜周部VSD介入封堵术病例。
1.2 病例排除标准 ①合并有其他需要外科或介入治疗的先天性心血管畸形;②合并有其他明显影响血流动力学稳定性的因素,如超声心动图(TTE)证实的严重的心脏肥大、左心房及左心室容量超负荷等;③重度肺动脉高压合并双向分流;④有感染性心内膜炎或其他感染性疾病尚未得到控制;⑤封堵器安置处或导管插入处有血栓存在;⑥存在明显的肝肾功能不全(ALT升高大于正常上限10倍,血尿素氮>28 mmol·L-1和/或血清肌酐>176 μmol·L-1)。
1.3 手术指征和方法
1.3.1 手术指征 我院介入封堵术治疗膜周部VSD的临床指征参考文献[7]:①经TTE检查确诊为膜周部VSD,缺损直径2~16 mm;②年龄>2岁且体重≥10 kg;③对于TTE提示心功能正常且体重不低于同年龄同性别健康儿童3个标准差的患儿[8],年龄可放宽至>1.5岁,体重可放宽至≥9 kg。
1.3.2 介入封堵术的方法同文献[9]。
1.3.3 术后 常规住院观察5 d(根据病情变化可延长观察时间),24~72 h复查心电图(ECG)和TTE;3~5 d予地塞米松 0.5~1.0 mg·kg-1·d-1,以减轻室间隔的水肿。术后6个月内予口服阿司匹林3~5 mg·kg-1·d-1,l、3、6和12个月门诊随访 TTE和ECG,之后连续 5 年内每年随访 1 次。
1.4 资料截取 由单人从医院电子病历系统中截取以下资料,各项检查中的指标均从检查报告中提取。①性别、年龄、体重;②术前TTE检查:压差、缺损大小、左心室射血分数(LVEF)、左心室缩短分数(LVFS)、左心室舒张末期内径(LVDD)、左心室收缩末期内径(LVSD)、是否合并膜部瘤、瓣膜反流情况;③术后24~72 h TTE检查报告:残余分流、瓣膜反流情况;④术前及术后24~72 h ECG检查结果;⑤术中心导管检查结果:缺损大小、VSD上缘距主动脉右冠瓣下缘距离、主肺动脉压、左心室压及右心室压;⑥封堵器品牌、直径及形状;⑦手术时间、麻醉方式;⑧住院期间并发症:术后新发的心律失常、新发中度及以上的瓣膜反流(包括主动脉瓣、三尖瓣和二尖瓣等)、所有程度的残余分流(微量:<1 mm;少量:~2 mm;中量:~4 mm,大量:>4 mm)、封堵器移位和脱落、机械性溶血、血栓形成或栓塞、其他需要外科紧急处理或明显延长住院时间的并发症。严重并发症包括封堵器脱落、大量的残余分流或瓣膜反流、Ⅲ°房室传导阻滞(AVB)、心包填塞、溶血、血栓形成及死亡。
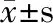
2 结果
2.1 一般资料 符合本文纳入和排除标准的患儿191例,

超声缺损(5.6±1.9)mm,压差(68.6±13.7)mmHg,距主动脉瓣距离<3 mm 8例(4.3%)、≥3 mm 178例,术前心律失常18例(9.7%),合并膜部瘤70例(37.6%)。LVEF(66.7±5.6)%,LVFS(36.4±4.1)%,LVDD(35.8±5.0)mm,LVSD(22.8±3.0)mm,心导管缺损(3.2±1.6)mm,主肺动脉收缩压(31.4±8.5)mmHg,主肺动脉平均压(19.8±7.0)mmHg,主肺动脉舒张压(12.1±5.5)mmHg,右心室收缩压(31.7±9.6)mmHg,右心室平均压(14.4±5.5)mmHg,右心室舒张压(2.9±4.2)mmHg,左心室收缩压(87.6±12.7)mmHg,左心室平均压(32.7±11.0)mmHg,左心室舒张压(7.2±8.6)mmHg。封堵器大小(6.3±1.2)mm,封堵器选用北京华医圣杰科技有限公司、上海形状记忆合金材料有限公司和深圳先建科技有限公司分别为47例(25.2%)、71例(38.2%)和68例(36.6%),封堵器形状对称178例(95.7%)、偏心8例。麻醉方式为全麻147例(79%)、 局麻39例,手术时间(38.8±15.0)min。
2.2 术后住院期间并发症情况 共发生并发症60例(32.3%)。
术后新发心律失常30例(16.1%),其中不完全右束支传导阻滞8例,结性逸搏6例,完全右束支传导阻滞3例,左前分支传导阻滞、Ⅰ°AVB、偶发房性早搏、QT高值各2例,完全左束支传导阻滞+QT高值、阵发性室上性心动过速、非阵发性结性心动过速+干扰性房室脱节、QT延长、V1V2QS波各1例。
术后残余分流30例(16.1%),大、少和微量分流分别为1、14和15例。
术后新发中度及以上瓣膜反流9例(4.8%),均为三尖瓣反流,中度7例,中重度和重度各1例。
严重并发症1例(女,2岁5个月),术后复查TTE提示大量残余分流、重度三尖瓣反流并出现机械性溶血,复查ECG提示左心室肥大及电轴左偏,立即转外科行体外循环下VSD人工材料修补术、VSD封堵器取出术及三尖瓣腱索修复+三尖瓣整形术,术后转PICU予呼吸机辅助呼吸、甲泼尼龙琥珀酸钠减轻心肌水肿、红细胞悬液输注、强心利尿等治疗2 d,后再次转入心胸外科及我科治疗11 d后,复查TTE示无明显残余分流、轻度三尖瓣反流、轻中度二尖瓣反流,好转出院。
2.3 单因素分析 表1显示,术后早期总并发症的相关因素包括超声下缺损大小、右心室收缩压;术后残余分流的相关因素包括性别、年龄、体重、超声下缺损大小、主肺动脉收缩压、右心室收缩压、左心室平均压、封堵器大小;新发中度及以上瓣膜反流的相关因素包括右心室收缩压;未发现心律失常的相关因素。

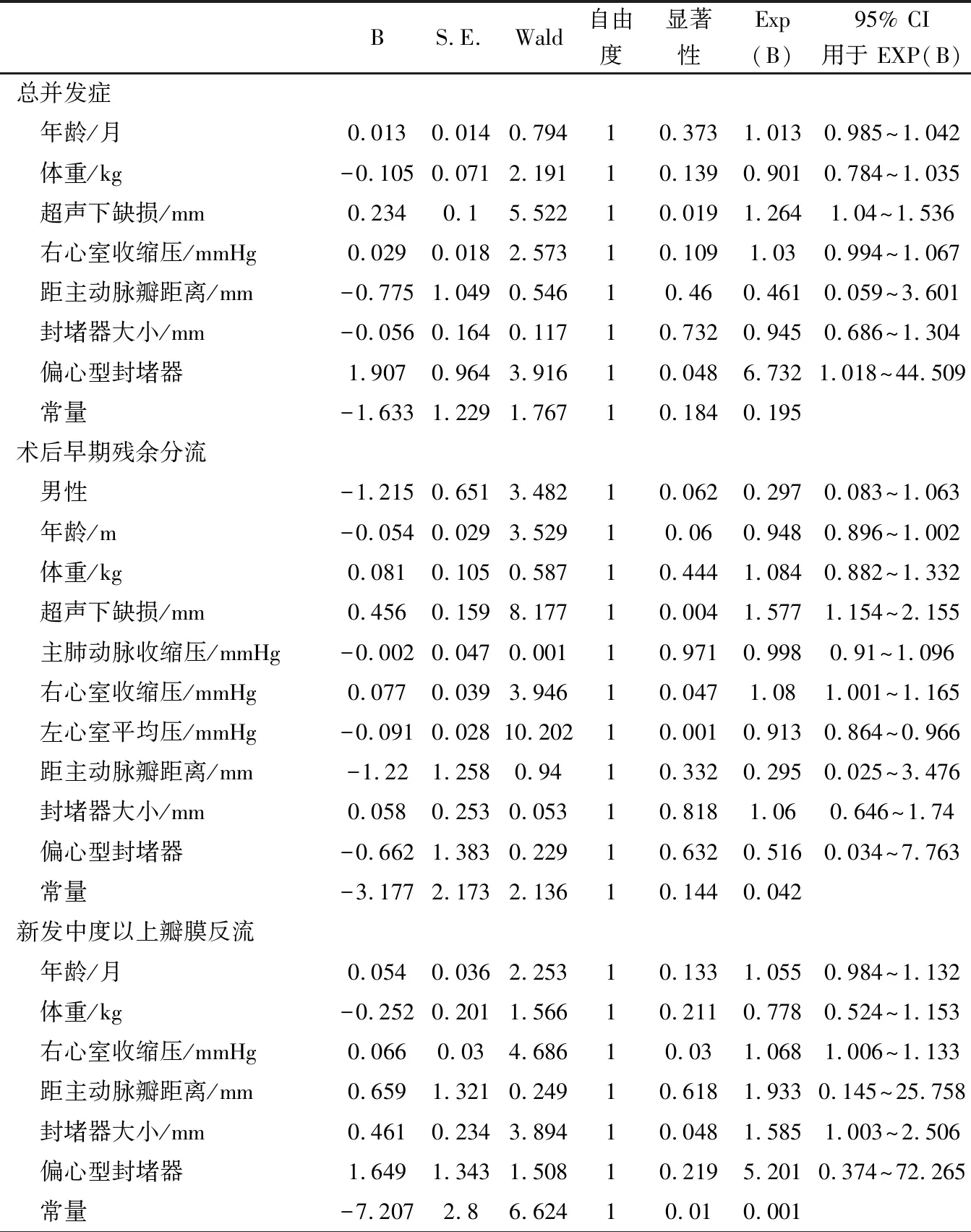
表2 膜周部室间隔缺损介入术后早期并发症危险因素的多因素Logistic回归分析
3 讨论
随着导管介入治疗VSD技术的成熟和各种新型封堵器进入临床使用,介入治疗膜周部VSD在我国已逐渐取代传统的外科手术修补,但是对于其带来相关并发症的风险的担忧仍在一定程度上限制了其应用。
3.1 总并发症 术后总并发症的发生率为32.3%(60/86)。多因素分析发现,超声下大的VSD、偏心型封堵器是膜周部VSD介入术后早期总并发症的独立危险因素,缺损每增加1 mm,发生并发症的风险增加26.4%;使用偏心型封堵器发生并发症的风险是对称型封堵器的6.7倍,由于本研究中使用偏心型封堵器仅8例,结论需谨慎看待。VSD越大,心内分流量越大,对于封堵器稳定性产生一定影响,同时,大的VSD意味着封堵器的边缘更加靠近传导束及瓣膜,也可能增加瓣膜损伤及心律失常等并发症发生的风险。偏心型封堵器主要是用于缺损靠近主动脉瓣的VSD,由于本身结构的特点,其主动脉瓣侧的盘边距离腰部0~0.5 mm,而指向心尖侧约为5 mm。造成了其在主动脉侧固定不如对称型牢固,在血流冲刷下容易产生残余分流,在心尖部更加靠近传导束,增加了心律失常的风险。Meta分析[10]显示,相较于对称性,其在封堵即刻的完全封闭率更低,术后更易发生左右束支传导阻滞及完全性AVB。因而对于较大的VSD的介入治疗应更加谨慎,同时应严格把握使用偏心型封堵器的适应证。
3.2 残余分流 残余分流是最常见的并发症,也是评价手术有效性的重要指标,本研究中其发生率为16.1%(30/186),其中仅1例患儿术后出现大量残余分流,其余均为少量及以下的残余分流。既往文献报道各地的发生率不一,中国Bai等[11]报告为6.8%(8/117),美国El Said等[12]报告为47.4%(9/19);巴西Esteves等[13]报告为8.9%(5/56),印度Mahimarangaiah等[14]报告为29.4%(37/126),考虑原因与术后超声随访的时间及统计的残留量大小有关,本研究随访超声时间为术后24~72 h,低至细丝状的残余分流也纳入统计。本文结果显示,膜周部VSD介入术后早期残余分流危险因素是超声下大缺损和右心室收缩压升高,左心室平均压升高是其保护因素。尽管其中的右心室收缩压、左心室平均压的OR值(1.080和0.913)非常接近无意义值,但是相关血流动力学的指标往往是10 mmHg甚至更大的变化,因此与相关并发症间的联系仍然是不可忽视的。
多年来,由于左心室在心脏功能中的主体作用,与其相关的研究是心功能研究的重点,由于右心室解剖结构的特点,对于右心室形态功能的研究有一定困难。随着研究的深入[15],发现右心室功能与右心相关先天性心脏病(如:肺动脉瓣狭窄、法洛四联症)存在明显的相关性[16],右心功能也是慢性心功能衰竭症状及预后的重要决定因素[17]。Bergersen等[3]发现,血流动力学不稳定与介入相关不良事件相关,血流动力学不稳定性的指标包括右室收缩压升高,主肺动脉收缩压升高或者肺动脉平均收缩压升高等。2011年一项多中心研究中也发现,右心收缩压升高是介入相关不良事件的危险因素[18]。VSD往往会带来血流动力学的改变,本研究也发现右心收缩压升高是膜周部VSD介入术后残余分流的独立危险因素,同时也提示了右心功能、血流动力学不稳定与膜周部VSD介入并发症存在内在联系。大的VSD会引起右心前负荷增加明显,导致右心压力升高,而左心室压力的升高会引起左右心室压力阶差增大,从而减弱右心室收缩压升高带来的血流动力学变化的影响,本研究中发现大的VSD是术后残余分流的危险因素,左心平均压升高是术后残余分流的保护性因素,支持了右心收缩压升高作为残余分流的独立危险因素之一。
3.3 心律失常及瓣膜反流 本研究中心律失常的发生率为16.1%(30/86),与文献报道类似[11, 19, 20],本研究未见完全性AVB等严重心律失常发生。既往报道的封堵器大小、缺损上缘距离主动脉瓣距离<3 mm、偏心型封堵器的选择等术后心率失常的危险因素[4-6],以及本研究统计的其他相关因素,均未发现与心律失常相关。
术后新发的中度及以上瓣膜反流的多因素分析发现,除右心室收缩压升高外,本研究还发现更大的封堵器也是其独立危险因素。越大的封堵器其边缘越靠近瓣膜,可能对于瓣膜的开闭功能产生一定的影响,从而导致瓣膜反流的发生。
综上所述,超声下VSD大小、封堵器的大小与形状、右心室收缩压、左心室平均压与膜周部VSD介入治疗术后早期并发症发生有着密切的关联,同时进一步提示了血流动力学稳定性、右心功能在术后并发症发生中的重要作用。
本研究的不足:①单中心研究,缺少中长期随访的结局。②通过病历系统回顾性收集数据,部分指标的数据有缺失。③尽管我院介入操作严格按照统一的诊疗常规进行,但是术者不同仍可能带来一定的混杂偏倚。
