立体定向放射治疗高龄胰腺癌患者的疗效及安全性分析
2018-04-24汤寅朱晓斐赵宪芝耿杨杨江林宫余海燕孟鸿宇张瑜张火俊
汤寅 朱晓斐 赵宪芝 耿杨杨 江林宫 余海燕 孟鸿宇 张瑜 张火俊
胰腺癌发病率随年龄增长而增高,在美国,胰腺癌分别位列60~79岁、80岁以上男性恶性肿瘤死亡率的第4和第5位,位列60岁以上女性恶性肿瘤死亡率的第4位[1]。研究表明,高龄并非胰腺癌手术的禁忌[2]。但胰腺癌本身是个高消耗性肿瘤,加之根治性切除手术创伤大,手术风险高,绝大部分高龄患者无法耐受,因此,放疗或化疗对高龄胰腺癌患者具有重要作用。立体定向放射治疗(stereotactic body radiation therapy,SBRT)相比普通放疗,具有大分割、高剂量、高精度、高安全性、治疗周期短及不影响后续化疗等优势,为此本研究对SBRT治疗高龄胰腺癌患者的疗效及安全性进行分析。
资料与方法
一、一般资料
回顾性分析2012年1月至2016年12月接受SBRT治疗的均经病理学或细胞学确诊的149例高龄胰腺癌患者资料,其中男性95例、女性54例,年龄75~90岁,中位年龄80岁。纳入标准:(1)年龄≥75岁;(2)依据美国东部肿瘤协作组(ECOG)评分标准[3]的体力状态评分≤2分,肝肾功能正常,无Ⅱ度以上骨髓抑制,无合并心肺功能衰竭;(3)局部晚期胰腺癌、晚期转移胰腺癌或临界可切除胰腺癌,但因高龄、全身状况欠佳及拒绝手术等原因不适合手术或放弃手术者。患者在治疗前均完善胰腺MR或胰腺薄层CT、肝脏MR、血常规、肝功能、CA19-9等检查评估。依据美国国家综合癌症网络(NCCN)指南进行临床分期[4],81例为局部晚期胰腺癌,38例为临界可切除胰腺癌,30例为晚期转移胰腺癌。SBRT治疗目的是缓解局部症状。本研究获医院伦理委员会批准,所有患者均签署知情同意书。
二、SBRT治疗方法
采用射波刀(Accuray Incorporated, Sunnyvale, CA)技术,即影像引导的立体定向机器人放射外科治疗系统。46例患者于定位前1周行内镜超声下金属标志物植入定位,103例患者采用脊柱追踪方式定位。金属标志物规格0.8 mm×5 mm。CT模拟定位时患者取仰卧位,双手置于体侧,用真空负压垫固定体位,静脉注射造影剂后行腹部1.5 mm层厚不间断增强扫描,范围包括肿瘤、淋巴引流区及可能涉及的区域。在CT图像上勾画大体肿瘤靶区,包括原发肿瘤和周围转移性腹膜后淋巴结;计划靶区由大体肿瘤靶区外扩2~5 mm,若肿瘤距离危及器官距离<3 mm时则该方向不外扩,危及器官包括肝脏、胃、十二指肠、小肠、肾脏、脊髓等,最终形成由肿瘤靶区非均匀外扩的个性化计划靶区。放疗计划要求90%的计划靶区被等剂量线包绕,采用单次剂量3.6~9 Gy/f,总剂量19.5~49 Gy/3~8 f的大分割照射方案。正常组织限量参考美国医学物理学家学会的TG-101报告[5]。为比较不同分次照射下的剂量效应,需要计算生物效应剂量(biological effective dose,BED)。BED=nd×[1+d/(α/β)],α/β=10(BED10)。n为分次数,d为分次剂量,nd为总剂量[6]。
三、评价标准
放疗前及治疗后3个月检测血清CA19-9水平。记录患者的生存期和无进展生存期。生存期定义为SBRT治疗后至死亡或随访终止的时间,取中位生存期。无进展生存期定义为SBRT治疗后至病灶增大25%或出现新转移病灶或死亡的时间,以增强CT、增强MRI或PET-CT结果评价疗效。放疗后不良反应依据肿瘤放射治疗组(RTOG)制定的“急性和晚期放疗损伤分级标准”进行评估,分为0~4级[7]。
四、统计学处理
采用SPSS 19.0统计软件进行数据处理,生存分析采用Kaplan-Meier法,采用单变量回归模型分析单因素对生存的影响,采用Pearson相关系数分析变量间的关系,然后采用COX比例风险模型进一步筛选与生存相关的因素。P<0.05为差异具有统计学意义。
结 果
一、血清CA19-9水平变化
治疗前58例CA19-9≤200 U/ml,91例>200 U/ml,治疗后57例CA19-9下降>50%,63例CA19-9下降≤50%或继续升高,29例治疗前后一直处于正常范围。治疗前CA19-9≤200 U/ml与>200 U/ml患者的中位生存期、无进展生存期的差异无统计学意义(P值分别0.162、0.171)。但治疗后CA19-9下降>50%患者的预后好于CA19-9一直处于正常范围及下降≤50%或继续升高的患者(P<0.01,表1)。
二、生物效应剂量(BED10)
149例患者的中位BED10为60.70 Gy(32.13~85.5 Gy),以60 Gy为界限区分高剂量组和低剂量组。高剂量组74例,低剂量组75例,高剂量组患者的中位生存期、无进展生存期显著长于低剂量组,差异均有统计学意义(P值均<0.01,表1),且BED10与CA19-9水平变化有相关性(R2=0.299,P<0.01)。
三、生存期及影响预后的因素
从治疗开始进行随访,截至2017年5月30日,中位随访时间为11.5个月(4~26个月)。149例患者总的中位生存期为12.9个月(95%CI11.9~13.8个月),1年生存率为55.9%;中位无进展生存期为8.3个月(95%CI7.6~8.9个月),1年无进展生存率为19.5%(图1)。
患者的中位生存期、中位无进展生存期与肿瘤分期、治疗后3个月CA19-9下降水平及BED10有关(表1,图2、3)。多因素分析提示肿瘤分期、治疗后3个月CA19-9下降水平及BED10是影响患者生存的独立因素(表2)。
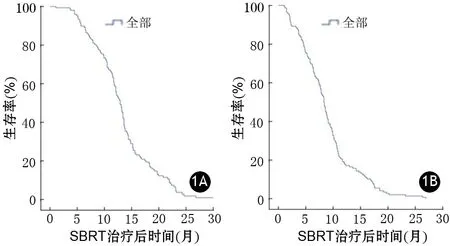
图1 患者的总生存期(1A)及无进展生存期(1B)曲线
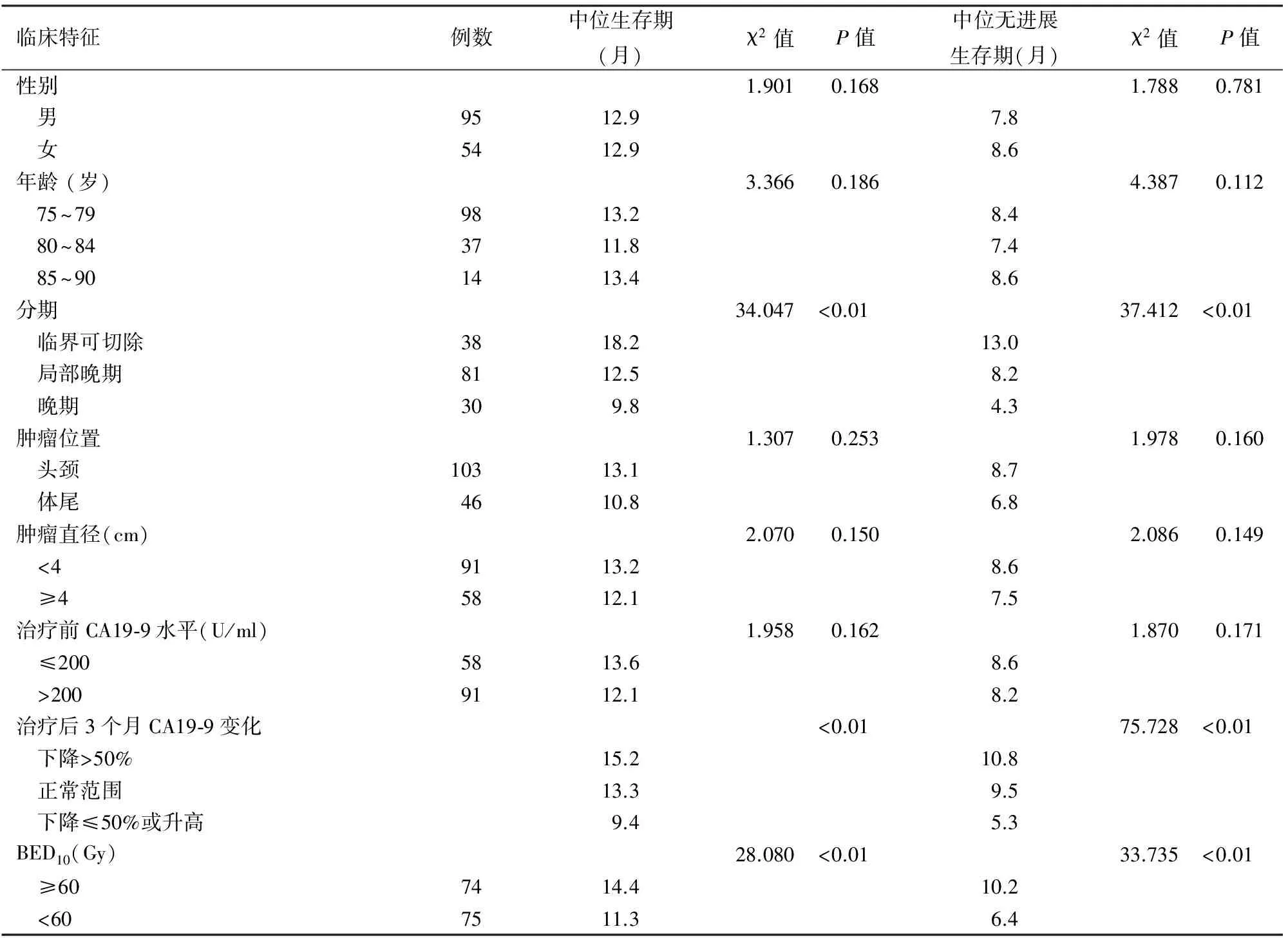
表1 SBRT治疗的高龄胰腺癌患者临床特征与中位生存期、无进展生存期的关系
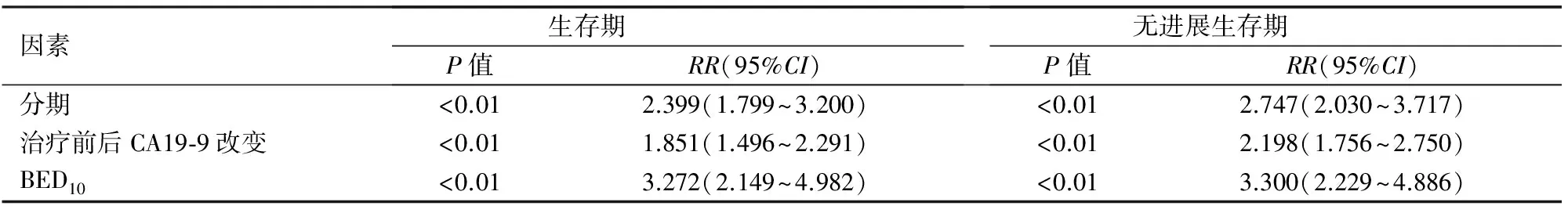
表2 影响患者生存期、无进展生存期的独立因素
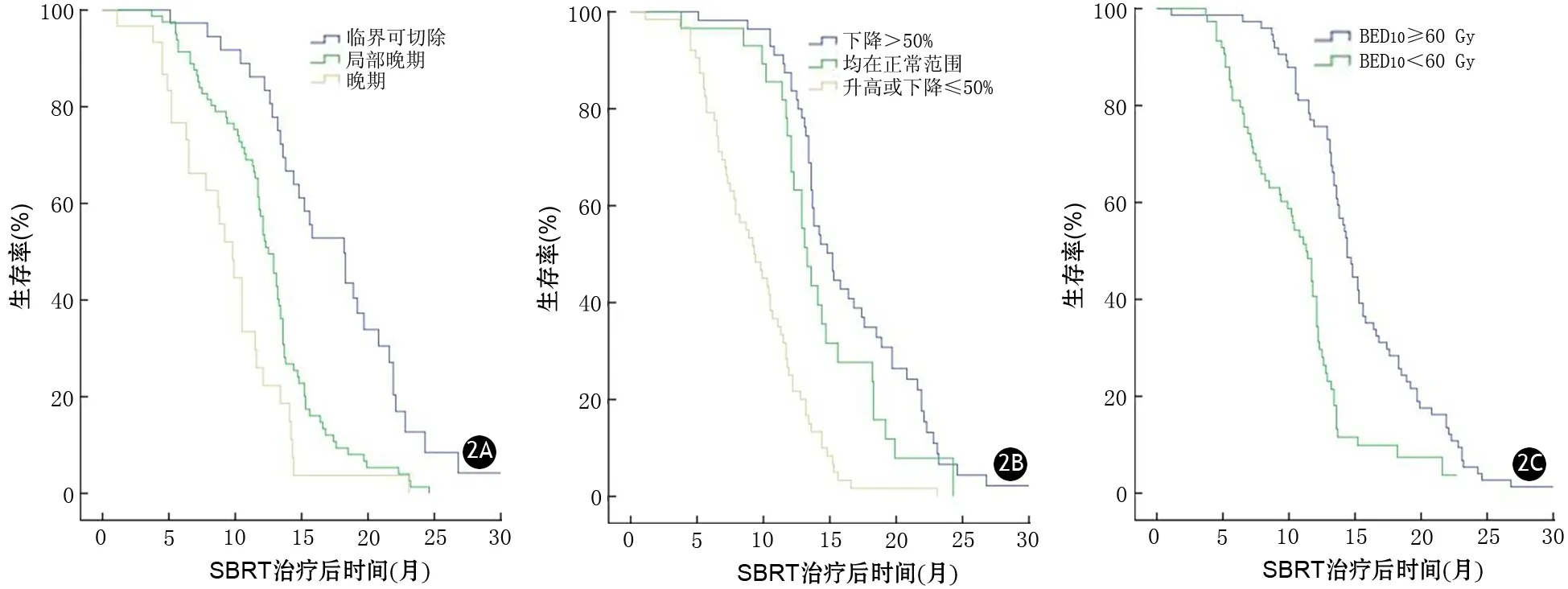
图2 不同临床分期(2A)、CA19-9水平(2B)、BED(2C)患者的总生存期曲线
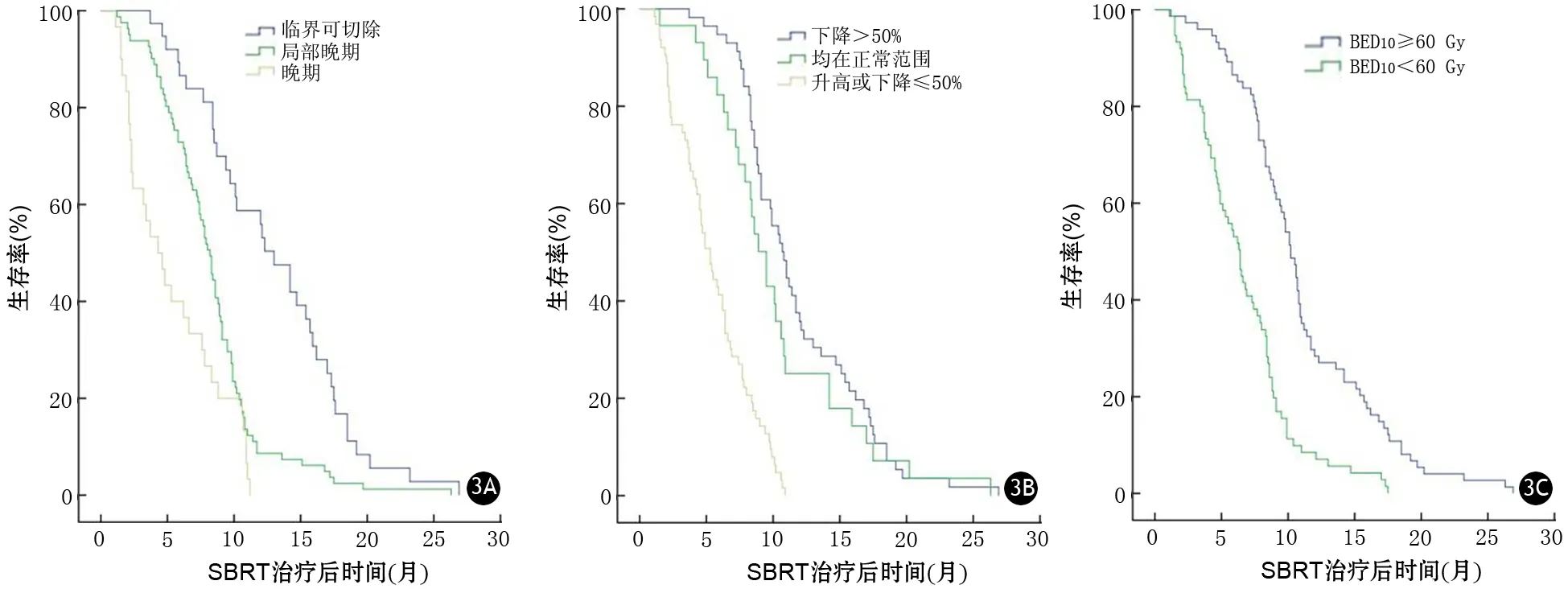
图3 不同临床分期(3A)、CA19-9水平(3B)、BED(3C)患者的无进展生存期曲线
四、放疗后不良反应
患者治疗后出现不同程度的1、2级放疗后不良反应,主要包括白细胞降低、乏力、纳差、轻度呕吐、轻度腹泻等,经对症处理后好转,均未出现3级及以上的放疗后不良反应。
讨论
胰腺癌发病率随着年龄增长而增加, 65岁以上患者占全部患者的60%,75岁以上患者占40%[8-9]。虽然年龄不是胰腺癌手术的禁忌证,但手术并发症和死亡率随着年龄增加而升高,老年胰腺癌患者Whipple手术的术后胃排空延迟、胰瘘、脓毒血症、胃肠道出血、腹腔出血等并发症发生率较高[10]。
国内外诸多研究已经证实了SBRT对不适宜手术和不能手术切除的局限期胰腺癌的疗效,Chang等[11]报道了77例无法切除的胰腺癌患者接受SBRT治疗,其6、12个月局部无进展率分别为91%和84%,总生存率分别为56%和21%,3级以上的放疗后不良反应发生率为9%。Kim等[8]报道26例>80岁无法接受手术的胰腺癌患者接受SBRT治疗,其中10例联合化疗,多数患者的治疗剂量为30~6 Gy/3 f,中位生存期为7.6个月,1年生存率为34.6%;中位局部无复发生存期为11.5个月,1年局部控制率为41.2%;中位远处无转移生存期为8.4个月,1年远处无转移率为41.4%。Yechieli等[9]报道20例>75岁局部进展期胰腺癌患者接受SBRT治疗,分别接受35 Gy/5 f、30 Gy/5 f及36 Gy/3 f,中位生存期为6.4个月(95%CI3.5~10.8个月)。国内任刚等[12]报道33例年龄≥65岁的Ⅳ期胰腺癌患者,胰腺原发灶的剂量为60~80 Gy/15~25 f,转移病灶剂量为35~70 Gy/7~25 f,中位生存期为9个月,1年生存率为24.0%,疼痛缓解率为80.0%(20/25)。既往的一些研究表明,SBRT联合化疗在疗效、不良反应等方面优于标准常规放化疗[13-14]。Kunkler等[15]的回顾性研究提示SBRT是可行的肿瘤治疗方式和相对优先的治疗模式。本研究中患者的中位生存期和无进展生存期分别为12.9个月和8.3个月,1年生存率和无进展生存率分别是55.9%、19.5%,与Johns Hopkins一项未发表的的数据(SBRT治疗29例70岁以上患者,中位生存期为13个月)结果类似,但长于以往的一些文献报道,可能的原因是本研究纳入的患者年龄为≥75岁,Ⅳ期患者的比例为20.1%。
Kim等[8]报道患者均未出现3级及以上急性或晚期放疗后不良反应。Yechieli等[9]报道3例发生了3~4级放疗后不良反应,其中2例为重度脱水,1例为胃肠道出血。任刚等[12]报道患者均无2级及以上消化道不良反应。本研究患者未发生3级及以上的放疗后不良反应,可能的原因是对放疗后不良反应风险较高的患者给予相对较低的处方剂量,且在制定的治疗计划中肿瘤靶区为均匀性外扩,从而避免所形成的计划靶区紧贴危及器官,减少了正常组织的受照剂量。
本研究结果显示,肿瘤分期、治疗后血清CA19-9下降水平、BED10是影响高龄胰腺癌患者预后的独立因素,且BED10与血CA19-9水平变化相关,可能的原因是较高的BED10可达到更好的治疗反应,降低了血清CA19-9水平,从而改善预后。Kim等[8]报道,处方剂量大于20Gy有提高局部控制率的趋势(P=0.063),但并不是局部控制率的独立影响因素。Bendict等[5]报道, BED>70Gy可提高总体生存期(17.8比15.0个月,P=0.03)及局部无复发生存时间(10.2比6.2个月,P=0.05)。本研究受到回顾性资料的限制,且为非随机研究,患者的主观选择可能会影响医师制定治疗计划和研究结果,因此潜在的预后因素需要进一步评估。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016 [J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI: 10.3322/caac.21332.
[2] Frakes JM, Strom T, Springett GM, et al. Resected pancreatic cancer outcomes in the elderly [J]. J Geriatr Oncol, 2015, 6(2): 127-132. DOI: 10.1016/j.jgo.2014.11.005.
[3] Oken MM, Creech RH, Tormey DC, et al. Toxicity and response criteria of the eastern cooperative oncology group[J].Am J Clin Oncol, 1982,5(6):649-655. DOI:10.1097/00000421-198212000-00014.
[4] Tempero MA, Malafa MP, Al-Hawary M, et al. Pancreatic adenocarcinoma, version 2.2017, NCCN clinical practice guidelines in oncology[J]. Natl Compr Canc Netw, 2017,15(8):1028-1061. DOI: 10.6004/jnccn.2017.0131.
[5] Bendict SH, Yenice KM, Followill D, et al. Stereotactic body radiation therapy: the report of AAPM Task Group 101 [J]. Med Phys, 2010, 37(8): 4078-4101. DOI: 10.1118/1.3438081.
[6] Krishnan S, Chadha AS, Suh Y, et al. Focal radiation therapy dose escalation improves overall survival in locally advanced pancreatic cancer patients receiving induction chemotherapy and consolidative chemoradiation [J]. Int J Radiat Oncol Biol Phys, 2016, 94(4): 755-765. DOI: 10.1016/j.ijrobp.2015.12.003.
[7] Radiation Therapy Oncology Group. Cooperative Group Common Toxicity Criteria[EB/OL] . [2017-03-24].https://www.rtog.org/ ResearchAssociates/ AdverseEventReporting/ Cooperative GroupCommonToxicityCriteria.aspx.
[8] Kim CH, Ling DC, Wegner RE, et al. Stereotactic body radiotherapy in the treatment of pancreatic adenocarcinoma in elderly patients [J]. Radiat Oncol, 2013, 8: 240. DOI: 10.1186/1748-717X-8-240.
[9] Yechieli RL, Robbins JR, Mahan M, et al. Stereotactic body radiotherapy for elderly patients with medically inoperable pancreatic cancer [J]. Am J Clin Oncol, 2017, 40(1): 22-26. DOI: 10.1097/COC.0000000000000090.
[10] Smith SL, Hampson F, Duxbury M, et al. Computed tomography after radical pancreaticoduodenectomy (Whipple′s procedure) [J]. Clin Radiol, 2008, 63(8): 921-928. DOI: 10.1016/j.crad.2007.10.012.
[11] Chang DT, Schellenberg D, Shen J, et al. Stereotactic radiotherapy for unresectable adenocarcinoma of the pancreas [J]. Cancer, 2009, 115(3): 665-672. DOI: 10.1002/cncr.24059.
[12] 任刚, 王颖杰, 邸玉鹏, 等. 老年Ⅳ期胰腺癌高剂量少分次放疗的效果观察 [J]. 临床肝胆病杂志, 2016, 32(5): 873-875. DOI: 10.3969/j.issn.1001-5256.2016.05.011.
[13] Su TS, Liang P, Lu HZ, et al. Stereotactic body radiotherapy using CyberKnife for locally advanced unreseetable and metastatic pancreatic cancer[J] . World J Gastroenteml, 2015, 21(26): 8156-8162. DOI:10.3748/wjg.v21.i26.8156.
[14] Wei Q, Yu W, Rosati LM, et al. Advances of stereotactic body radiotherapy in pancreatic cancer[J].Chin J Cancer Res, 2015, 27(4): 349-357. DOI: 10.3978/j.issn.1000-9604.2015.04.12.
[15] Kunkler IH, Audisio R, Belkacemi Y, et al. Review of current best practice and priorities for research in radiation oncology for elderly patients with cancer: the International Society of Geriatric Oncology (SIOG) task force [J]. Ann Oncol, 2014, 25(11): 2134-2146. DOI: 10.1093/annonc/mdu104.
