不同晶胶比液体早期复苏对中度重症急性胰腺炎预后影响
2018-04-24刘爱茹谢沛曾彦博董元航杜奕奇
刘爱茹 谢沛 曾彦博 董元航 杜奕奇
胰酶的异常活化是急性胰腺炎(AP)的始动因素,炎症反应的过度激活、毛细血管通透性增加等微循环障碍的改变是其主要病理过程之一[1]。液体复苏是AP初期治疗的关键环节,可在AP早期克服血管内液体丢失,减少第三间隙液体的潴留,干预瀑布式炎症反应,对阻止AP的进展、降低病死率、提高预后效果具有重要意义[2]。2012年修订的亚特兰大标准将发病后1周定义为AP早期阶段[3],该阶段如何对于中度重症急性胰腺炎(MSAP)进行有效的液体复苏,如何选择比例恰当的晶体、胶体液最能改善预后尚未定论。本研究回顾性分析早期不同晶胶比液体复苏对MSAP患者治疗的影响,为MSAP的早期补液治疗提供一定的循证医学证据。
资料与方法
一、 研究对象
回顾性分析上海长海医院2015年1月至2017年7月间100例MSAP患者的临床资料。入选标准:(1)年龄>18岁;(2)MSAP诊断符合2012年最新亚特兰大分类标准[3];(3)发病至入院治疗时间在48 h内。排除标准:(1)发病前合并严重心、脑、肺、肝、肾功能障碍及肿瘤的患者;(2)入院1周内病死的患者;(3)妊娠合并MSAP患者。最终纳入符合标准的72例患者。
二、研究方法
以24 h为1个观察日,记录入院后7 d内的补液类型及补液量,计算7 d补液晶胶比值(晶体液总量/胶体液总量),以晶胶比4.5和7.5为界,将患者分为低晶胶比(<4.5)组23例、中晶胶比(4.5~7.5)组25例、高晶胶比(>7.5)组24例。记录每例患者液体复苏72 h及7 d内是否转为SAP、发生MODS、需机械通气,是否出现胰腺坏死感染,是否病死及SIRS持续时间和肠内营养达全量(104.6 kJ/kg)所需时间。
三、相关诊断标准
1.SIRS诊断标准[4]:(1)体温>38℃或<36℃;(2)心率>90次/min;(3)呼吸频率>20次/min或PaCO2<32 mmHg(1 mmHg=0.133 kPa);(4)白细胞>12×109/L或<4×109/L,或幼稚杆状核细胞>10%。需满足2项或以上。
2.MODS诊断标准:采用Marshall评分[5-7]。心血管功能衰竭:收缩压<90 mmHg,心率≤54次/min或≥130次/min,平均动脉压(mean arterial pressure, MAP)≤49 mmHg;呼吸衰竭:呼吸频率>35次/min,PaO2<60 mmHg,或氧合指数(PaO2/FiO2)≤200 mmHg;肾功能障碍:尿量<20 ml/h,血清肌酐值≥177 μmol/L;肝功能衰竭:血清总胆红素≥34 μmol/L,转氨酶超过2倍正常值上限;血液系统障碍:血小板≤50×109/L或减少25%,或出现弥散性血管内凝血;中枢神经系统障碍:精神模糊或昏迷,Glasgow评分<7分;胃肠道功能障碍:24 h上消化道出血量>400 ml或出现消化道坏死或穿孔。
四、晶体液和胶体液的种类定义和治疗
晶体液包括氯化钠溶液、乳酸林格液;胶体液包括羟乙基淀粉、低分子右旋糖酐、血浆、白蛋白。满足以下2项或以上标准者为液体复苏达标:心率<120次/min,MAP≥65 mmHg,尿量≥0.5 ml·kg-1·h-1,红细胞比容(HCT)≤0.35,SIRS纠正[8-9]。
复苏同时给予胃肠减压、抑酸、抑酶、抗感染及中成药(芒硝外敷,大黄灌肠)辅助治疗;根据患者病情给予血液净化;对于消化道出血或腹腔出血者给予消化内镜下止血或数字减影心血管造影术(DSA)血管栓塞;腹腔或胸腔大量积液给予腹腔或胸腔穿刺引流。
五、统计学处理
结 果
一、一般资料
各组患者性别、年龄、病因、入院24 h APACHEⅡ评分的差异均无统计学意义,具有可比性(表1)。
二、入院7 d内液体复苏参数
高晶胶比组24、72 h补液总量,复苏7 d的晶体液总量及晶胶液量比值均显著高于中、低晶胶比组;复苏7d的胶体液总量显著低于中、低晶胶比组,差异均有统计学意义(P值均<0.05)。3组7 d的补液总量、24 h与72 h补液总量比值及72 h与7 d补液总量比值的差异均无统计学意义(表2)。
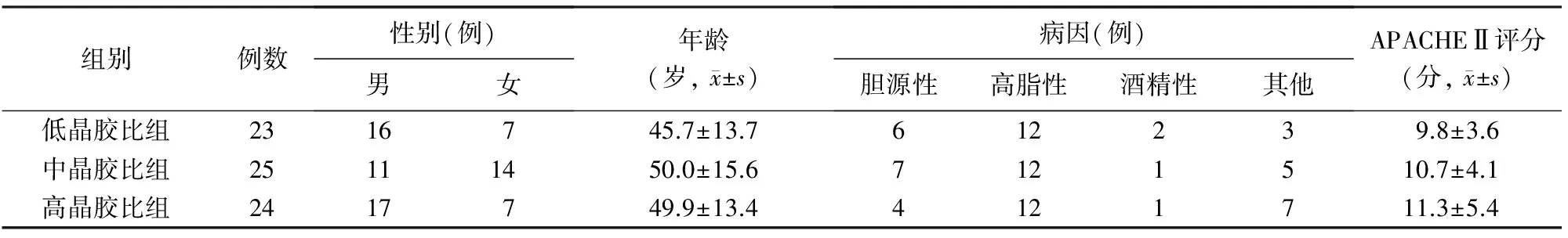
表1 不同晶胶比组患者一般资料比较
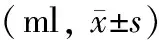
表2 不同晶胶比组液体复苏参数的比较
注:与中、低晶胶比组比较,aP<0.05;与低晶胶比组比较,bP<0.05
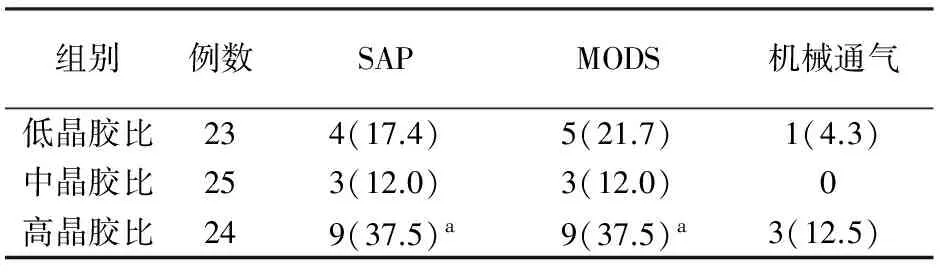
三、复苏效果比较
在液体复苏72 h时高晶胶比组患者进展为SAP的例数、MODS发生率均显著高于中晶胶比组(P值均<0.05),而与低晶胶比组的差异无统计学意义(表3);液体复苏72 h时的机械通气率与中、低晶胶比组的差异均无统计学意义。
在液体复苏7 d时高晶胶比组患者进展为SAP的例数、MODS发生率均显著高于中晶胶比组(P值均<0.05),而与低晶胶比组的差异无统计学意义(表4);7 d时的机械通气率、胰腺坏死感染发生率、30 d内病死率虽高于中、低晶胶比组,但差异均无统计学意义(表4);SIRS持续的时间及肠内营养达全量所需的时间均较中晶胶比组显著延长[(16.5±15.2)d比(8.2±6.4)d, (7.2±3.6)d 比(4.8±2.5)d)],差异有统计学意义(P值均<0.05),与低晶胶比组的差异无统计学意义。低晶胶比组与中晶胶比组的差异均无统计学意义。
表3不同晶胶比组72 h进展为SAP、发生MODS及需要机械通气比较[例数(%)]
组别例数SAPMODS机械通气低晶胶比234(17.4)5(21.7)1(4.3)中晶胶比253(12.0)3(12.0)0高晶胶比249(37.5)a9(37.5)a3(12.5)
注:与中晶胶比组比较,aP<0.05
表4不同晶胶比组7 d进展为SAP、发生MODS、需要机械通气、胰腺坏死感染、30 d内病死率比较[例数(%)]
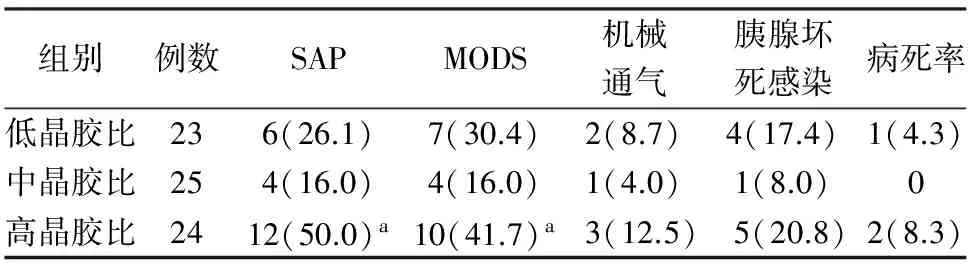
组别例数SAPMODS机械通气胰腺坏死感染病死率低晶胶比236(26.1)7(30.4)2(8.7)4(17.4)1(4.3)中晶胶比254(16.0)4(16.0)1(4.0)1(8.0)0高晶胶比2412(50.0)a10(41.7)a3(12.5)5(20.8)2(8.3)
注:与中晶胶比组比较,aP<0.05
讨 论
AP按照最新的分类标准分为轻症、中度重症和重症3类[3],轻症AP(MAP)症状轻,通常在1~2周内恢复,因此不需要液体复苏。MSAP伴有局部或全身并发症,可出现一过性(48 h内)器官功能衰竭,发病后1周内是SIRS、MODS的高发期,液体复苏是重要的治疗手段,补液不及时、恰当,器官衰竭超过48 h即可进展为SAP,病死率高达30%~50%[10],因此对于MSAP、SAP发病早期及时有效的液体复苏对疾病的预后至关重要。
在血流动力学方面,胶体明显优于晶体,胶体可维持血管内胶体渗透压,减少毛细血管渗漏,降低第三间隙液体潴留[11],可抑制炎症因子,预防炎症反应的进展[12]。晶体分布于血管内和血管外间隙,不仅补充血容量,同时对体内的炎症因子起到冲刷作用[13]。目前晶体和胶体联合补液被推荐为优于单一补液治疗[6,14],但对于晶胶液的比例尚未定论。
一些研究专家指出,晶胶比3∶1早期补液效果更佳,但缺乏高质量临床研究的证据[10]。一项纳入47例SAP回顾性分析报道[15],入院第1个24 h晶胶比为1.5~3.0组患者的机械通气率、病死率、液体潴留量均显著低于<1.5、>3.0晶胶比组。冯永文等[16]报道,SAP患者液体复苏72 h后,高晶胶比组(>3∶1)的补液量、血管外肺水指数、膀胱内压、心房钠尿肽均显著高于低晶胶比组(<3∶1),而PaO2/FiO2显著降低。但对于MSAP患者早期选择何种晶胶比以及补液速率尚未见报道。
Warndorf等[2]报道,补充过多的晶体或胶体液均不利于患者整体预后。本研究结果显示,高、中、低晶胶比组患者7 d内总补液量、补液整体的速率无显著差异,但高晶胶比组24、72 h的补液总量显著高于中、低晶胶比组。此外,高晶胶比组机械通气率、30 d病死率高于中、低晶胶比组,而中晶胶比组机械通气率、30 d病死率低于低晶胶比组,尽管差异无统计学意义,但仍提示早期不宜补充过多的液体。因为早期以晶体为主的大量低渗透性补液可能增加毛细血管的渗漏,加重第三间隙液体潴留和肺水肿的发生,增加急性呼吸衰竭的发生率;而过量的胶体则可能增加血管内的容量负荷,引起血液黏滞、凝血功能障碍及多器官氧合障碍,增加病死率。
胰腺微循环障碍是AP发生发展的重要机制之一,发病早期采用合适的晶胶比进行液体复苏可以改善胰腺微循环状态,增加胰腺血流灌注,减少胰腺坏死,降低SAP的发生率[2]。本研究结果显示,中晶胶比组在液体复苏72 h、7 d内进展为SAP的例数、MODS的发生率均显著低于高晶胶比组,SIRS持续时间最短,可见采用中晶胶比液体复苏可以降低速发型及迟发型MODS的发生及缩短复苏达终点的时间。这可能与微循环的改善可以减少毛细血管渗漏综合征、降低炎症递质的级联反应有关[17]。
中晶胶比组的胰腺坏死感染率低于高、低晶胶比组,但差异无统计学意义,可能与样本量较少有关。此外,降低胰腺坏死感染的发生除了有效液体复苏改善胰腺微循环外,还包括抑酸、抑酶、抗炎抗感染、局部并发症处理等重要措施,补液外相关治疗的不当也会严重影响患者的预后,故需大样本高质量研究进行验证。
AP时微循环障碍、瀑布式炎症反应引起肠黏膜缺血坏死及缺血再灌注损伤,导致肠道机械、生物、化学、免疫屏障破坏,可伴有麻痹性肠梗阻,肠道细菌及内毒素易位即出现肠源性感染,甚至MODS[18]。早期液体复苏改善微循环,尤其胶体可抑制炎症反应,减少缺血再灌注损伤,促进肠黏膜屏障功能的恢复[19-20]。有研究指出,晶胶联合补液组患者血IL-1、IL-8、TNF-α水平显著低于单纯晶体补液组[21],且胃黏膜pH值升高的时间显著缩短[22]。本研究以达到肠内营养全量的时间作为肠道功能恢复的观察指标,结果显示高晶胶比组达到肠内营养全量的时间显著长于中、低晶胶比组,推测胶体可能通过抑制炎症因子的产生,改善肠道微循环,降低肠道黏膜屏障损伤的程度,从而缩短肠道功能恢复的时间。
[1] Tomkotter L, Erbes J, Trepte C, et al. The effects of pancreatic microcirculatory disturbances on histopathologic tissue damage and the outcome in severe acute pancreatitis[J]. Pancreas, 2016,45(2):248-253. DOI:10.1097/mpa.0000000000000440.
[2] Warndorf MG, Kurtzman JT, Bartel MJ, et al. Early fluid resuscitation reduces morbidity among patients with acute pancreatitis[J]. Clin Gastroenterol Hepatol, 2011,9(8):705-709. DOI:10.1016/j.cgh.2011.03.03.
[3] Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis-2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013,62(1):102-111. DOI:10.1097/mpa.0000000000000440.
[4] Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM consensus conference committee. american college of chest physicians/society of critical care medicine[J]. Chest, 1992,101(6):1644-1655.
[5] Witthaut R, Werdan K, Schuster HP. Multiple organ dysfunction syndrome and multiple organ failure. Diagnosis, prognosis and therapeutic concepts[J]. Internist, 1998,39(5):493-501.
[6] Du XJ, Hu WM, Xia Q, et al. Hydroxyethyl starch resuscitation reduces the risk of intra-abdominal hypertension in severe acute pancreatitis[J]. Pancreas, 2011,40(8):1220-1225. DOI:10.1097/MPA.0b013e3182217f17.
[7] 周荣斌. 多器官功能障碍综合征(MODS). 2009年全国危重病急救医学学术会议, 2009, 中国山东青岛.
[8] Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock[J]. N Engl J Med, 2001,345(19):1368-1377. DOI:10.1056/NEJMoa010307.
[9] 毛恩强, 汤耀卿, 李磊, 等. 重症胰腺炎急性反应期控制性液体复苏策略[J]. 中华外科杂志, 2007,45(19):1331-1334. DOI:10.3760/j.issn:0529-5815.2007.19.012.
[10] 中国医师学会胰腺病学专业委员会. 中国急性胰腺炎多学科诊治(MDT)共识意见(草案)[J]. 中华胰腺病杂志,2015,15(4):217-224.DOI:10.3760/cma.j.issn.1674-1935.2015.04.001.
[11] Trikudanathan G, Navaneethan U, Vege SS. Current controversies in fluid resuscitation in acute pancreatitis: a systematic review[J]. Pancreas, 2012,41(6):827-834. DOI:10.1097/MPA.0b013e31824c1598.
[12] Gardner TB, Vege SS, Pearson RK, et al. Fluid resuscitation in acute pancreatitis[J]. Clin Gastroenterol Hepatol, 2008,6(10):1070-1076. DOI:10.1016/j.cgh.2008.05.005.
[13] Martin DT, Kopolovic R, Gower WR, et al. Colloid vs. crystalloid resuscitation in experimental hemorrhagic pancreatitis[J]. Curr Surg, 1984,41(3):189-192.
[14] Mao EQ, Tang YQ, Fei J, et al. Fluid therapy for severe acute pancreatitis in acute response stage[J]. Chin Med J, 2009,122(2):169-173.
[15] Chang YS, Fu HQ, Zou SB, et al. The impact of initial fluid resuscitation with different ratio of crystalloid-colloid on prognosis of patients with severe acute pancreatitis[J]. Zhonghua wei zhong bing ji jiu yi xue, 2013,25(1):48-51. DOI:10.3760/cma.j.issn.2095-4352.2013.01.013.
[16] 冯永文. 不同晶胶比液体复苏对重症急性胰腺炎血管外肺水指数的影响. 中华医学会第五次全国重症医学大会, 2011, 中国广东广州.
[17] Foitzik T, Eibl G, Buhr HJ. Therapy for microcirculatory disorders in severe acute pancreatitis: comparison of delayed therapy with ICAM-1 antibodies and a specific endothelin A receptor antagonist[J]. J Gastrointest Surg, 2000,4(3):240-246.
[18] Tian R, Tan JT, Wang RL, et al. The role of intestinal mucosa oxidative stress in gut barrier dysfunction of severe acute pancreatitis[J]. Eur Revi Med Pharmacol Sci, 2013,17(3):349-355.
[19] Feng X, Liu J, Yu M, et al. Protective roles of hydroxyethyl starch 130/0.4 in intestinal inflammatory response and survival in rats challenged with polymicrobial sepsis[J]. Clin Chim Acta, 2007,376(1-2):60-67. DOI:10.3760/cma.j.issn.2095-4352.2013.01.013.
[20] Schaper J, Ahmed R, Schafer T, et al. Volume therapy with colloid solutions preserves intestinal microvascular perfusion in endotoxaemia[J]. Resuscitation, 2008,76(1):120-128. DOI:10.1016/j.resuscitation.2007.06.026.
[21] Chen QJ, Yang ZY, Wang CY, et al. Hydroxyethyl starch resuscitation downregulate pro-inflammatory cytokines in the early phase of severe acute pancreatitis: A retrospective study[J]. Exp Ther Med, 2016,12(5):3213-3220. DOI:10.3892/etm.2016.3744.
[22] Zhao G, Zhang JG, Wu HS, et al. Effects of different resuscitation fluid on severe acute pancreatitis[J]. World J Gastroenterol, 2013,19(13):2044-2052. DOI:10.3748/wjg.v19.i13.2044.
