氯胺酮对小型猪不同脑区氨基酸类神经递质的影响
2018-04-18张一鸣李晓蕾李欣然李丽娜李亚楠王宇鑫刘文瀚
张一鸣 , 李晓蕾 , 李欣然 , 李丽娜 , 李亚楠 , 王宇鑫 , 刘文瀚 , 陈 宇 , 高 利
(东北农业大学动物医学学院 , 黑龙江 哈尔滨 150030)
氯胺酮属于苯环己哌啶类静脉麻醉药,基本结构为环己胺,于20世纪70年代开始应用于兽医临床,因其拥有良好的镇痛作用、轻度的呼吸抑制以及循环兴奋等特点,导致在麻醉药中至今仍然处于重要的地位[1]。氯胺酮在兽医临床上常与其他药物组合进行复合麻醉,可以减少麻醉药的用量,并增强麻醉效果。
氨基酸类神经递质是19世纪60年代发现的,通过对中枢神经系统中氨基酸类神经递质的研究,现已知氨基酸类神经递质包括兴奋性氨基酸类神经递质和抑制性氨基酸类神经递质两大类。神经递质储存于突触囊泡并通过囊泡释放,因此突触囊泡的胞吐和内吞调控对神经递质释放有着重要的作用[2]。谷氨酸(GLU)由酮戊二酸经相关酶催化合成,天门冬氨酸(ASP)则由GLU与草酰乙酸在谷草转氨酶的作用下合成并储存于囊泡中。GLU和ASP通过扩散与突触后膜上的特异性神经递质受体结合,最终引起突触后膜去极化,产生兴奋性突触后电位(EPSP)。甘氨酸(GLY)可由糖异生途径合成,γ-氨基丁酸(GABA)是以GLU为原料,在包浆中谷氨酸脱羧酶(GAD)的作用下生成,GLY和GABA与突触后膜上的受体结合,使突触后膜超极化,从而产生抑制性突触后电位(IPSP)。氨基酸类神经递质作为中枢神经递质的重要组成部分,有研究表明,其含量的改变与脑损伤、神经退行性病变、镇痛以及学习记忆密切相关,同时氨基酸类神经递质的异常也会诱发诸如兴奋性毒性反应、帕金森病、舞蹈病以及癫痈等多种神经系统疾病[3-4]。
因此,本试验研究氯胺酮对小型猪不同脑区氨基酸类神经递质的影响,探讨氯胺酮在中枢神经系统中的作用机制,明确氯胺酮麻醉的作用部位,同时为氯胺酮的临床应用提供理论依据。
1 材料与方法
1.1 试验材料 氯胺酮,东北农业大学动物医学学院临床外科教研室提供;谷氨酸(GLU)标准品(BCBB5881,Sigma);甘氨酸(GLY)标准品(109K0107,Sigma);天门冬氨酸(ASP)标准品(129K0181,Sigma);γ-氨基丁酸(GABA) 标准品(0001446172,Sigma);美国Waters 600高效液相色谱仪;色谱级乙腈(DIMA TECHNOLOGY INC);色谱级甲醇(DIMA TECHNOLOGY INC)。
1.2 试验动物分组 3月龄健康巴马香猪20只,雌雄兼用,体重10~15 kg,生理健康状态良好,购自黑龙江省哈尔滨市三元养殖场。随机取5只作为生理盐水对照组,其余作为试验组,分为诱导组、麻醉组和恢复组,每组5只。对照组小型猪,肌肉注射生理盐水0.07 mL/kg体重,试验组小型猪,肌肉注射氯胺酮0.07 mL/kg体重。
1.3 样品采集与处理 试验组:肌肉注射氯胺酮溶液后,诱导组、麻醉组和恢复组分别在注射氯胺酮后小型猪倒地不起、翻正反射消失、翻正反射恢复时处死,取脑组织。生理盐水对照组:肌肉注射生理盐水溶液后立即将对照组小型猪宰杀,取脑组织。之后用生理盐水冲洗血液,迅速于冰面上依次分离脑组织(大脑皮层、海马、脑干、小脑和丘脑),分别称重后液氮冷冻,并于-80 ℃保存。
试验时取相应脑组织加入9倍体积甲醇/水溶液,手动研磨数次后将匀浆液注入到EP管中;4 ℃高速离心30 min(3 500 r/min),取上清液低温保存;检测时取脑组织液400 μL,加入100 μL乙腈,混匀,4 ℃高速离心10 min(15 000 r/min),取上清再次高速离心10 min(15 000 r/min),取上清加入0.5 mol/L NaHCO3溶液400 μL,0.5%的2,4-二硝基氟苯200 μL,涡旋混匀,置于65 ℃恒温水浴锅中衍生55 min,最后经0.22 μm微孔滤膜过滤,装入进样瓶准备进样,进样量为20 μL。
1.4 RP-HPLC色谱条件 色谱柱:Symmetry C18(4.6×150 mm,5μm)美国Waters公司生产;流动相:A为0.05 mol/L的醋酸钠缓冲溶液(pH值=6.2),B为乙腈/水(V/V=50∶50),之后进行梯度洗脱,流动相B的浓度由开始时65%经10 min至10%,18 min时至40%;流速:0.6 mL/min;检测波长:360 nm;柱温:28 ℃。进样量为20 μL,采用外标法定量分析,检测各脑区氨基酸神经递质的浓度。
1.5 数据分析 试验数据用平均值±标准差表示。所有试验结果使用SPSS 19软件数据分析系统进行单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 氯胺酮麻醉后小型猪不同脑区神经递质GLU的含量 如图1所示,氯胺酮作用下引起小型猪各脑区神经递质GLU含量变化呈先降低后升高的趋势性。大脑、海马、丘脑、小脑及脑干内GLU含量在诱导组降至最低,与对照组相比分别降低36%、54%、39%、28%和55%,差异极显著(P<0.01)。大脑、小脑GLU含量在麻醉组和恢复组逐渐升高,最终高于正常水平,恢复组GLU含量与对照组相比均呈极显著差异(P<0.01)。海马、丘脑内GLU含量在麻醉组升至最高,与对照组相比上升15%、35%,差异极显著(P<0.01)。脑干内GLU含量在麻醉组升至最高,与对照组相比上升6%,差异不显著(P>0.05);恢复组GLU含量下降,与麻醉组相比差异极显著(P<0.01)。
2.2 氯胺酮麻醉后小型猪不同脑区神经递质ASP的含量 如图2所示:氯胺酮作用下引起小型猪各脑区神经递质ASP含量变化呈现不同的趋势性。海马、丘脑、小脑和脑干中ASP含量在诱导组降至最低,与对照组比较分别下降31%、18%、26%和37%,差异极显著(P<0.01)。海马、丘脑和脑干内ASP含量在麻醉组升至最高且差异极显著(P<0.01);恢复组含量降低但仍高于正常水平,与麻醉组含量比较分别下降15%差异极显著(P<0.01),6%、3%差异不显著(P>0.05)。小脑内ASP含量在恢复组升至最高,与对照组、诱导组含量相比较差异极显著(P<0.01)。大脑内ASP含量逐渐增加,在麻醉组升至最高,与对照组相比升高116%,差异极显著(P<0.01);恢复组含量下降但仍高于正常水平,与对照组、诱导组含量相比差异极显著(P<0.01)。
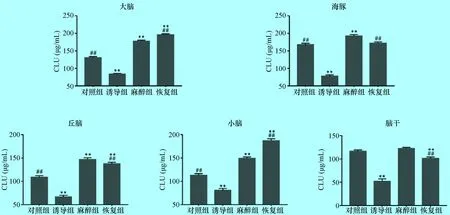

图2 氯胺酮麻醉下小型猪不同脑区神经递质ASP的含量变化 (μg/mL, n=5)
2.3 氯胺酮麻醉后小型猪不同脑区神经递质GLY的含量 如图3所示,氯胺酮作用下引起小型猪各脑区神经递质GLY含量变化呈现不同的趋势性。海马和小脑内GLY含量在诱导组降至最低,与对照组相比下降30%和25%,差异均不显著(P>0.05);麻醉组和恢复组含量逐渐上升,与对照组相比,海马和小脑在恢复组GLY含量分别上升111%和69%,差异极显著(P<0.01)。丘脑和脑干GLY含量在诱导组降至最低;麻醉组含量升至最高,与对照组相比,麻醉组GLY含量分别上升104%和36%,差异显著(P<0.01或P<0.05);恢复组含量下降且高于正常水平,差异显著(P<0.01或P<0.05)。大脑内GLY含量在麻醉组升至最高,与对照组相比上升84%,差异极显著(P<0.01);恢复组含量下降并高于正常水平,差异极显著(P<0.01)。
2.4 氯胺酮麻醉后小型猪不同脑区神经递质GABA的含量 如图4所示,氯胺酮作用下引起小型猪各脑区神经递质GABA含量变化呈现不同的趋势性。大脑内GABA含量在麻醉组升至最高,与对照组比较上升46%,差异显著(P<0.05);恢复组含量下降并接近正常水平,与对照组相比差异不显著(P>0.05)。海马、小脑和脑干内GABA含量在诱导组下降,与对照组相比分别下降41%和39%,差异极显著(P<0.01),12%差异不显著(P>0.05);麻醉组和恢复组GABA含量回升,均高于正常水平且差异显著(P<0.01或P<0.05)。丘脑内GABA含量在诱导组下降,麻醉组GABA含量上升,与对照组相比上升53%,差异极显著(P<0.01);恢复组含量下降并高于正常水平,与对照组相比差异不显著(P>0.05)。
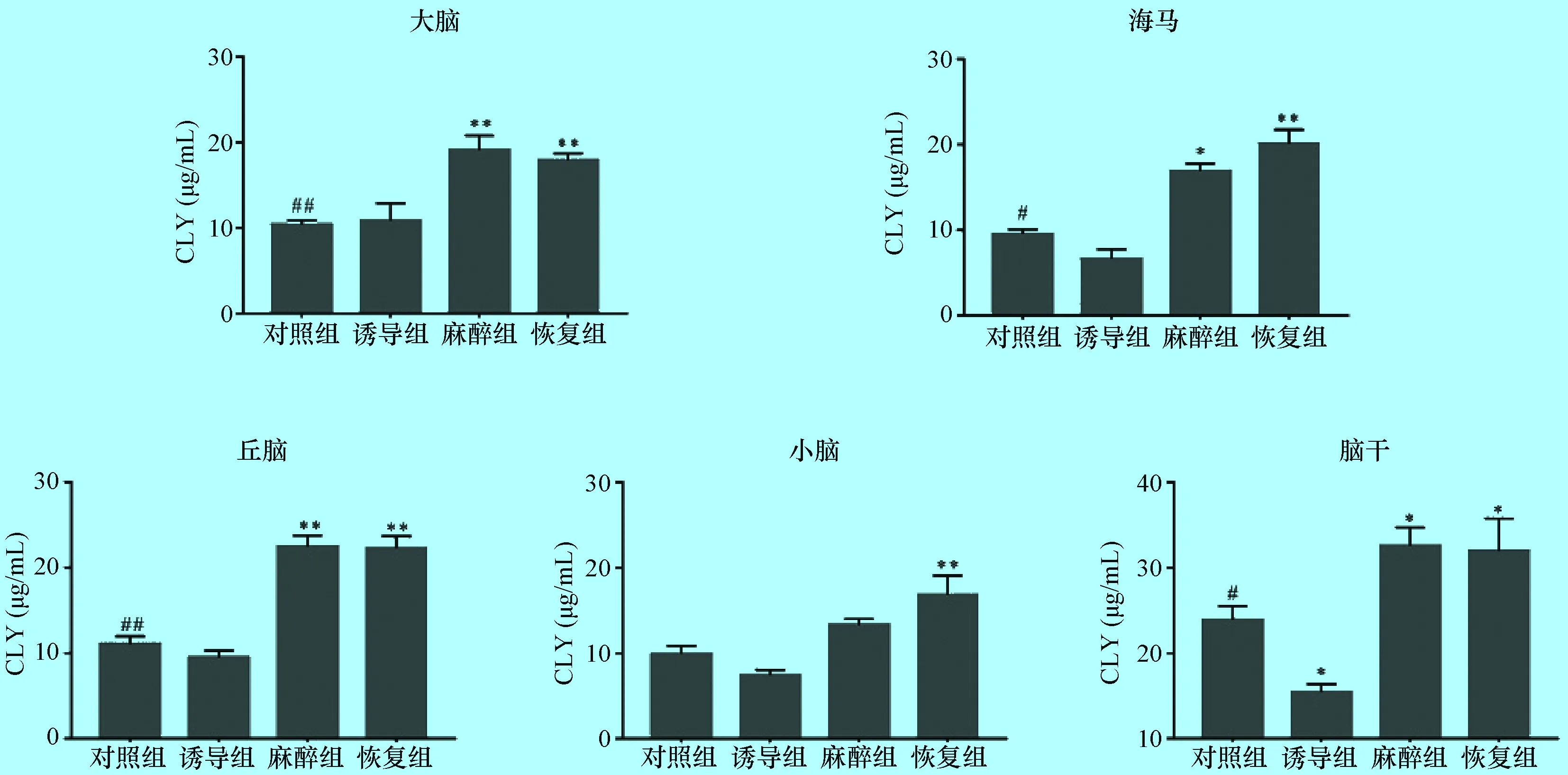
图3 氯胺酮麻醉下小型猪不同脑区神经递质GLY的含量变化 (μg/mL,n=5)

图4 氯胺酮麻醉下小型猪不同脑区GABA的含量变化 (μg/mL,n=5)
3 讨论
氯胺酮麻醉后,小型猪海马、丘脑、小脑和脑干兴奋性神经递质含量分别下降43%、29%、27%和46%,因此海马、丘脑、小脑和脑干是氯胺酮的主要作用部位;小型猪大脑和丘脑抑制性神经递质含量分别升高65%和79%,因此大脑和丘脑是氯胺酮的主要作用部位。神经递质作为突触传递的基础,其摄取、合成、释放、重吸收以及损耗等在中枢神经系统内起重要作用。目前的研究表明,全麻药可以调控神经递质的含量,进而改变相应受体的功能来发挥麻醉效果[5]。
GLU作为哺乳动物脑内含量最高的氨基酸,是锥体神经元中最主要的兴奋性神经递质,在大脑发育、长时程增强、学习记忆及神经元可塑性等方面均起重要作用[6]。Tsurugizawa等通过研究认为异氟醚主要是通过抑制突触前膜GLU释放,同时增加其摄取,并降低突触间隙GLU浓度,从而抑制兴奋性神经传递作用[7]。在本试验中,GLU在各脑区先降低后升高的趋势和张春兰等[9]报道的大鼠注射氯胺酮后对前额叶皮质、海马和杏仁体GLU含量的改变类似。作为GLU受体中最重要的NMDA受体,全麻药可能通过抑制GLU与NMDA受体的结合,同时降低GLU突触前膜的释放,并增强GLU在突触间隙的摄取,来调节谷氨酸能神经元的兴奋性从而产生麻醉效应[8]。推测可能的原因是氯胺酮与NMDA受体结合,非竞争性抑制GLU对该受体激活;氯胺酮降低NMDA受体通道的开放频率及时间;氯胺酮抑制GLU的释放,与受体结合减少,从而影响兴奋性冲动的传递,最后产生麻醉作用。
ASP作为兴奋性氨基酸类神经递质,ASP亦是由突触前膜释放后作用于突触后膜的GLU受体,但其作用效果不及GLU强烈,同时ASP在神经系统兴奋性信息传递的过程中起重要作用,并与突触的形成、神经细胞的存活及可塑性密切相关[10]。张燕等[11]使用与氯胺酮相类似的噻环乙胺对大鼠进行腹腔注射,发现除大脑外其他4个脑区内ASP含量降低,这与本试验的结果一致。结果推测大脑可能不是麻醉药对ASP作用的主要部位,这需要更多的研究去证实。氯胺酮产生的麻醉作用与小脑、海马、脑干和丘脑这4个脑区ASP合成和释放的减少,以及神经元兴奋性的降低有关。
GABA作为中枢神经系统中最重要的抑制性神经递质,它与GLU一样,不能通过血脑屏障,只在脑组织内合成,有研究显示,培养在人工脑脊液(ACSF)中未成熟的小鼠大脑切片中GABA作用为抑制作用[12]。Chowdhury等[13]经研究发现一定剂量的氯胺酮使大鼠额前皮质内的GABA含量增加,这表明氯胺酮作为一种有效的临床麻醉剂,对抑制性神经递质GABA的释放有一定的促进作用。本试验中除大脑外,其他4个脑区GABA含量的变化表现为一个先降低后增加的波动趋势,我们推测氯胺酮使用初期会对GABA的合成和释放有抑制作用,随时间推移这种抑制会减弱,反而增强GABA的合成和释放,减少代谢和消除,从而降低神经元兴奋性,最终产生麻醉作用。
GLY是脑组织中重要的抑制性神经递质,主要介导脊髓及脑干抑制性突触的传递[14]。孙建良等[15]使用异氟醚麻醉大鼠发现其脑内的GLY含量升高,表明异氟醚麻醉机制可能与GLY存在着某种联系,异氟醚产生的麻醉作用与增加抑制性神经递质的释放有着直接的关系。在本试验中麻醉组各脑区GLY含量均高于正常水平,这表明氯胺酮麻醉剂对小型猪五个脑区都有明显的效果,氯胺酮产生的麻醉效果可能是由于其促进GLY的合成和释放,从而增强抑制性突触的传递有关。
4 结论
总之,我们的试验结果表明,氯胺酮产生的麻醉机制可能与抑制小型猪海马、丘脑、小脑和脑干内兴奋性神经递质释放,促进大脑、丘脑内抑制性神经递质释放相关。
参考文献:
[1] Abdallah N M, Salama A K, Ellithy A M,etal. Effects of preincisional analgesia with surgical site infiltration of ketamine or levobupivacaine in patients undergoing abdominal hysterectomy under general anesthesia; A randomized double blind study[J]. Saudi J Anaesth, 2017, 11(3): 267-272.
[2] Zachar G, Wagner Z, Tabi T,etal. Differential changes of extracellular aspartate and glutamate in the striatum of domestic chicken evoked by high potassium or distress: an in vivo microdialysis study[J]. Neurochem Res, 2012, 37(8): 1 730-1 737.
[3] Buchanan R J, Gjini K, Darrow D,etal. Glutamate and GABA concentration changes in the globus pallidus internus of Parkinson's patients during performance of implicit and declarative memory tasks: a report of two subjects[J]. Neurosci Lett, 2015.589: 73-78.
[4] Yan N, Chen N, Lu J,etal. Electroacupuncture at acupoints could predict the outcome of anterior nucleus thalamus high-frequency electrical stimulation in medically refractory epilepsy[J]. Med Hypotheses, 2013, 81(3): 426-428.
[5] Chen X, Yan R, Bai Z,etal. Enhanced sedative efficacy and delayed recovery in propofol anesthesia in a rat model of hepatic cirrhosis[J]. Int J Clin Exp Med, 2015, 8(4): 5 723-5 730.
[6] Ghisleni C, Bollmann S, Poil S S,etal. Subcortical glutamate mediates the reduction of short-range functional connectivity with age in a developmental cohort[J]. J Neurosci, 2015, 35(22): 8 433-8 441.
[7] Tsurugizawa T, Uematsu A, Uneyama H,etal. Effects of isoflurane and alpha-chloralose anesthesia on BOLD fMRI responses to ingested L-glutamate in rats[J]. Neuroscience, 2010, 165(1): 244-251.
[8] 张春兰.氯胺酮对大鼠相关脑区兴奋性神经递质的影响[D].昆明:昆明医学院法学院,2011.
[9] 疏树华,潘建辉,方才.谷氨酸及N-甲基-D-门冬氨酸受体与全身麻醉药[J].中国临床保健杂志,2007,10(6):652-654.
[10] Marchi M, Zappettini S, Olivero G,etal. Chronic nicotine exposure selectively activates a carrier-mediated release of endogenous glutamate and aspartate from rat hippocampal synaptosomes[J]. Neurochem Int, 2012, 60(6): 622-630.
[11] 张燕.噻环乙胺及小型猪复合麻醉剂(XFM)对大鼠不同脑区神经递质含量的影响[D].哈尔滨:东北农业大学,2010.
[12] Rheims S, Holmgren C D, Chazal G,etal. GABA action in immature neocortical neurons directly depends on the availability of ketone bodies[J]. Neurochem, 2009, 110 (4): 1 330-1 338.
[13] Chowdhury G M, Behar K L, Cho W,etal. (1)H-[(1)(3)C]-nuclear magnetic resonance spectroscopy measures of ketamine's effect on amino acid neurotransmitter metabolism[J]. Society of Biological Psychiatry, 2012, 71(11): 1 022-1 025.
[14] Tatetsu M, Kim J, Kina S,etal. GABA/glycine signaling during degeneration and regeneration of mouse hypoglossal nerves. Brain Res, 2012, 1446: 22-33.
[15] 孙建良,段世明.异氟烷对大鼠皮层, 海马及脊髓氨基酸类递质的影响[J].中华麻醉学杂志, 2002, 22(3): 171-173.
