雷米普利对慢性心力衰竭大鼠肾脏细胞凋亡、半胱氨酸天冬氨酸蛋白酶3及细胞色素C的影响
2018-04-17张梦云杨晓欧李秀华
徐 婧 张梦云 杨晓欧 李秀华
(承德医学院附属医院老年病科,河北 承德 067000)
慢性心力衰竭(CHF)是多种心血管疾病的终末阶段,常伴有全身水钠潴留、肾素-血管紧张素、醛固酮系统调节异常和心肌重构〔1〕,末期阶段各种器官的衰竭现象也愈来愈严重,尤其肾功能不全,已经成为CHF患者加重和死亡的独立因子〔2〕。研究表明,CHF患者肾脏存在不同程度变性、坏死等病理改变,且随病程进展,病变也加重〔3〕。在CHF的早期,肾损害存在可逆性,即在肾损害的早期及时治疗和控制,可能会得到完全恢复,因此,早期发现患者的肾损伤对CHF的治疗和预后判断有重要意义。雷米普利作为一种高效血管紧张素转化酶抑制剂(ACEI),为临床治疗CHF的一线药物〔4〕。研究发现,雷米普利具有非降压依赖性肾脏保护作用,可减轻不同疾病动物模型的肾损伤〔5〕,但具体机制不明。本研究主要观察雷米普利对CHF大鼠肾脏细胞凋亡及其因子半胱氨酸天冬氨酸蛋白酶(caspase)-3和细胞色素C的影响。
1 材料与方法
1.1主要试剂及药品凋亡检测试剂盒(美国罗氏公司),逆转录聚合酶链反应(RT-PCR)试剂盒(大连宝生物工程有限公司),Trizol,细胞色素C引物(美国 Invitrogen公司),caspase-3引物(上海生工公司),caspase-3及细胞色素C兔抗多克隆抗体(武汉博士德公司),雷米普利(昆山龙灯瑞迪制药有限公司),DEPC水(天津市福晨化学试剂厂提供);二喹啉甲酸(BCA)蛋白定量试剂盒(北京索莱宝科技有限公司)。
1.2动物来源及分组选择健康雄性Wistar大鼠40只(北京华阜康生物科技股份有限公司,许可证编号:2009-0004),体重210~240 g,按清洁级动物分笼饲养,适应性喂养1 w后,随机选取10只作为正常对照组,余均经肾上动脉缩窄术建立CHF模型,将建模成功的20只大鼠随机分为模型组和雷米普利组,每组10只,正常对照组只穿线不结扎,雷米普利组给予雷米普利 1 mg·kg-1·d-1灌胃,模型组及正常对照组给予等量生理盐水灌胃。实验期间3组大鼠均自由饮水,正常饮食。饲养室环境温度保持18℃~28℃,相对湿度为40%~60%,定时用日光灯照射12 h/d。
1.3方法
1.3.1建立CHF模型在大鼠左肾动脉下方0.5 cm处游离腹主动脉,将去尖7号针头与游离的腹主动脉并行后,用粗丝线一起结扎阻断血流,迅速抽出针头见远端动脉充盈后缝合腹腔。术后均给予连续3 d腹腔青霉素20万U注射〔6〕,测血流动力学参数时造模成功的标准为左心室舒张末压(LVEDP)≥15 mmHg,正常对照组除未缩窄腹主动脉外其余同模型组。
1.3.2标本制取造模成功且给药4 w后处死大鼠,立即取出肾脏,放入装有冰盐水的培养皿中冲洗后在冰块上操作,剪取部分肾脏组织,置于10%甲醛溶液中固定,常规酒精脱水,二甲苯透明,石蜡包埋,留做光镜、原位末端标记(TUNEL)荧光化学染色;取右肾皮质组织于-80℃冰箱保存待行逆转录聚合酶链反应(RT-PCR)、Western印迹实验〔7〕。
1.3.3苏木素-伊红(HE)染色将石蜡切片常规脱蜡和水化后,置于苏木素液中3~5 min,清水冲洗1 min,1%盐酸分化3~5 s(切片变红,颜色变浅即可),0.5%氨水反蓝,然后清水复洗10 min,放入伊红液中1 min,再依次用95%和100%酒精脱水各10 min,二甲苯透明,中性树胶封片,制成HE染色切片。于光镜下观察肾脏形态学改变。
1.3.4TUNEL测定肾脏细胞凋亡率取切片常规脱蜡至水,于室温下浸泡于3 mol/L的过氧化氢甲醇液中30 min,磷酸盐缓冲液(PBS)清洗之后滴加复合酶,放入37℃温箱中孵育20 min,滴加新配制的绿色荧光标记液,标本用盖玻片覆盖,于37℃温箱中静置1 h,继续PBS清洗,加入转化剂过氧化物(POD),于37℃温箱中孵育30 min,PBS洗后滴加二氨基联苯胺(DAB)显色,苏木素轻度复染,脱水透明封片。采用荧光显微镜观察细胞凋亡情况并以此计数,细胞核被染为绿色荧光,即为阳性细胞,每个标本观察10张切片,每张切片随机选择10个视野(×200倍)中的凋亡阳性细胞,计算凋亡指数(AI),AI(%)=(凋亡阳性的细胞核数/总计数的细胞核数)×100%,测定肾脏细胞的凋亡率。
1.3.5RT-PCR法检测肾脏组织中caspase-3及细胞色素C mRNA的表达组织总RNA提取:于低温冰箱中取组织50~100 mg,冰上解冻后加入1 ml Trizol匀浆捣碎,滴加氯仿(大约为Trizol的1/5),充分离心后取上清,加入同体积异丙醇,用手上下混匀,沉淀RNA,取沉淀用75%乙醇洗涤,并将其溶于DEPC水中,紫外可见分光光度计仪器测量RNA浓度及纯度。扩增PCR中,需5倍PCR缓冲液,dNTP,Taq酶及特异性PCR引物;引物序列为:caspase-3,上游5′-TCCACGAGCAGAGTCAAA-3′,下游5′- TTCAACAAGCCAACCAAG-3′,扩增片段208 bp;细胞色素C,上游5′-CCTTTGTGGTGTTGACCAGC-3′,下游5′-CCATGGAGGTTTGGTCCAGT-3′,扩增片段140 bp;β-actin上游5′-GAGAGGGAAATCGTGCGTGAC-3′;下游5′-CATCTGCTGGAAGGTGGACA-3′,扩增片段为452 bp;退火温度依次为52℃、50.5℃、57℃。RT-PCR产物于溴已啶2%琼脂糖凝胶电泳,在凝胶成像分析系统下进行分析,拍摄电泳图像,目的基因caspase-3及细胞色素C mRNA的相对表达量由测定的目的基因与β-actin的RT-PCR产物电泳带的灰度比值测得。
1.3.6Western印迹法检测肾脏组织中caspase-3及细胞色素C蛋白含量取 50 μg上样,5%聚丙烯酰胺
凝胶浓缩,12.5%分离胶电泳分离1.5 h,之后将凝胶蛋白转至PVDF膜,膜蛋白面向上置于5%脱脂牛奶中,4℃冰箱下封闭过夜,加适当稀释浓度的一抗,匀速摇床孵育2 h后漂洗3次,然后加入PBS稀释的辣根过氧化物标记的二抗(稀释比例1∶500),室温反应1 h后,TBST漂洗3次,化学发光底物显色,曝光,成像。扫描胶片,检测目标条带的光密度值,通过计算与内参蛋白光密度比值确定目的蛋白相对表达量。
1.4统计学方法采用SPSS19.0统计软件进行方差分析及SNK检验。
2 结 果
2.1各组肾脏病理学观察正常对照组大鼠肾脏无明显病理改变;模型组大鼠肾小管系膜区增宽,细胞排列紊乱,结构消失;雷米普利组大鼠肾脏出现类似模型组变化,但较模型组减轻,见图1。
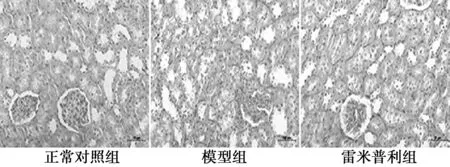
图1 光学显微镜下观察HE染色大鼠肾脏形态学变化(HE,×200)
2.2各组肾脏细胞凋亡率比较凋亡细胞主要见于肾小管,正常对照组少见凋亡细胞,模型组可见较多凋亡细胞(P<0.01),雷米普利组可见凋亡细胞,较正常对照组明显增多(P<0.01),但与模型组相比显著减少(P<0.01),见图2,表1。

图2 TUNEL法检测各组肾组织细胞凋亡的变化(×200)

组别AI(%)mRNAcaspase⁃3细胞色素C蛋白caspase⁃3细胞色素C正常对照组284±089030±003030±003052±012037±013模型组4085±1231)079±0031)089±0011)271±0091)252±0121)雷米普利组1996±1191)2)059±0041)2)054±0061)2)177±0111)2)159±0111)2)
与正常对照组比较:1)P<0.01;与模型组比较:2)P<0.01
2.3各组肾脏组织caspase-3及细胞色素C mRNA表达与正常对照组相比,模型组caspase-3及细胞色素C mRNA均有较高表达(P<0.01);与模型组相比,雷米普利组caspase-3及细胞色素C mRNA表达明显降低(P<0.01),但仍明显高于正常对照组(P<0.01),见图3,表1。

1、4组为正常对照组;2、5组为模型组;3、6组为雷米普利组图3 RT-PCR 法检测各组肾组织 caspase-3及细胞色素C mRNA 表达
2.4各组肾脏组织caspase-3、细胞色素C蛋白比较caspase-3蛋白及细胞色素C蛋白主要表达于肾小管内。与正常对照组相比,模型组、雷米普利组肾组织caspase-3及细胞色素C蛋白表达均明显上调(P<0.01);但雷米普利组 caspase-3及细胞色素C蛋白表达较模型组显著下调(P<0.01),见图4,表1。

图4 各组肾脏组织caspase-3及细胞色素C蛋白表达
3 讨 论
细胞凋亡可能是肾脏病变的重要分子细胞学基础,凋亡不仅与神经内分泌因子和凋亡途径有关,还与凋亡相关基因和蛋白的表达有关〔8〕。在动物细胞中,线粒体通路是最普遍的凋亡机制和细胞凋亡核心,其功能及作用受到越来越多关注〔9,10〕。而这一途径的激活又依赖线粒体膜电位的下降和线粒体内的细胞色素C释放到胞质,触发caspase的级联效应,首先激活caspase-9,进而caspase-9进一步激活下游的caspase-3,6,7,诱发细胞凋亡〔11〕。细胞色素C和caspase-3分别作为线粒体凋亡途径的启动因子和关键执行因子,在凋亡中有着不可替代的地位,也是检测线粒体途径致细胞凋亡的重要指标〔12,13〕。
有实验显示,血管紧张素Ⅱ是导致心脏、肾脏、肺脏及其他器官细胞凋亡的一个诱导剂〔14,15〕,其可能机制为血管紧张素Ⅱ与其受体结合后,通过Gqa调节蛋白激活磷脂酶C,加速细胞膜中的磷酸肌醇(Ip3)和甘油二酯(DAG)、Ip3刺激Ca2+从肌浆网释放;DAG使蛋白激酶c同功异构体ε从细胞质转位至细胞膜上L型Ca2+通道,导致Ca2+内流,从而引起胞质线粒体内Ca2+增多,影响线粒体通透性转换孔的开闭,破坏线粒体膜电位的稳定性,同时激活Ca2+依赖的DNA酶系,使DNA断裂,影响能量代谢,进而影响线粒体结构与功能,促发凋亡〔16,17〕。
雷米普利经胃肠道吸收后在肝脏水解,生成具有活性的雷米普利拉,发挥竞争性抑制血管紧张素酶的作用〔4〕。由此推测可能由于雷米普利拉具有独特的戊烷结构,脂溶性高,故能与心、肾、血管组织中的血管紧张素转换酶的两个活性位点同时结合,抑制血管紧张素转换酶,从而抑制了血管紧张素Ⅰ向血管紧张素Ⅱ的转化,进一步阻断了线粒体凋亡途径,不但发挥了扩血管、排钠利尿和抑制交感神经冲动等作用,也起到了抑制细胞凋亡发生的作用。
本研究显示,雷米普利具有抑制CHF大鼠肾脏细胞凋亡的作用,其机制可能与减少血管紧张素Ⅱ的生成,改善线粒体结构,减少细胞凋亡蛋白细胞色素C的释放,下调caspase-3蛋白水平有关,并验证了雷米普利的肾脏保护作用,细胞凋亡作为肾脏病变的病理基础,对雷米普利有一定的敏感性。
1欧阳劭,陈伟,匡希斌.培哚普利对慢性心力衰竭大鼠肾脏水通道蛋白2的影响〔J〕.中华心血管病杂志,2013;41(4):276-81.
2苏显明,何亚军,刘景委,等.klotho蛋白与心力衰竭患者肾脏损害的相关性〔J〕.中国老年学杂志,2012;32(17):3686-7.
3Hease M,Muller C,Damman K,etal.Pathogensis of cardiorenal syndrome type 1 in acute decompensated heart failure:workgroup statements from the eleventh consensus conference of the Acute Dialysis Quality Initiative(ADQI)〔J〕.Contrib Nephrol,2013;182(1):99-116.
4Borghi C,Cosentino ER,Rinaldi ER,etal.Effect of zofenopril and ramipril on cardiovascular mortality in patients with chronic heart failure〔J〕.Am J Cardiol,2013;112(1):90-3.
5Buleon M,Allard J,Jaafar A,etal.Pharmacological blockade of B2-kinin receptor reduces renal protective effect of angiotensin-converting enzyme inhibition in db/db mice model〔J〕.Am J Physiol Renal Physiol,2008;294(5):F1249-56.
6Roussel E,Gaudreau M,Plante E,etal.Early responses of the left ventricule to pressure overload in Wistar rats〔J〕.Life Sci,2008;82:265-72.
7贾政,魏玲,刘茜,等.重组腺病毒介导Klotho基因转导对大鼠心力衰竭心肌重构的影响〔J〕.中华心血管病杂志,2015;3(43):219-26.
8Re RN.A possible mechanism for the progression of chronic renal disease and congestive heart failure〔J〕.J Am Soc Hypertens,2015;9:54-63.
9Liu LC,Damman K,Lipsic E,etal.Heart failure highlights in 2012-2013〔J〕.Eur J Heart Fail,2014;16(2):122-32.
10Jiang H,Li J,Zhou T,etal.Colistin-induced apoptosis in PC12 cells:involvement of the mitochondrial apoptotic and death receptor pathways〔J〕.Int J Mol Med,2014;3(5):1298-304.
11Jiang L,Wang L,Chen L,etal.As2O3 induces apoptosis in human hepatocellular carcinoma HepG2 cells through a ROS-mediated mitochondrial pathway and activation of caspases〔J〕.Int J Clin Exp Med,2015;8:2190-6.
12冯翔宇,赵亮,冯佩明,等.曲美他嗪干预对心力衰竭大鼠心肌细胞线粒体超微结构、心肌细胞凋亡及半胱氨酸天冬氨酸蛋白酶 3 蛋白、细胞色素 C 蛋白表达的影响〔J〕.中国循环杂志,2015;30(3):1-4.
13Zhao L,Yan X,Shi J,etal.Ethanol extract of forsythia suspense root induces apoptosis of esophageal carcinoma cells via the mitochondridal apoptotic pathway〔J〕.Mol Med Rep,2015;11:871-80.
14Bosman FT,Stamenkovic I.Functional structure and composition of the extracellular matrix〔J〕.J Pathol,2003;200(4):423-31.
15Mori J,Zhang L,Oudit GY,etal.Impact of the renin-angiotensin system on cardiac energy metabolism in heart failure〔J〕.J Mol Cell Cardiol,2013;63:98-106.
16刘以鹏,梁伟,陈星华,等.IQGAP1在血管紧张素Ⅱ诱导足细胞凋亡中的作用及其机制探讨〔J〕.中华肾脏病杂志,2014;3(30):210-6.
17Chang YM,Tsai CT,Wang CC,etal.Alpinate oxyphyllae fructus(Alpinia Oxyphylla Miq)extracts inhibit angiotensin-Ⅱ induced cardiac apoptosis in H9c2 cardiomyoblast cells 〔J〕.Biosci Biotechnol Biochem,2013;77:229-34.
