1型糖尿病大鼠心肌纤维化microRNA表达变化筛选
2018-04-17张明霞吴均芳陈云肖
黄 俊 张明霞 吴均芳 陈云肖 姜 红
(南昌大学第一附属医院心内科,江西 南昌 330006)
心肌纤维化是糖尿病重要并发症之一,其发病机制并未完全阐明〔1〕。miRNA是近年发现的一类来源于内源性染色体的非编码单链RNA,可对目的基因进行转录后表达调控。miRNA在心肌组织有特征性表达,在调控心肌细胞的分化发育,在众多心脏病变的病理生理过程中起着重要作用〔2,3〕。本文拟建立1型糖尿病大鼠心肌纤维化模型,运用基因芯片技术检测心肌组织中miRNA差异表达,初步探讨miRNA在1型糖尿病心肌纤维化病理过程中的作用。
1 材料与方法
1.1动物、分组、主要试剂和仪器30只雄性SD大鼠,体质量(170±5.85)g;随机分为糖尿病模型组和对照组各15只。实验动物按南昌大学医学院动物伦理委员会规定执行。链脲佐菌素(STZ),TRIzol试剂(Sigma,美国);血糖仪(强生稳豪血糖仪,美国);GE VIVI7超声诊断系统(探头频率12 MHz,美国GE);第六代miRCURY TM LNA Array (v.16.0,Exiqon);荧光标记、芯片杂交及结果检测在上海康成生物公司实验室完成;奥林巴斯BX51显微镜。
1.2方法
1.2.1建立糖尿病心肌纤维化大鼠模型参考相关文献〔4〕,模型组大鼠经单次腹腔注射STZ(60 mg/kg)制作1型糖尿病动物模型。对照组大鼠则单次腹腔注射等量柠檬酸缓冲液。STZ注射后72 h,尾静脉采血检测随机血糖,模型组剔除血糖低于16.7 mmol/L大鼠。成模后每周测量实验大鼠体质量、血糖1次,血糖高于16.7 mmol/L即认为模型建立成功。
1.2.2心脏功能检测建模后12 w超声心动图检测,大鼠麻醉固定仰卧略向左倾斜位后获取胸骨旁左室长轴切面二维及M型超声图像,测量左心室射血分数(LVEF),左室壁厚度(LVWT),左室舒张末期内径(LVEDD),左室收缩末期内径(LVESD)和左心室短轴缩短率(FS)。
1.2.3心肌VG染色组织学检查建模后12 w麻醉、处死大鼠,取左心室心肌组织,10%磷酸盐缓冲液(PBS)中性甲醛固定,脱水、透明、石蜡包埋后制成切片,VG染色观察心肌组织胶原含量变化,Image-Pro Plus4.0图像系统测量心肌组织胶原容积分数(CVF,胶原面积/总面积)。
1.2.4心肌组织miRNA表达检测芯片检测差异表达miRNA,TRIzol试剂抽提大鼠心肌组织总 RNA,分光光度计定量,甲醛变性凝胶电泳检测总RNA质量。分离<100 nt的小分子RNA,miRCURY TM Hy3 TM萤光标记,采用第6代 miRCURY TM LNA Array芯片(包含1 891个成熟miRNA探针,包括miRBase 16.0中所有人类、大鼠和小鼠microRNAs,及与之相关的所有病毒microRNAs,包含66个新的miRPlus TM人类microRNAs探针)进行基因芯片杂交,Axon GenePix 4000B microarray 扫描仪扫描芯片,GenePix Pro 6.0 software软件对芯片图像分析。
1.2.5差异miRNA靶基因预测及功能分析采用生物信息学分析方法,运用 miRBase和starBase分析软件进行差异表达miRNAs的靶标基因预测和功能分析。
1.3统计学方法采用SPSS7.0软件进行t检验。
2 结 果
2.1两组生存率、血糖、心脏功能及心肌组织学改变模型组与对照组大鼠生存率分别为93.3%和100.0%;模型组大鼠血糖均>16.7 mmol/L,对照组为5.6~7.4 mmol/L。超声检测模型组大鼠LVWT、LVEDD和LVESD明显大于对照组;LVEF和左心室FS明显小于对照组(均P<0.05),见表1。心肌VG染色模型组粉红色胶原组织增多,对照组黄色心肌组织内仅有少许粉红色胶原组织表达;胶原半定量分析对照组CVF〔(1.93±0.45)%〕明显少于模型组〔(8.35±1.02)%,P<0.05〕。

表1 两组心脏指标比较
与对照组比较:1)P<0.05
2.2miRNA芯片检测见表2,表3。芯片检测结果显示,12 w模型大鼠心肌组织62个miRNAs表达有明显差异,其中上调miRNAs 38个,下调miRNAs 24个(表达差异标准以上下1.5倍作为域值范围),差异倍数改变大于2倍的miRNA共有25个。
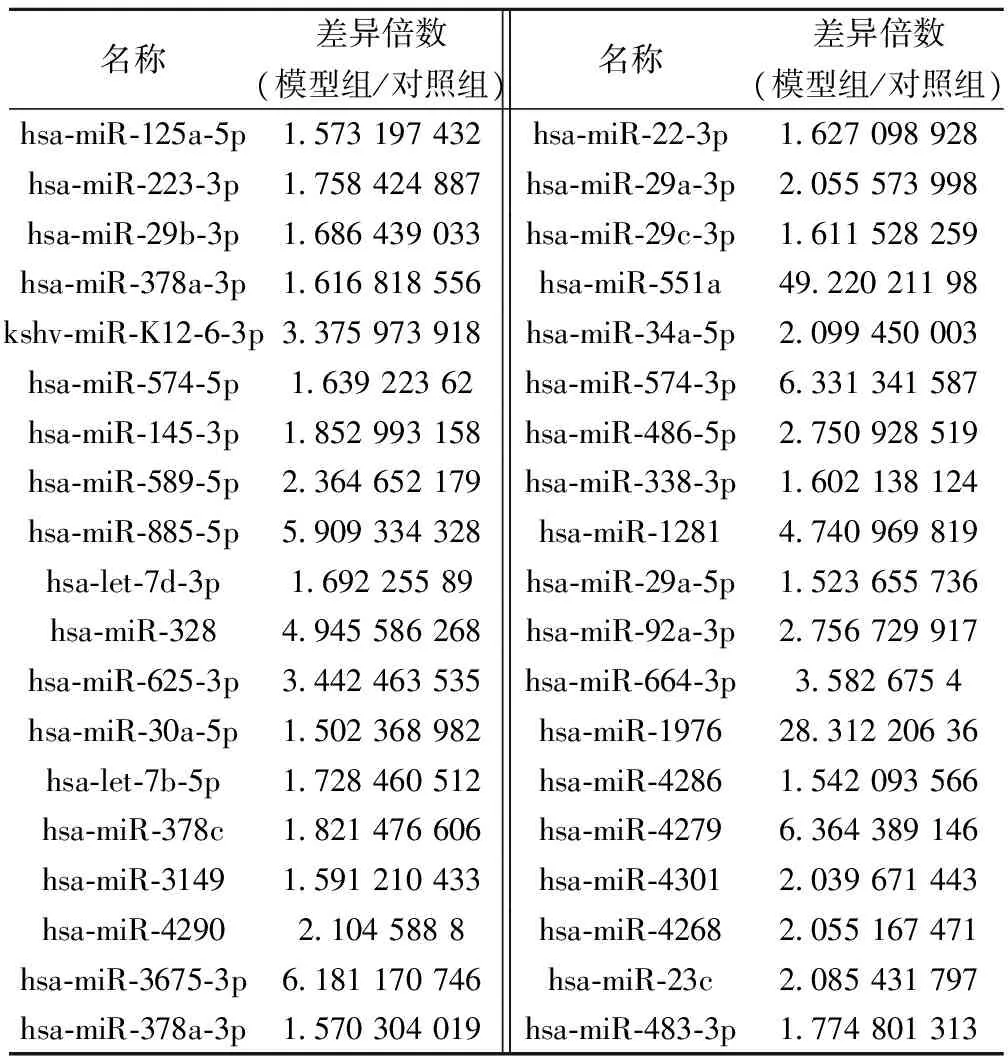
表2 模型组上调miRNAs
2.3miRNAs靶基因预测应用生物信息学方法对目前已建立相关数据库,差异表达≥2倍的miRNA调控的靶基因进行预测,基因主要涉及细胞生长、胶原纤维生长、凋亡、血管生成、细胞分化与增殖等生物学功能,见表4。

表3 模型组下调miRNAs

表4 差异表达miRNAs的主要靶基因及其功能
3 讨 论
miRNA为19~22个核苷酸的非编码小调控RNA,由具有发夹结构的前体RNA经Dicer酶加工生成,通过与mRNA的3′非翻译区互补序列的碱基配对,指导效应复合物RNA诱导的沉默复合体(RISC),通过mRNA 降解和翻译抑制两种不同机制,调控靶基因表达。miRNA参与包括细胞分裂增殖、分化发育及代谢等许多重要的生物学过程,一种miRNA可能调控多种甚至数百种蛋白质的翻译过程,多个miRNA也可能作用于同一种mRNA〔2〕。糖尿病患者外周血采用miRNA 芯片技术检测,发现特异性miRNA表达变化,提示某些miRNA参与了糖尿病的病理生理过程〔4〕。目前有关miRNA 在糖尿病肾病纤维化中的作用研究较多〔5〕,miRNA377在STZ诱导的小鼠糖尿病肾病模型、高糖及转化生长因子(TGF)-β1共培养的肾系膜细胞中表达均上升,肾系膜细胞过表达miRNA377 能增加纤维连接蛋白等细胞外基质的合成〔6〕。
本文糖尿病大鼠成模12 w后,心脏功能减退、心室扩张,心肌组织内胶原含量增多,心肌纤维化明显,为1型糖尿病大鼠心肌纤维化心肌组织miRNA表达谱的研究提供了一个可靠的模型,与对照组比较心肌组织差异表达2倍以上的miRNA有25个,其中hsa-miR-29a-3p、hsa-miR-29b-3p、hsa-miR-29c-3p、hsa-miR-126-3p、hsa-miR-208a、hsa-miR-150-5p在心脏发育、血管生成及心脏病理过程中有重要调控作用。
miR-29在心脏成纤维细胞中比在心肌细胞中表达得更多,但miR-29在梗死心脏的边界区表达下调。然而这种对立的调节通过胶原蛋白和弹性蛋白的合成依然与心肌纤维化相关〔3〕。本实验结果显示,糖尿病模型大鼠心肌组织miR-29a/b/c表达上调,但对于高糖是否直接通过miR-29影响心肌细胞肥大和心肌纤维化及miR-29所调控的确切靶基因尚需进一步确认。
MiR-208a是目前发现的另一种与心肌肥大和纤维化相关的miRNA。通过转基因在小鼠心脏中过表达miR-208a可引起心肌肥大。上调miR-208a可能通过显著抑制靶基因甲状腺素相关蛋白和肌肉抑制素这两种肌肉生长和肥大的负性调节者,从而导致心肌肥大、纤维化和心力衰竭〔7〕。本实验中糖尿病模型大鼠心肌组织miR-208a表达上调,但对于高糖是否直接通过miR-208a影响心肌细胞肥大和心肌纤维化及miR-208a所调控的确切靶基因尚需进一步确认。
循环miR-126减少在非糖尿病人群被发现是一个重要的糖尿病预测因子,从正常葡萄糖耐受,到糖耐量减低,再到糖尿病,miR-126的血浆水平逐渐下降〔8〕。本研究糖尿病模型大鼠心肌组织miR-126表达也显著下调,但miR-126与糖尿病大鼠心肌纤维化是否有关目前不知。我们前期实验在STZ制作的1型糖尿病大鼠心肌纤维化模型中,发现心肌微血管内皮细胞同时表达CD31、α-SMA,证实微血管内皮细胞发生间质转分化,通过该途径生成大量的成纤维细胞、肌纤维母细胞在心肌纤维化中发挥作用〔9〕。本实验中miR-328在糖尿病大鼠心肌纤维化中的表达上升4倍。研究发现房颤患者血清miR-328浓度明显高于正常对照,与房颤持续时间及左心房直径相关〔10〕。miR-328还可通过靶基因CD44调节小鼠肾小管上皮细胞间质转分化现象〔11〕。我们推测miR-328有可能调节心肌微血管内皮细胞间质转分化,在1型糖尿病大鼠心肌纤维化中发挥作用。 本研究利用miRBase和starBase分析软件,对差异表达的miRNA可能调控的靶基因进行初步预测,这些基因主要涉及细胞生长、胶原纤维生长、凋亡、血管生成、细胞分化与增殖等生物学功能。然而仍有大量预测靶基因及其功能需要实验加以验证,且一种miRNA可同时调节多个靶基因表达,一个靶基因又同时受多种miRNA的调控,提示miRNA参与和调控生物学功能的多样性和复杂性。本研究仅提示miRNAs可能涉及糖尿病心肌纤维化的发生和发展过程,但对于差异表达的miRNAs如何启动糖尿病心肌纤维化发生机制的问题尚有待深入研究和探讨。
1Maya L,Villarreal FJ.Diagnostic approaches for diabetic cardiomyopathy and myocardial fibrosis〔J〕.J Mol Cell Cardiol,2010;48(3):524-9.
2Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function〔J〕.Cell,2004;116(2):281-97.
3E van Rooij,Sutherland LB,Thatcher JE,etal.Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis〔J〕.PNAS,2008;105(35):13027-32.
4Zampetaki A,Kiechl S,Drozdov I,etal.Plasma microRNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes〔J〕.Circ Res,2010;107(6):810-7.
5Kato M,Natarajan R.microRNA cascade in diabetic kidney disease:big impact initiated by a small RNA〔J〕.Cell Cycle,2009;8(22):3613-4.
6Wang Q,Wang Y,Minto AW,etal.MicroRNA-377 is up-regulated and can lead to increased fibronectin production in diabetic nephropathy〔J〕.FASEB J,2008;22(12):4126-35.
7Callis TE,Pandya K,Seok HY,etal.MicroRNA208a is a regulator of cardiac hypertrophy and conduction in mice〔J〕.J Clin Invest,2009;119(9):2772-86.
8Zampetaki A,Kiechl S,Drozdov I,etal.Plasma micro-RNA proling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes〔J〕.Circ Res,2010;107(6):810-7.
9黄俊,张明霞,黄江燕,等.1型糖尿病大鼠心肌微血管内皮细胞间质转分化的鉴定〔J〕.中国老年学杂志,2015;35(23):6653-6.
10McManus DD,Lin H,Tanriverdi K,etal.Relations between circulating microRNAs and atrial fibrillation:data from the Framingham Offspring Study〔J〕.Heart Rhythm,2014;11(4):663-9.
11Chen CH,Cheng CY,Chen YC,etal.MicroRNA-328 inhibits renal tubular cell epithelial-to-mesenchymal transition by targeting the CD44 in pressure-induced renal fibrosis〔J〕,PLoS One,2014;9(6):e99802.
