螺旋型可植入式微创葡萄糖传感器中PVA/PEG复合水凝胶外膜结构与响应性能
2018-04-14解丽丽李崭虹朱志刚
陈 杨,解丽丽,陈 诚,李崭虹,潘 帅,朱志刚
(上海第二工业大学 环境与材料工程学院,上海201209)
0 引言
糖尿病是当前威胁全球人类健康最重要的慢性疾病之一,主要病因是负责分泌胰岛素的胰腺β细胞发生故障,导致无法严格控制血液中的葡萄糖水平[1]。糖尿病会诱发高血压、心血管、肾衰竭、手足坏死、神经紊乱等多种病症,对人的生命健康有极大危害[2-3]。根据国际糖尿病联盟(International Diabetes Federation,IDF)统计,预计到2030年,全球将近有5.5亿人身患糖尿病,其中在我国I型糖尿病患者总数在700~1 000万之间[4]。为了维持接近正常的血糖水平(70~120 mg/dL)[5],目前糖尿病患者广泛使用的是手持式血糖仪,每天需要数次刺破手指以获得血液样品,这种方式会给患者带来疼痛和不便,而且无法连续检测体内葡萄糖水平[6-7]。
目前研究以及市场上出售的人体血糖检测产品主要采用针形葡萄糖电极,因其易于制造和适合植入的特性而受到广泛关注[8],如Koh等[9]设计的超微孔聚氨酯涂覆的针形植入式葡萄糖传感器。但其缺点也较明显:葡萄糖氧化酶(glucose oxidase,GOD)担载量过低导致其使用寿命较短。为了解决此类问题,螺旋式葡萄糖传感器被陆续报道。例如,Yu等[10]所制作的螺旋型传感器,在体外恒定极化3个月后仍能发挥较好的功能,但在植入体内后由于排异反应而很快失去敏感性。传感器在植入后逐渐丧失功能,主要是因为植入后创口周围组织所引起的身体异物反应(foreign body reaction,FBR),包括纤维包膜和炎症反应[11]。为了提高植入式葡萄糖传感器的寿命,具有生物相容性涂层的材料被广泛选用,如二氧化硅复合材料、溶胶-凝胶法涂层、类金刚石碳薄膜、纳米多孔阳极铝膜等。研究表明,这些材料都有作为传感器外膜的潜力。葡萄糖传感器外膜必须在生物体中稳定存在以保证葡萄糖能输送到电极,减少蛋白质的淤积并尽量缓解纤维包膜。近年来,陆续有新材料被尝试用来减少上述影响,其中包括水凝胶[12]、胶原[13]或者是聚乳酸[14]作为保护涂层,或使用皮质类固醇抑制免疫反应[15]。而在众多生物材料中,水凝胶是一种类似于生命组织的材料,其表面不易黏附蛋白质和细胞,在与人体血液、细胞及组织接触时,能表现出良好的生物相容性。近期研究表明,三维网络互穿结构的水凝胶可满足植入传感器外膜的要求并在水中溶胀而不溶解[16],能极大地提高传感器在人体内的使用寿命。聚乙烯醇(PVA)是一种用途相当普遍的水溶性高分子聚合物,具有良好的抗拉强度,耐磨、绝缘性好[17];聚乙二醇(PEG)水溶性好、无毒、生物相容性好,具有广泛的应用。然而PEG基水凝胶的力学性能较差,为提高水凝胶的强度,本文将PEG接枝到PVA上,制备综合性能优良的水凝胶,从而提高传感器植入后的寿命[18]。
选用螺旋形铂铱合金电极来担载GOD,以提高植入式葡萄糖生物传感器的GOD担载量并增大工作电极的电化学活性面积。本文主要研究PVA与PEG不同配比复合水凝胶的配比对力学性能、显微结构的影响,重点考察涂覆该复合水凝胶涂层对螺旋形铂铱合金电极传感器性能的影响,并研究了传感器的抗干扰性能和长期稳定性。
1 实验部分
1.1 试剂与仪器
主要试剂与原料包括:GOD、牛血清蛋白(bovine serum albumin,BSA)、戊二醛 (glutaraldehyde,GA)、聚氨酯 (polyurethanes,PU)、抗坏血酸 (ascorbic acid,AA)、尿酸 (uric acid,UA)、多巴胺 (dopamine,DA)、果糖 (fructose,Fru)、四氢呋喃(tetrahydrofuran,THF)、十二烷基聚四氧乙烯醚(Brij30)、双组份环氧胶粘剂(Epoxy)等化学试剂均从Sigma-aldrich公司购得;聚乙烯醇(PVA 1799)、聚乙烯醇(PEG 1000)购于国药集团化学试剂有限公司;实验用水为18 MΩ·cm超纯水,磷酸盐缓冲溶液(PBS)由0.1 mol/L NaH2PO4和Na2HPO4溶液混合配制,pH值调节至7.4。
采用扫描电子显微电镜(scan electran microscope,SEM)S-4800(Hitachi,日本)观测水凝胶的形貌;采用TBR4100四通道自由基检测系统(World Precision Instruments,美国)对制备的电极进行计时电流测试;采用AG22000A万能测试仪(Shimadzu,日本)对水凝胶进行力学测试;计时电流测试需要在磁力搅拌(上海辰华仪器公司)的电解池中进行;配置的GOD需要在IKa摇床(IKa仪器公司,德国)上使其均匀混合。
1.2 实验过程
1.2.1螺旋型铂铱电极的制备
螺旋型铂铱电极的传感器结构示意图如图1所示。主要包括Pt-Ir螺旋型工作电极、GOD、半透膜、水凝胶等。取长约4~7 cm的医用级铂铱丝(Φ=0.125 mm,铂:铱=9:1),剥离去除末端1 cm左右的特氟隆涂层,在超纯水中超声处理5 min。用无水乙醇擦拭的镊子将上述铂铱丝沿着皮下注射针头(30 G)紧密盘旋缠绕5~8圈,获得外径为1 mm、内径约为0.85 mm的Pt-Ir线圈。将一小股纤维材料嵌入线圈内以提高GOD担载量。

图1 螺旋电极结构图Fig.1 Schematic diagram of the spiral-type Pt-Ir electrode
1.2.2GOD的制备与涂覆
采用经典的化学交联法,以GA做为交联剂、GOD与BSA配制成氧化酶溶液,在摇床上使其均匀混合。将上述电极垂直悬挂在可移动胶带上,用移液器取8µL酶溶液滴涂在电极上2次,滴涂时间间隔为30 min,然后将电极在室温条件下干燥1 h。
1.2.3Epoxy-PU半透膜的制备与涂覆
将4 mL THF、26.7mg PU、1mg Brij30及Epoxy按比例配制成Epoxy-PU溶液。将制备好的螺旋线圈型酶电极垂直悬挂在可移动胶带上,用移液器取适量Epoxy-PU溶液滴涂到酶电极上。将涂覆了Epoxy-PU溶液的酶电极放置在室温下干燥30 min,然后放置在80◦C恒温干燥箱中固化20 min。课题组前期的工作表明PU的最佳涂覆量为2µL[19]。固化后的电极,置于0.15 mol/L PBS缓冲溶液中,并在4◦C环境下冷藏备用。
1.2.4水凝胶的制备与包覆
首先制备含量w=10%,15%,20%的PVA水凝胶并考察其机械性能,研究发现w=10%的PVA水凝胶机械强度较弱,容易坍塌;w=20%的PVA水凝胶虽然机械强度高,但是韧性不佳;当PVA含量w=15%时,水凝胶机械性能表现最优。因此,本文选用w=15%的PVA水凝胶作为研究对象,并在此基础上设计出不同PVA和PEG配比的复合水凝胶。
将不同质量比的PVA和PEG在加热搅拌的条件下溶于一定量的超纯水,直至溶液呈透明的黏稠状,将溶液在室温下自热冷却,制备成复合水凝胶。采用4种不同的PVA和PEG的质量比,分别为2:1,3:1,4:1和5:1。利用医用注射器(15 G针头)将水凝胶溶液吸入,使针头内腔充满水凝胶,并将上述螺旋电极塞入填满水凝胶针头的内腔,然后放入冰箱冷冻12 h(−20◦C低温下),将电极取出并置于室温下解冻1 h。将包覆水凝胶的螺旋电极,置于0.15 mol/L PBS缓冲溶液中并在4◦C环境下冷藏备用。
1.2.5电化学测试
本实验采用TBR 4100电化学工作站双电极体系:其中自制的铂铱螺旋线圈电极为工作电极,Ag/AgCl丝为参比电极。在自制的聚四氟乙烯电化学反应池中,以PBS缓冲液为支持电解质,加入适量葡萄糖溶液,采用计时电流法对电极进行测试,且计时电流测试的控制电位为0.7 V。
我们将传感器的灵敏度S,µA/(mol·L−1),设定为:

其中 i1和 i2分别为 15 mmol·L−1和 5 mmol·L−1葡萄糖对应的响应电流值,c1和c2分别为15 mmol·L−1和 5 mmol·L−1葡萄糖溶液浓度值。
2 结果与讨论
如前文所述,选定PEG1000,固定水凝胶总量为15%,调节PVA与PEG的质量比分别为2:1,3:1,4:1和5:1。如图2(a)所示,当PVA与PEG质量比<4时,共混凝胶的断裂伸长率随着PVA含量的增加而增大;当PVA与PEG质量比为4时,此时断裂伸长率达到最大值259.2%;当PVA与PEG质量比>4时,共混凝胶的断裂伸长率随着PVA用量的增加而急剧减小。根据李亚东等[20]的研究,这种现象可以解释为:PVA的羟基与PEG的醚键可以形成氢键,当PVA与PEG质量比低于某一值时,单根的PEG分子链可同时与多根PVA分子链形成分子间氢键,共混凝胶可以形成相互交联的网络互穿结构;另外,PVA分子内氢键作用力的减弱可使PVA分子链间的空间增大并相应减少空间位阻,导致分子链柔顺程度增加进而提高水凝胶断裂伸长率。然而当PVA含量过高时,PEG和PVA的自聚力远远大于两者之间的氢键作用,因而发生相分离,相分离的PVA在共混水凝胶间形成了相应的力学薄弱点,从而导致了断裂伸长率下降。由图2(b)可知,随着PEG含量的增加,共混凝胶膜的拉伸强度呈下降趋势。这是由于PVA分子间及分子内氢键作用被PVA与PEG分子间氢键的相互作用所替代,减少了PVA分子间的交联点,使得PVA分子间的作用力减小。此外,PEG的分子量远低于PVA,与PVA共混降低了体系的分子链长度,从而导致拉伸强度的降低。同理,PEG含量升高导致的相分离也是造成拉伸强度降低的一个重要原因。

图2 PVA与PEG不同配比水凝胶的机械性能Fig.2 Mechanical properties of different ratios of PVA/PEG hydrogels
水凝胶外膜的结构对葡萄糖分子输运起到至关重要的作用,它可以起到筛分作用,将一些小分子(UA、AA等)过滤掉。图3为不同配比水凝胶的SEM图片,如图3(a)所示,当PVA与PEG质量比为2时,孔的直径在300~400 nm,孔径较小但大小均匀,孔隙率仅为16%;随着PVA含量的增加,孔的直径逐渐增大,当PVA与PEG质量比为3时,如图3(b)所示,孔径增大至500 nm,同时孔隙率增加为33%,孔的均匀性较差;当PVA与PEG质量比增加至4时,孔径达到最大,其尺寸在500 nm~1µm,孔径较均匀,孔隙率最高达到67%;当PVA与PEG质量比为5时,孔的直径减小至最小,仅为20 nm,孔隙率下降至18%。通过对比可知,当PVA与PEG质量比为4时,水凝胶外膜具有最合适葡萄糖分子通过的多孔结构,同时具有有效隔绝干扰物质参与反应的功效。
不同比例水凝胶涂覆前后螺旋电极的计时安培电流响应曲线如图4所示。当PVA与PEG质量比为2时,包覆了水凝胶的电极的线性度由未包覆前的0.994减少为0.958,灵敏度和最大电流变化幅度较小,分别从 12.5 µA/(mol·L−1)和 390 nA 增大至 15.5 µA/(mol·L−1)和 411 nA,该比例的水凝胶对螺旋电极性能影响较大。当PVA与PEG质量比为3时,包覆过水凝胶的电极的线性度从未包覆前的0.958变化为0.962,变化幅度较小;但其灵敏度变化较大,从未包覆前的12.6µA/(mol·L−1)下降至9.3µA/(mol·L−1),且最大电流值也有较大幅度的变化,从353 nA减小至306 nA。由此可知,包覆了该比例的水凝胶,其性能仍有较大影响。然而,当PVA与PEG质量比为4时,包覆了该比例的水凝胶对电极的性能基本无影响,其线性度、灵敏度、最大电流值分别由 0.993、8.8 µA/(mol·L−1)和 280 nA,变化为 0.997、8.7 µA/(mol·L−1)和 281 nA,两者的线性对比如图5所示,所以该比例的水凝胶最适合作为电极的外层生物膜。当PVA与PEG质量比为5时,该比例的水凝胶又对电极的性能产生了一定程度的影响,尤其是包覆了水凝胶后,其最大电流由423 nA变化至388 nA,另外2个性能指标也有些许变化。综上所述,最佳水凝胶配方为PVA与PEG质量比为4,包覆了该比例的水凝胶对螺旋电极的性能影响最小。

图3 不同配比的PVA与PEG水凝胶的SEM图片:(a)PVA/PEG=2;(b)PVA/PEG=3;(c)PVA/PEG=4;(d)PVA/PEG=5Fig.3 SEM images of different ratios of PVA/PEGhydrogels:(a)PVA/PEG=2;(b)PVA/PEG=3;(c)PVA/PEG=4;(d)PVA/PEG=5

图4 不同比例水凝胶涂覆前后螺旋电极的计时安培电流响应曲线Fig.4 Amperometric response of uncoated and different ratios of PVA/PEG hydrogels coated glucose sensors
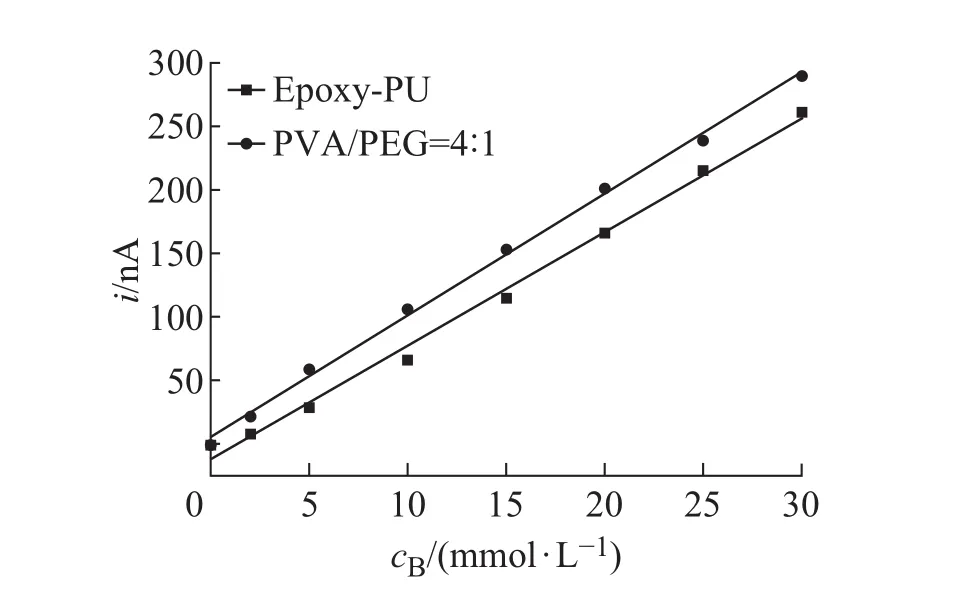
图5 未包覆水凝胶以及PVA/PEG=4水凝胶包覆过后的电极的线性图Fig.5 Linear fi tting of amperometric responsefor uncoated and PVA/PEG=4 hydrogels coated glucose sensors
本文最终选用优化后的配比和材料——2µL PU和PVA与PEG质量比为4的水凝胶涂覆螺旋电极,对其进行长期稳定性和抗干扰性测试,如图6所示。电极存放在4◦C冰箱内,每隔3 d测试1次,共测试11次,图6(a)为电极在11个周期中的计时电流响应图,在经过31 d后,响应电流仍可达到初始信号的90%以上,表明包覆的水凝胶对传感器的性能影响较小,传感器的重复性较好,可满足长期植入的要求。图6(b)为传感器的灵敏度随时间的变化,结果表明,在整个测试过程中,传感器的灵敏度的变化范围小于18%,传感器灵敏度的变化在可接受的范围。
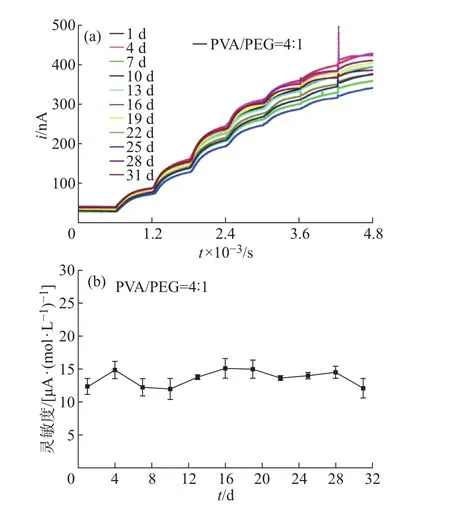
图6 PVA/PEG=4:1时:(a)电极长期稳定性测试;(b)电极的灵敏度随时间的变化Fig.6 When PVA/PEG=4:1:(a)long term stability test;(b)response of sensitivity during experimental period
水凝胶作为传感器的最外层膜起着高效选择性渗透以及阻挡一些体内电化学活性干扰物(如UA、AA、DA)的作用。本传感器的工作电位为0.7 V,在此电位下,UA、AA和DA容易被电化学氧化,产生干扰电流,从而影响传感器测试结果。考虑到人体血糖内的葡萄糖浓度至少要高于干扰物浓度30倍,将抗干扰实验设置为分别注入5 mmol/L葡萄糖、0.5 mmol/L AA、0.5 mmol/L UA、0.5 mmol/L DA以及0.5 mmol/L Fru。如图7所示,正常生理浓度范围内的AA(0.5 mmol/L),与5 mmol/L的葡萄糖相比仅仅产生较小的电流响应,值得注意的是0.5 mmol/L的DA产生的电流对传感器响应有一定程度的影响,而UA和Fru产生的电流响应几乎可以忽略不计。实验结果表明,包裹了PVA与PEG质量比为4:1的水凝胶的电极对葡萄具有较好的选择性。

图7 PVA/PEG=4:1时电极的抗干扰测试Fig.7 Anti-interference test of PVA/PEG=4:1
3 结 论
本文引入具有良好生物相容性的水凝胶作为铂铱螺旋电极的最外层膜,考察不同比例PVA/PEG对复合水凝胶力学性能以及传感器性能的影响。研究表明,当PVA与PEG质量比为4:1时,水凝胶的机械性能最佳、孔径为500 nm~1µm、孔隙率高达67%,均匀的孔径和高孔隙率在阻挡人体内电化学活性干扰物的同时,传感器的灵敏度可以调控在10µA/(mol·L−1)左右。此外,涂覆最佳复合水凝胶的电极具有良好的重复性和长期稳定性,表明所制备的传感器满足长期植入的要求。
参考文献:
[1] ZAIDI S A,SHIN J H.Recent developments in nanostructurebased electrochemical glucosesensors[J].Talanta,2016,149:30-42.
[2] WILSON G S,GIFFORD R.Biosensors for real-time in vivo measurements[J].Biosens Bioelectron,2005,20:2388-2403.
[3]ZHU Z G,GARCIA-GANCEDO L,CHEN C,et al.Enzyme-freeglucosebiosensor based on low density CNT forest grown directly on a Si/SiO2substrate[J].Sens Actuators B Chem,2013,178(3):586-592.
[4] 中华医学会糖尿病分会.中国2型防治糖尿病防治指南[J].中华糖尿病杂志,2014,6(7):447-498.
[5] LEE S,NAYAK V,DODDS J,et al.Glucose measurements with sensors and ultrasound[J].Ultrasound Med Biol,2005,31(7):971-977.
[6] DOLGIN E.Managed by machine[J].Nature,2012,485:S6-S8.
[7] CHEN C,ZHAOX L,LIZH,et al.Current and emerging technology for continuousglucosemonitoring[J].Sensors,2017,17(1):182-200.
[8] YANGQL,ATANASOV P,WILKINSE.Development of needle-type glucose sensor with high selectivity[J].Sens Actuators B Chem,1998,46(3):249-256.
[9] KOH A,LU Y,SCHOENFISCH M H.Fabrication of nitric oxide-releasing porous polyurethane membranescoated needle-type implantable glucose biosensors[J].Anal Chem,2013,85(21):10488-10494.
[10]YU BZ,JUY M,WESTL,etal.An investigation of longterm performance of minimally invasive glucose biosensors[J].Diabetes Technol Ther,2007,9(3):265-275.
[11]余江渊,李崭虹,陈诚,等.血糖监测用植入式传感器的研究进展[J].生物医学工程学杂志,2016,33(5):991-997.
[12]YU B Z,WANGCY,JU Y M,et al.Use of hydrogel coating to improve the performance of implanted glucose sensors[J].Biosens Bioelectron,2008,23:1278–1284.
[13]JU Y M,YU BZ,WESTL,et al.A novel porouscollagen scaffold around an implantable biosensor for improving biocompatibility.II.Long-term in vitro/in vivo sensitivity characteristics of sensors with NDGA-or GA-crosslinked collagen scaffolds[J].JBiomed Mater Res A,2010,92(2):650-658.
[14]KOSCHWANEZ H E,YAPF Y,KLITZMAN B,et al.In vitro and in vivo characterization of porous poly-L-lactic acid coatings for subcutaneously implanted glucose sensors[J].JBiomed Mater Res A,2008,87(3):792-807.
[15]JU Y M,YU B Z,LEIGH W,et al.A dexamethasoneloaded PLGA microspheres/collagen scaffold composite for implantable glucose sensors[J].JBiomed Mater Res A,2010,93(1):200-210.
[16]杨连利,梁国正.水凝胶在医学领域的热点研究及应用[J].材料导报,2007,21(2):112-115.
[17]胡晓华,平郑骅,朱青,等.PVA/PEG共混交联膜的渗透蒸发分离性质(Ⅰ)[J].高等学校化学学报,1998,19(4):647-651.
[18]张亚玲,杨斌,许亮鑫,等.基于动态化学的自愈性水凝胶及其在生物医用材料中的应用研究展望[J].化学学报,2013,71(4):485-492.
[19]余江渊,朱志刚,陈诚,等.基于螺旋型铂铱合金电极的植入式葡萄糖生物传感器[J].传感技术学报,2016,29(1):9-14.
[20]李亚东,胡卉,魏松,等.PVA/PEG共混流延薄膜制备与表征[J].郑州轻工业学院学报(自然科学版),2008,23(4):22-25.
简 讯
上海第二工业大学获得2018年度上海市青年科技英才扬帆计划资助
2018年度上海市青年科技英才扬帆计划评选工作已经结束。上海市科委组织,经专家网上评审、见面会考评等程序,共遴选出300人拟予资助。我校电子废弃物资源化协同创新中心王瑞雪的“分段加热条件下废弃LCD与电石渣制备复合型CMA环保型融雪剂的研究”获得立项资助,项目研究期为3年,资助金额20万元。
