嗜热脂肪芽孢杆菌木聚糖酶A的H297F定点突变、表达及酶学性质变化
2018-04-12李婵娟石慧王曼玥王婧
李婵娟,石慧,王曼玥,王婧
1(武汉设计工程学院 食品与生物科技学院,湖北 武汉,430205)2(湖北省农业科学院 农业质量标准与检测技术研究所,湖北 武汉,430064)
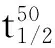
来源于Geobacillusstearothermophilus木聚糖酶最适反应温度在65~80 ℃之间,为高温木聚糖酶,在烘焙、造纸等工业领域具有应用潜力,成为热门研究对象[7]。ZHANG等人应用易错PCR结合family shuffling技术将Geobacillusstearothermophilus木聚糖酶XT6的最适反应温度从77 ℃提高到87 ℃;催化效率也提高了90%[11]。WANG等人对Geobacillusstearothermophilus木聚糖酶XynA的179位H进行饱和突变,当其突变为179F时,催化活性和热稳定性均有提高[12]。本研究采用重叠延伸PCR技术对XynA保守区内可能影响活性的位点H297定点突变为F,以期提高XynA的热稳定性和催化活性。
1 材料与方法
1.1 材料与试剂
菌种和质粒:木聚糖酶基因由本实验室从Geobacillusstearothermophilus菌株中获得并构建成重组质粒pGEX-6p-xynA,可在大肠杆菌中异源表达;大肠杆菌EscherichiacoliDH5α、BL21(DE3)均由本实验室保存。
培养基:酵母粉5 g,胰蛋白胨10 g,NaCl 10 g,溶于1 000 mL蒸馏水;液体培养基中加入1.5%琼脂粉即为固体培养基。
工具酶和生化试剂:TransStartFastPfuDNA聚合酶为北京全式金生物技术有限公司提供;限制性内切酶BamHI和XhoI、T4 DNA连接酶、DNA 分子量标准和蛋白质分子量标准购自TaKaRa 宝生物工程(大连)有限公司,AxyPrepDNA凝胶回收试剂盒和AxyPrep Plasmid Miniprep Kit购自爱思进(杭州)技术有限公司,GST-蛋白纯化试剂盒购自GE Healthcare公司(美国),蛋白质定量检测试剂盒为Beyotime公司产品;桦木木聚糖(birchwood xylan) 、氨苄青霉素、异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside, IPTG)购自Sigma 公司(美国),其他化学试剂均为国产分析纯。
1.2 仪器与设备
PCR仪,美国Biorad T100 Thermal Cycler;微量离心机,美国Thermo Heraeus Pico 17;超速冷冻离心机,美国Backman OptimeTM LE-80K;凝胶成像系统,中国CLiXN GenoSens1580;细胞破碎仪器,美国Thermo French Cell Press;酶标仪,美国Thermo Multiskan Spectrum。
1.3 方法
1.3.1XynAH297F定点突变
根据嗜热脂肪芽孢杆菌木聚糖酶XynA的核苷酸序列设计引物如下:

TC(下划线为BamHI酶切位点);

CCAA(下划线为XhoI酶切位点);
CTTGACCAT(下划线为Phe 297位点);

GGCAATTCC(下划线为Phe 297位点);
利用重叠延伸PCR法对xynA的H297位点突变为F。第一步:以构建好的pGEX-6p-xynA质粒为模板,以xynA-F/xynAH297F-R 和xynAH297F-F/xynA-R为引物分别扩增上游片段和下游片段。反应体系为50 μL:5×FastPfubuffer 10 μL,正向引物、反向引物(10 mmol/L)各1 μL,模板DNA 1 μL,FastPfuDNA聚合酶(2.5 U/μL)1 μL,dNTP(2.5 mmol/L)2 μL,补充ddH2O至50 μL。反应条件为:95 ℃预变性3 min,95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸25 s,30个循环。第二步:取上游片段和下游片段混合为模板,以xynA-F/xynA-R为引物进行全长扩增,获得含有酶切位点和突变位点的xynAH297F基因,反应体系同第一步。反应条件为95 ℃预变性3 min,95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,30个循环。以1%的琼脂糖凝胶电泳检测PCR扩增结果,凝胶回收试剂盒回收DNA片段。
1.3.2重组质粒pGEX-6p-xynAH297F的构建
用BamH I和XhoI对回收后的PCR产物进行双酶切,再回收木聚糖酶基因酶切片段,将其与相应双酶切的pGEX-6p-1质粒载体在4 ℃下酶连过夜,转化E.coliDH5α感受态细胞,构建pGEX-6p-xynAH297F重组质粒,挑选阳性克隆进行测序验证。
1.3.3XynA及XynAH297F在E.coliBL21(DE3)中的表达与纯化
将构建正确的重组质粒pGEX-6p-xynA、pGEX-6p-xynAH297F分别转化至E.coliBL21(DE3)感受态细胞中。挑选含有重组质粒的E.coliBL21(DE3)分别液体培养过夜,以1%的接种量分别转接至含100 μg/mL氨苄青霉素2 L的LB液体培养基中,37 ℃摇床培养A600达到0.6~0.7后,加入IPTG至终浓度为0.1 mmol/L,18 ℃,200 r/min诱导培养12 h。离心收集菌体,PBS悬浮后高压破碎仪破细胞,12 000 r/min,4 ℃离心30 min,收集细胞破碎液上清,按照谷胱甘肽S转移酶(glutathione S-transferase,GST)融合蛋白纯化试剂盒说明书纯化重组木聚糖酶XynA及突变体XynAH297F。根据采用5%的浓缩胶和12%的分离胶进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测分析,并根据蛋白定量检测试剂盒说明书测定蛋白浓度。
1.3.4XynA及XynAH297F酶学性质研究
采用Somogyi-Nelson 法测定木聚糖酶活性。取10 μL适量的木聚糖酶加入90 μL缓冲液配制的1%桦木木聚糖底物,一定温度下反应10 min,再加入100 μL 3,5-二硝基水杨酸(DNS)沸水浴10 min,冷却后加ddH2O定容至1 mL,再取200 μL反应液至96孔板中,酶标仪测定A540读数。
酶活单位定义(Unit): 在上述条件下,每分钟产生1 μmol木糖所需要的酶量为一个酶活力单位。
1.3.4.1XynA及XynAH297F最适pH及pH稳定性研究
最适pH:配制不同pH值的浓度为1%底物溶液(pH 4~8缓冲液为0.2 mol/LNa2HPO4/0.1 mol/L柠檬酸缓冲液;pH 8.5~10缓冲液为50 mmol/L Gly-NaOH缓冲液),按照上述酶活测定方法,以最高酶活为100%,计算不同pH条件下的相对酶活。
pH稳定性:将木聚糖酶分别置于不同pH缓冲液中,室温放置20 h后,以最适pH缓冲液配制底物测定活性,以未处理的木聚糖酶酶活为100%,计算相对酶活。
1.3.4.2XynA及XynAH297FP的最适反应温度和热稳定性研究
最适反应温度:以最适pH缓冲液配制底物,按照标准方法测定不同温度下的酶活,以最高酶活为100%,计算相对酶活。
热稳定性:将木聚糖酶分别置于60~80 ℃处理20 min,然后在最适条件下测定酶活,以未处理的木聚糖酶酶活为100%,计算相对酶活。
1.3.5XynA及XynAH297F动力学研究
以最适pH缓冲液配制一系列不同浓度梯度的木聚糖底物,酶促反应结束后,根据Lineweaver-Burk 法,通过双倒数作图,求出米氏常数Km和最大速率Vmax,而催化常数Kcat=Vmax/[E],[E]为酶浓度。
2 结果与分析
2.1 XynAH297F的定点突变
本实验采用重叠延伸PCR进行xynA的定点突变H297F。如图1所示,以xynA-F/xynAH297F-R和xynAH297F-F/xynA-R为引物分别扩增上游片段891 bp

M-DNA marker;1-引物xynAH297F-F/ xynA-R扩增产物;2-xynAH297F-F/xynA-R扩增产物;3-xynA-F/xynA-R扩增产物图1 重叠延伸PCR扩增xynAH297F基因Fig.1 XynAH297F gene amplified by overlapping extension PCR
和下游片段105 bp,第二轮PCR以xynA-F/xynA-R为引物进行全长扩增所得片段大小为996 bp,与预期一致。构建重组质粒并测序验证,将成功的突变的质粒转入E.coliBL21(DE3)中进行表达与纯化。
2.2 XynA及XynAH297F的诱导表达和纯化
将带有重组质粒pGEX-6p-xynA、 pGEX-6p-xynAH297F的E.coliBL21(DE3)分别诱导表达,破细胞后利用SDS-PAGE检测蛋白表达情况。如图2-A所示,带有空载质粒菌株诱导后只表达了26 ku的GST标签,且主要存在上清中;含有重组的pGEX-6p-xynA和pGEX-6p-xynAH297F菌株均表达了64 ku的融合蛋白,虽然主要存在沉淀中,但是上清中也存在可溶的融合蛋白。经过亲和层析、3C蛋白酶切除GST标签后,最终获得高纯度的木聚糖酶。经SDS-PAGE分析,纯化后的蛋白条带单一,且大小约为38 ku,与预期一致,说明所得蛋白即为目标蛋白。

A-XynA和XynAH297P在BL21(DE3)中的表达分析。M-蛋白质marker;1-IPTG诱导的含pGEX-6p-1的E. coliBL21(DE3)表达上清;2-IPTG诱导的含pGEX-6p-1的E. coli BL21(DE3)表达沉淀;3-IPTG诱导的含pGEX-6p-xynA的E. coliBL21(DE3)表达上清;4-IPTG诱导的含pGEX-6p-xynA的E. coliBL21(DE3)表达沉淀;5-IPTG诱导的含pGEX-6p-xynAH297F的E. coli BL21(DE3)表达上清H297P上清;6-IPTG诱导的含pGEX-6p-xynAH297F的E. coli BL21(DE3)表达上清H297P沉淀。B-M-蛋白质marker;1-纯化后的XynA;2-纯化后的XynAH297P图2 XynA和XynAH297P的表达与纯化SDS-PAGE分析Fig.2 SDS-PAGE analysis of XynA and XynAH297P
2.3 XynA和XynAH297F酶学性质
2.3.1最适反应pH和pH的稳定性研究
如图3-A所示,野生型XynA与突变体XynAH297F的最适反应pH值均为5.5,且在不同pH缓冲液中相对活性几乎相同。由图3-B可知,野生型XynA在pH 4~10的缓冲液中室温处理20h后残余活性均在90%左右;相同处理条件下,XynAH297F残余活性均在95%左右。XynA与突变体XynAH297F均具有较好的pH稳定性,且两者的pH稳定性也几乎相同。说明H297位点对该酶的最适pH和pH稳定性不起关键作用。

A-XynA和XynAH297P的最适反应pH测定; B-XynA和XynAH297P的pH稳定性研究图3 XynA和XynAH297P的最适反应pH及pH稳定性研究Fig.3 The optimum pH and pH stability of the purified XynAand XynAH297P
2.3.2XynA及XynAH297P最适反应温度及热稳定性研究
测定不同温度下XynA和XynAH297F的相对活性,如图4-A所示,XynA的最适反应温度为70 ℃;XynAH297F的最适反应温度为75 ℃,与野生型相比提高了5 ℃。分别测定XynA和XynAH297的热稳定性发现,65 ℃处理20 min后,XynA残余活性降低至80%左右,而XynAH297活性几乎不变;80℃处理20 min后,XynA的残余活性降低至10%左右,而XynAH297仍具有30%左右的残余活性,说明突变体的热稳定性优于野生型。
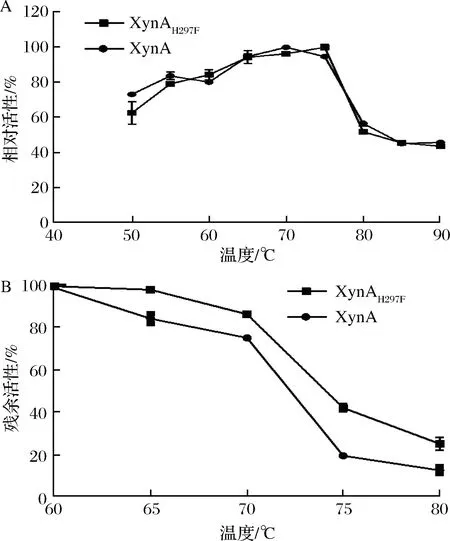
A-XynA和XynAH297P的最适反应温度;B-XynA和XynAH297P的热稳定性图4 XynA和XynAH297P的最适反应温度及热稳定性研究Fig.4 The optimum temperature and thermal stability of XynAand XynAH297P
2.4 XynA及XynAH297P的动力学参数的测定
以不同浓度的木聚糖为底物,测定XynA和XynAH297P的活性,采用双倒数作图法计算动力学参数。从表1可以看出,与重组野生型酶相比,突变体XynAH297P的Km增大,说明H297位点突变成F后导致酶对底物的亲和力下降。但突变体Vmax和Kcat均增大了1倍,说明突变后酶促催化速率增大,酶活也提高了1倍。

表1 XynA及XynAH297P的动力学参数Table 1 Kinetic parameters for XynA and XynAH297P
2.5 同源建模
Swiss-model 服务器以蛋白质结构数据(http://www.rcsb.org/pdb/home/home.do)中已经报道的GeobacillusstearothermophilusT6(IXT6; PDB code 3mui)木聚糖酶的三维结构为模板,模拟出突变型酶的三维结构模型。从图5可以看出,Glu44和Asn45是酶与底物结合的关键残基,可能与底物木四糖形成氢键。H297突变为Phe后,底物的空间位置有一定改变,可能影响Glu44和Asn45与底物的作用力,使得酶对底物的亲和力下降。另外,如图5所示,Phe取代His后侧链角度向外偏转,活性空腔变大,可能有利于产物的释放,从而增大酶促反应速率。同时,Phe的苯环结构的疏水性大于His的咪唑基团,有研究表明,引入疏水性氨基酸有利于提高木聚糖酶的热稳定性[13]。李同彪等人对黑曲霉木聚糖酶XynZF-2进行突变引入芳香族氨基酸和其他疏水性氨基酸后都明显改善了XynZF-2的热稳定性、最适反应温度等[14-15]。
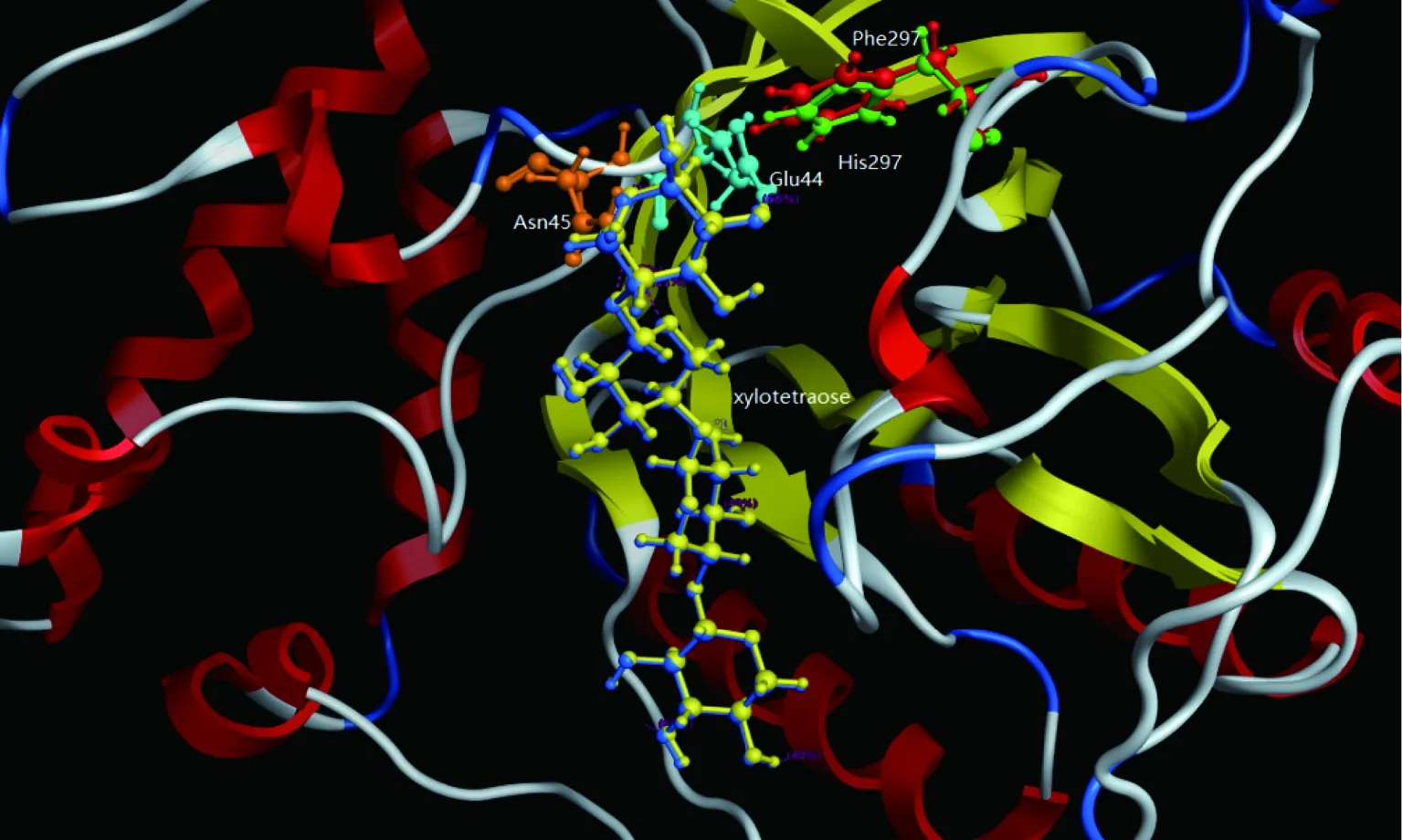
蓝色代表突变前酶蛋白结合的底物分子木四糖;黄色代表突变后酶蛋白结合的底物分子;绿色代表his297残基;红色代表突变后的Phe残基图5 利用Siwss-Model 模拟XynA及XynAH297P的结构图Fig.5 The molecular simulation of XynA and XynAH297Pby Siwss-Model
3 结论
本研究利用重叠延伸PCR对嗜热脂肪芽孢杆菌木聚糖酶XynA活性中心附近的H297位点突变为F。在大肠杆菌中异源表达并纯化相关蛋白,比较研究野生型木聚糖酶XynA和突变体XynAH297P的酶学性质发现,H297突变为F后,酶的最适pH和pH稳定性不受影响,但最适反应温度和热稳定性有所提高。F297取代H297后,酶对底物的亲和力下降,但催化反应速率有一定程度提高。本结果为木聚糖酶结构与功能关系研究提供了材料。
[1]DEUTSCHMANN R,DEKKER R F H.From plant biomass to bio-based chemical: latest developments in xylan research [J].Biotechnology Advances,2012, 30(6):1 627-1 640.
[2]MCCLEARY B V,MCKIE V A,DRAGA A,et al.Hydrolysis of wheat flour arabinoxylan, acid-debranched wheat flour arabinoxylan and arabino-xylo-oligosaccharides by β-xylanase,α-L-arabinofuranosidase and β-xylosidase[J].Carbohydrate Research,2015, 407(30):79-96.
[3] MOREIRA L R,FILHO E X.Insights into the mechanism of enzymatic hydrolysis of xylan[J].Applied Microbiology And Biotechnology.2016,100(12):5 205-5 214.
[4]CARVALHO E A,DOS SANTOSGóES L M,UETANABARO A P,et al.Thermoresistant xylanases fromTrichodermastromaticum: Application in bread making and manufacturing xylo-oligosaccharides[J].Food Chemistry,2017,221(15):1 499-1 506.
[5]DHIMAN S S,GARG G,SHARMA J,et al.Characterization of statistically produced xylanase for enrichment of fruit juice clarification process[J]. New Biotechnology,2011,28(6):746-755.
[6]WANG X,LUO H,YU W,et al.A thermostable Gloeophyllum trabeum xylanase with potential for the brewing industry[J].Food Chemistry,2016,199(15):516-523.
[7] KUMAR V,MARíN-NAVARRO J,SHUKLA P.Thermostable microbial xylanases for pulp and paper industries: trends, applications and further perspectives[J].World Journal of Microbiology & Biotechnology,2016,32(2):34-43.
[8]吴芹,胡蝶,李雪晴,等.Y13F定点突变改良米曲霉中温木聚糖酶的耐热性[J].中国生物工程杂志,2016,36(12):36-41.
[9]RULLER R,ALPONTI J,DELIBERTO L A,et al.Concommitant adaptation of a GH11 xylanase by directed evolution to create an alkali-tolerant/thermophilic enzyme[J].Protein Engineering Design & Selection,2014,27(8):255-262.
[10]DESOUZA A R,DE ARAúJO G C,ZANPHORLIN L M,et al.Engineering increased thermostability in the GH-10 endo-1,4-β-xylanase fromThermoascusaurantiacusCBMAI 756[J].International Journal of Biological Macromolecules,2016,93(Pt A):20-26.
[11]ZHANG Z G,YI Z L,PEI X Q, et al.Improving the thermostability ofGeobacillusstearothermophilusxylanase XT6 by directed evolution and site-directed mutagenesis[J]. Bioresource Technology,2010,101(23):9 272-9 278.
[12]WANG Y,FENG S,ZHAN T, et al.Improving catalytic efficiency of endo-β-1, 4-xylanase fromGeobacillusstearothermophilusby directed evolution and H179 saturation mutagenesis[J].Journal of Biotechnology,2013,168 (4):341-347.
[13]杨浩萌,姚斌,范云六.木聚糖酶分子结构与重要酶学性质关系的研究进展[J].生物工程学报,2005,21(1):6-11.
[14]李同彪,周晨妍,朱新术,等.引入疏水性氨基酸对GH11家族木聚糖酶热稳定性的影响[J].食品工业科技,2016,37(1):145-152.
[15]李同彪,周晨妍,朱新术,等.N-端二硫键及芳香族氨基酸对木聚糖酶XynZF-2热稳定性的影响[J].食品与发酵工业,2016,42(1):26-30.
