补骨脂二氢黄酮甲醚诱导HepaRG细胞损伤机制探讨
2018-04-12季宇彬孙桂波孙晓波
季宇彬,王 敏,王 姗,罗 云,孙桂波,孙晓波
(1.哈尔滨商业大学生命科学与环境科学研究中心,黑龙江 哈尔滨 150076;2.中国医学科学院药用植物研究所药理毒理中心,北京 100193)
药物性肝损伤(drug-induced liver injury, DILI)是指各种的处方药及非处方药造成的肝损伤,主要包括小分子化学物质、生物制剂、中药、天然药物、保健品和膳食补充剂[1]。目前,随着各种新药研发及临床联合用药的增多,使DILI发病率逐年增多[2]。但是其影响因素较多,临床早期症状不明显,发病具有不可预测性,近10年来,已成为最常见且最严重临床副反应,给临床用药和新药研发都造成巨大的障碍,引起了广泛的关注[3-4]。因此,解决此问题已成为研究者的重大挑战。DILI按其发病机制不同分为固有型DILI和特异质型DILI,前者与药物剂量有关,后者涉及遗传代谢因素[5]。其毒性作用机制主要涉及氧化应激、线粒体损伤、炎症反应、内质网应激等方面。HepaRG人肝细胞能表现人原代肝细胞的大部分功能,其对CYP酶的诱导和抑制作用与人原代肝细胞基本一致。有研究表明,在毒理学研究方面,其细胞毒性与原代肝细胞表现相吻合[6],而且还有异于原代肝细胞的优势,非常有希望成为人原代肝细胞的替代物。根据最近文献报道,HepaRG细胞系在用于药物诱导的肝毒性筛选方面显示出比L-02、HepG2、hiHeps、PRLs 4种肝细胞都优越的特点[7]。
线粒体是肝脏内重要的细胞器之一,是细胞生存的主要能量来源,对于细胞内能量代谢、凋亡和衰老具有重要作用,是药物作用的关键靶标,药物导致的肝细胞凋亡能改变线粒体的功能和能量状态,因此,线粒体被认为是介导肝细胞损伤和凋亡的中心环节,介导肝细胞死亡的多种途径[8]。线粒体损伤主要表现在线粒体呼吸酶活性的降低、氧自由基的增多、线粒体膜电位的降低、线粒体膜通透性增加、钙紊乱等方面。线粒体损伤导致肝细胞死亡的关键环节之一就是线粒体膜通道开放孔的开放,随后介导线粒体膜电位的降低、线粒体呼吸链及ATP合成障碍,大量离子和水等进入线粒体基质,引起基质肿胀、线粒体膜破裂、细胞色素C等促凋亡因子释放,进而激活凋亡家族蛋白引起细胞死亡[9-10]。
在我国引起DILI的前 5 类药物中,中药排在第1位。因此对于中药造成的DILI更应加强监管、预测及治疗。补骨脂是豆科植物补骨脂的干燥成熟果实,药理作用广泛,临床应用较多。补骨脂二氢黄酮甲醚是补骨脂乙醇提取物中的一种黄酮类化合物,研究表明其具有抗炎、抗肿瘤,抗氧化、神经保护、治疗哮喘及心血管疾病等方面的作用[11],药物临床开发应用价值较大。因此,我们利用HepaRG细胞对其肝毒性进行检测,并对其毒性作用机制做初步探究。
1 材料
1.1细胞HepaRG细胞购自上海冠导生物工程有限公司;HepG2细胞购自协和细胞库。
1.2药物与试剂补骨脂二氢黄酮甲醚(批号:161205),纯度99.93%,购自上海融禾医药科技发展有限公司;MTT、JC-1染料(Sigma公司);Hoechst 33342/碘化丙啶(propidiumiodide,PI)凋亡检测试剂(Invitrogen公司);乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(C0016)、ATP试剂盒(S0027)均购自碧云天公司;线粒体膜通道开放孔(mitochondrial permeability transition pore,MPTP)试剂盒(杰美GMS10095.1v.A);caspase-3活性检测试剂盒(Biovision K105-25);细胞色素C(cytochrome C,cyt C)抗体(Abcam公司);Bax抗体、Bcl-2抗体(Proteintech公司);BCA蛋白定量试剂盒、高灵敏度化学发光检测试剂盒,均购自北京康为世纪生物科技有限公司。
1.3仪器ZHJH-C1115B 型超净工作台(上海智成分析仪器制造有限公司),Heraeus BB15型二氧化碳细胞培养箱(美国Thermo Scientific),Infinite M1000型酶标仪(瑞士Tecan公司),EVOS®FL Imaging 倒置荧光显微镜(美国Life Technologies),电泳槽、转膜槽、凝胶成像仪(美国 Bio-Rad)。
2 方法
2.1补骨脂二氢黄酮甲醚对HepaRG细胞毒性作用取对数生长期的HepaRG细胞,调整细胞密度至1×108·L-1接种于96孔板,37℃、5% CO2的培养箱中培养至密度达70%~80%;分别设空白组,不同浓度药物组与细胞作用24 h后,每孔加入100 μL MTT染液(5 g·L-1溶于PBS中),37℃、5% CO2培养箱中继续培养4 h;弃上清,每孔加150 μL的 DMSO 溶液,振荡3 min,置于全自动酶标仪570 nm处测定其吸光度值,并计算其半数致死量。
2.2补骨脂二氢黄酮甲醚对HepaRG细胞死亡方式的影响药物处理方式:分别设置空白组、补骨脂二氢黄酮甲醚6.25、12.5、25 μmol·L-1剂量组,作用24 h。
2.2.1Hoechst 33342/PI染色检测药物对HepaRG细胞凋亡的影响药物处理结束后,弃上清,用PBS洗2次,加入Hoechst 33342染料,终浓度为10 g·L-1,37℃孵育15 min,弃染料,PBS洗2次,加入PI染料100 μL(5 g·L-1),37℃孵育10 min,弃染料,加100 μL PBS,置荧光显微镜下拍片。
2.2.2LDH试剂盒检测药物对HepaRG细胞坏死的影响药物处理结束后,弃上清,加入150 μL PBS稀释10倍的LDH 释放试剂,孵育1 h,静置,每孔取上清120 μL到新的96孔板中,酶标仪检测。
2.2.3Western blot检测药物对HepaRG细胞中Bax/Bcl-2蛋白的影响培养瓶接种细胞,药物处理结束后,弃上清,PBS洗1遍,加入胰蛋白酶消化后,1 500 r·min-1离心5 min收集细胞,500 μL PBS重悬细胞,3 000 r·min-1离心5 min,加入蛋白酶裂解液,以95%的功率超声1 min,4℃静置30 min,12 000 r·min-1离心30 min,取上清液。BCA定量蛋白浓度。取定量后的蛋白加5×loading buffer煮沸变性,SDS-PAGE电泳80 V分离,300 mA恒流湿转至NC膜,再用含5%脱脂奶粉的TBST封闭2 h,一抗封闭过夜,TBST清洗3次,每次15 min,二抗封闭90 min,重复TBST清洗步骤,加显色剂显影。
2.2.4caspase-3试剂盒检测药物对HepaRG细胞中caspase-3活性的影响药物处理结束后,弃上清,加入细胞裂解液,冰上孵育10 min,每孔加入2×buffer 20 μL,再每孔加入DEVD-AFC 2 μL,混匀,37℃避光孵育2 h,酶标仪400~505 nm检测。
2.3补骨脂二氢黄酮甲醚对线粒体影响
2.3.1线粒体膜电位检测试剂(JC-1)检测药物对HepaRG细胞线粒体膜电位的影响药物处理结束后,加入JC-1染料(10 g·L-1)100 μL,37 ℃避光孵育30 min,去除染料,PBS洗2次,每孔加PBS 100 μL,荧光显微镜下拍片。另取6孔板,药物处理结束后,弃上清液,PBS洗2次,加入胰酶消化后,1 500 r·min-1离心5 min收集细胞,弃上清,加JC-1染料,37℃避光孵育30 min,离心,去除染料,400 μL PBS重悬细胞,转移至96孔板,每孔100 μL,3个复孔。置酶标仪514~585 nm检测。
2.3.2ATP试剂盒检测药物对HepaRG细胞能量代谢的影响6孔板接种细胞,药物处理结束后,弃上清液,每孔加入200 μL裂解液,充分裂解后,4℃、12 000×g离心5 min,取上清,转移至96孔板,每孔60 μL,3个复孔,每孔加100 μL ATP检测工作液,并根据试剂盒做其标准曲线,酶标仪检测。
2.3.3MPTP试剂盒检测药物对HepaRG细胞线粒体膜通道的影响药物处理结束后,弃上清,加入100 μL 37 ℃预热的GENMED清理液清洗细胞,抽去清理液,加100 μL含有GENMED染色液和GENMED中和液的GENMED染色工作液(1 ∶100)到1个细胞培养孔,覆盖培养皿表面,37 ℃避光孵育20 min,抽去染色工作液,再加清理液100 μL,洗2次,再加100 μL清理液,酶标仪下,以激发波488 nm、发射波505 nm检测,并于荧光显微镜下拍照。
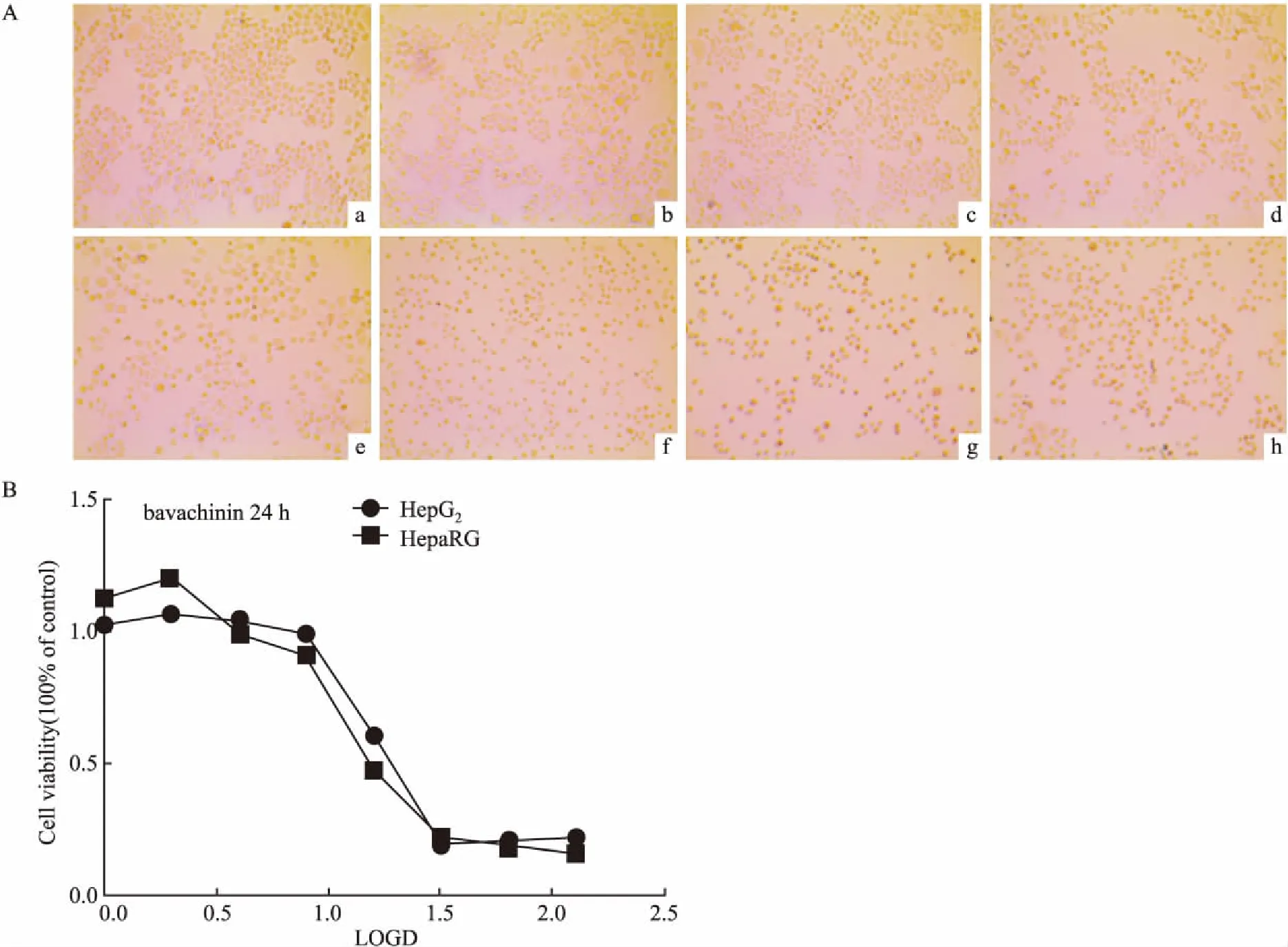
Fig1Differentconcentrations
ofbavachininfor24h

A: Cell morphology after 24h of different concentrations of bavachinin; B: 24 h toxicity curve of bavachinin. a: Control; b:bavachinin 1.5625 μmol·L-1; c:bavachinin 3.125 μmol·L-1;d:bavachinin 6.25 μmol·L-1;e:bavachinin 12.5 μmol·L-1; f:bavachinin 25 μmol·L-1; g:bavachinin 50 μmol·L-1; h:bavachinin 100 μmol·L-1
2.3.4Western blot检测药物对HepaRG细胞中cyt C蛋白的影响方法同“2.2.3”。
3 结果
3.1补骨脂二氢黄酮甲醚毒性剂量筛选结果补骨脂二氢黄酮甲醚在2种细胞中,以浓度为1.5625、3.125……100 μmol·L-1作用24 h后,MTT法检测其细胞存活率结果见Fig 1B,细胞形态见Fig 1A,正常HepaRG细胞呈现肝细胞样颗粒状上皮细胞,随药物浓度增加,细胞出现死亡,细胞形态皱缩呈圆形。计算其IC50值分别为HepaRG:11.97 μmol·L-1,HepG2:15.75 μmol·L-1。
3.2补骨脂二氢黄酮甲醚诱导细胞损伤
3.2.1补骨脂二氢黄酮甲醚对细胞凋亡的影响补骨脂二氢黄酮甲醚6.25、12.5、25 μmol·L-1作用24 h后发现,在6.25、12.5 μmol·L-1时,正常细胞呈浅蓝色荧光,而具有细胞凋亡特征细胞核表现为固缩形态或颗粒状的荧光,呈亮蓝色的细胞数量逐渐增多,此时PI染色的红色荧光并不明显,细胞以凋亡为主,但是在25 μmol·L-1时,毒性较强,细胞呈红色荧光,细胞主要表现为坏死(Fig 2)。

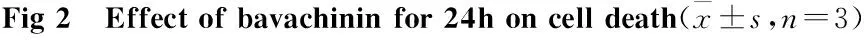
White arrow: Early apoptotic nuclei; Yellow arrow: Necrosis of the nucleus. A: Control; B: bavachinin 6.25 μmol·L-1; C:bavachinin 12.5 μmol·L-1;D: bavachinin 25 μmol·L-1; E: Quantitative analysis of apoptotic cell ratio.**P<0.01vscontrol
3.2.2LDH检测补骨脂二氢黄酮甲醚导致的细胞坏死在检测细胞凋亡的情况下,我们有对坏死指标LDH活力进行检测,发现补骨脂二氢黄酮甲醚6.25、12.5、25 μmol·L-1作用24 h后,细胞LDH活力在6.25 μmol·L-1时增加不明显,而在12.5、25 μmol·L-1时明显增加,与之前Hoechst 33342结果相吻合,在25 μmol·L-1时HepaRG细胞以坏死为主(Fig 3)。
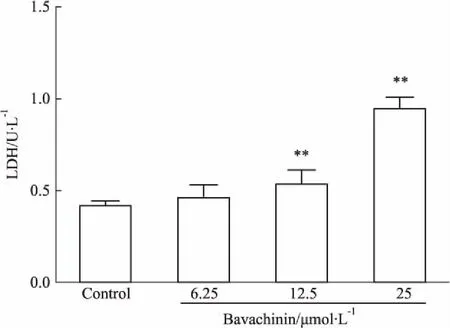
Fig 3 Effect of bavachinin for 24h on LDH leakage(±s,n=3)
**P<0.01vscontrol
3.2.3补骨脂二氢黄酮甲醚对Bax、Bcl-2蛋白的影响补骨脂二氢黄酮甲醚6.25、12.5、25 μmol·L-1作用24 h后,随药物浓度增大,Bax/Bcl-2比值不断增加(Fig 4)。

Fig 4 Effect of bavachinin for 24h on activity
A:Protein band of Bax and Bcl-2; B:Grayscale scanning Bax/Bcl-2.**P<0.01vscontrol
3.2.4补骨脂二氢黄酮甲醚对caspase-3活性的影响补骨脂二氢黄酮甲醚6.25、12.5、25 μmol·L-1作用24 h后,随药物浓度增大,caspase-3活性不断增强(Fig 5)。
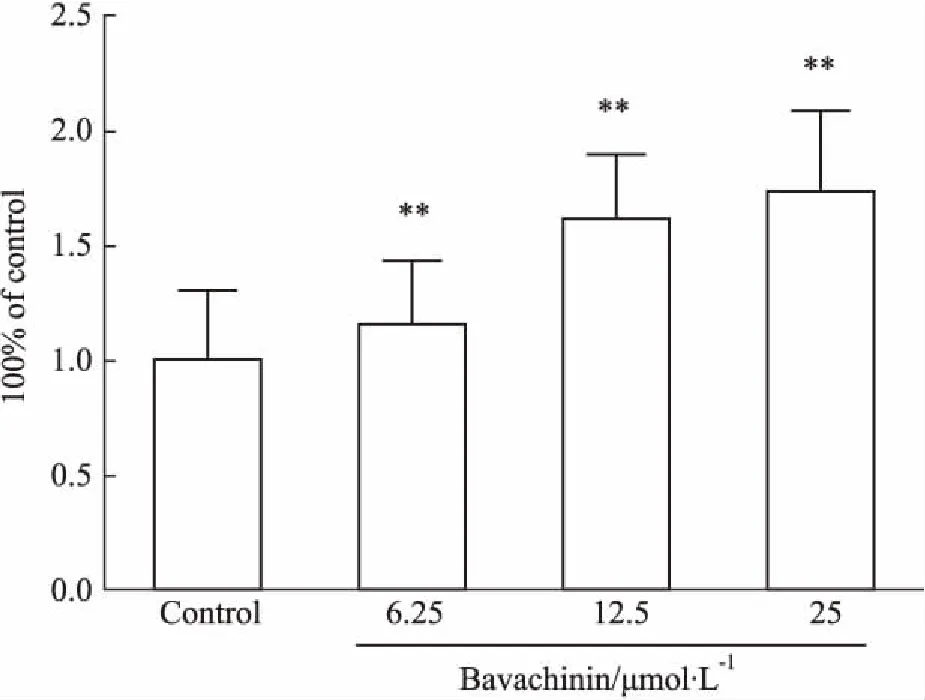
Fig 5 Effect of bavachinin for 24 h on activity
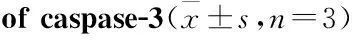
**P<0.01vscontrol
3.3补骨脂二氢黄酮甲醚对线粒体的影响
3.3.1补骨脂二氢黄酮甲醚对线粒体膜电位的影响补骨脂二氢黄酮甲醚6.25、12.5、25 μmol·L-1作用24 h后,随药物浓度增大,线粒体膜电位逐渐降低(Fig 6)。
3.3.2补骨脂二氢黄酮甲醚对细胞内ATP的影响补骨脂二氢黄酮甲醚6.25、12.5、25 μmol·L-1作用24 h后,随药物浓度的增大,细胞内ATP含量不断降低(Fig 7)。
3.3.3补骨脂二氢黄酮甲醚对细胞MPTP的影响补骨脂二氢黄酮甲醚6.25、12.5、25 μmol·L-1作用24 h后,MPTP通透性逐渐增大(Fig 8)。
3.3.4补骨脂二氢黄酮甲醚对细胞cyt C蛋白的影响Western blot检测发现,cyt C蛋白浓度随药物浓度的升高而升高(Fig 9),说明细胞死亡过程中涉及cyt C的释放,且补骨脂二氢黄酮甲醚毒性作用诱导细胞凋亡。
4 讨论
肝脏作为药物代谢的主要场所,也更容易成为药物损伤的主要器官。近年来,关于DILI的报道越来越多,且每年都呈上升趋势,但是由于其临床发病的不可预测性及早期临床症状不明显等因素,可能其发病率远大于报道[2],因此,解决这一问题尤为重要。
线粒体是多种药物作用的靶点,因而成为药物临床应用及研发的又一大障碍。有研究表明,线粒体在肝细胞损伤的早期即发生结构和功能的改变是凋亡的执行者[13]。MPTP在引起细胞的凋亡和坏死中都具有重要作用。MPTP开放初期启动细胞凋亡,使线粒体肿胀、外膜破裂、细胞色素C释放,但是随药物损伤的加剧,线粒体氧化磷酸化解偶联,其ATP的合成受阻,产生能量代谢障碍,在ATP耗竭时,细胞发生坏死[14]。根据上述实验结果我们发现,补骨脂二氢黄酮甲醚在低浓度6.25 μmol·L-1时就可以导致MPTP的开放,在此期间还伴随着线粒体膜电位的降低,ATP合成降低,细胞色素C活性增强,并且随药物浓度增加线粒体损伤加剧。对凋亡相关指标检测时发现,随药物浓度增加,Bax/ Bcl-2蛋白比例增大,caspase-3活性增强,但在高剂量25 μmol·L-1时,此时细胞虽然仍有凋亡,但主要表现为坏死。所以我们推测,补骨脂二氢黄酮甲醚导致的HepaRG细胞的凋亡和坏死,应该是通过损伤线粒体介导的,在6.25、12.5 μmol·L-1时,损伤较轻,细胞以凋亡为主,而在25 μmol·L-1时,损伤过重,细胞以坏死为主。
补骨脂由于其药理作用广泛,深受临床用药的欢迎,但是目前大量的临床及实验研究都表明补骨脂存在肝毒性,而且其成分复杂,毒性成分难以确认,是否存在药物之间的相互作用关系也尚未知晓。此外,国家食品药品监督管理总局药品评价中心对补骨脂进行的风险评估也表明,补骨脂用药风险主要为肝损伤,因此,明确其肝毒性成分,了解其毒性作用,并有效规避其毒副作用,对于提高补骨脂临床用药的安全性具有重要意义。目前针对补骨脂二氢黄酮甲醚的研究甚少,主要集中在其保护作用方面,而且其作用机制等尚不明确,因此加强对补骨脂二氢黄酮甲醚研究,对指导临床用药提高临床用药价值都具有非常重要的意义。
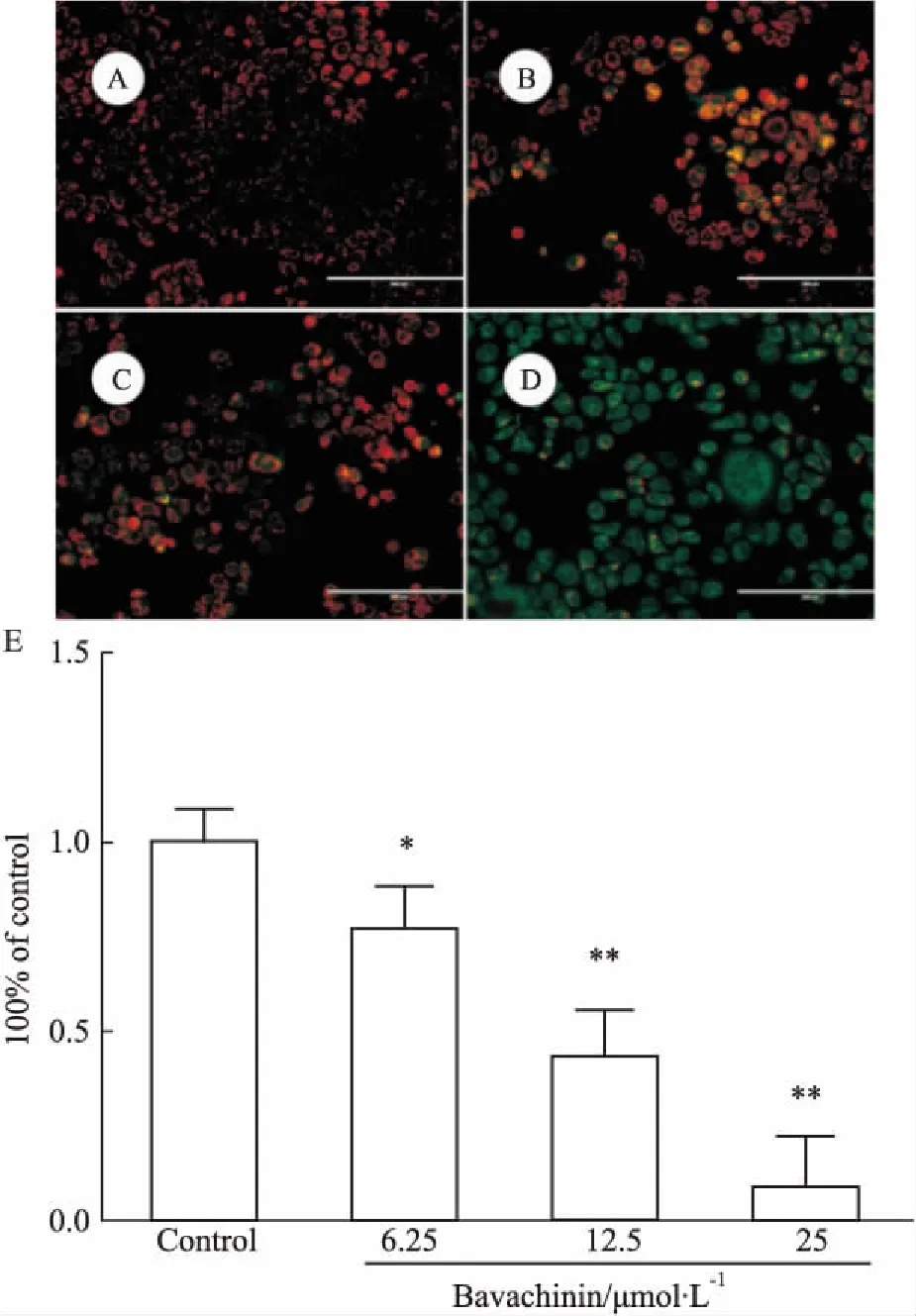
Fig 6 Effect of bavachinin treatment on mitochondrial
A: Control; B: 6.25 μmol·L-1;C: 12.5 μmol·L-1;D: 25 μmol·L-1; E: Quantitative analysis of JC-1 red/green fluorescence ratio.*P<0.5,**P<0.01vscontrol

Fig 7 Effect of bavachinin treatment on intracellular ATP
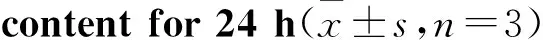
**P<0.01vscontrol
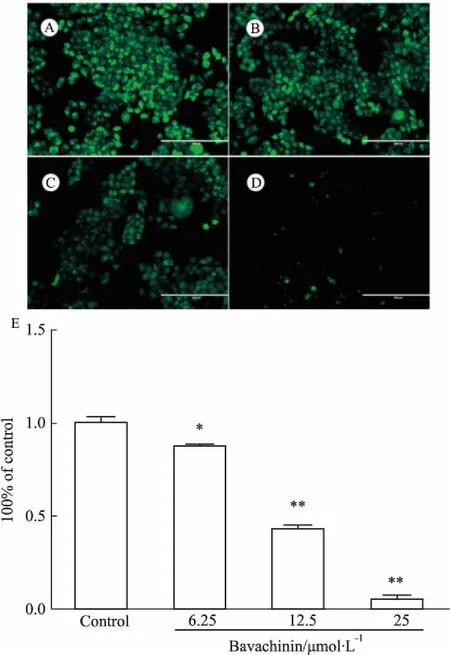
Fig 8 Effect of bavachinin on permeability of mitochondrial
A:Control; B:6.25 μmol·L-1;C:12.5 μmol·L-1; D: 25 μmol·L-1; E:Quantitative analysis of MPTP fluorescence ratio.*P<0.5,**P<0.01vscontrol
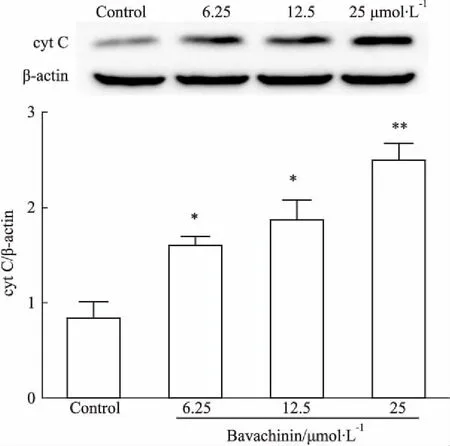
Fig 9 Effect of bavachinin for 24 h on activity
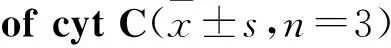
A:Cyt C and β-actin protein band; B:Grayscale scanning cyt C/β-actin.*P<0.5,**P<0.01vscontrol
[1]Yu Y C,Mao Y M,Chen C W,et al. CSH guidelines for the diagnosis and treatment of drug-induced liver injury[J].HepatolInt,2017,11(3):221-41.
[2]Tujios S,Fontana R J. Mechanisms of drug-induced liver injury: from bedside to bench[J].NatRevGastroenterolHepatol,2011,8(4):202-11.
[3]Björnsson E S,Bergmann O M,Björnsson H K,et al. Incidence,presentation,and outcomes in patients with drug-induced liver injury in the general population of Iceland[J].Gastroenterology,2013,144(7):1419-25.
[4]Miguel A,Azevedo L F,Araújo M,et al. Frequency of adverse drug reactions in hospitalized patients: a systematic review and meta-analysis[J].PharmacoepidemiolDrugSaf,2012,21(11):1139-54.
[5]王书杰,王沛,李晓天,等. 药物性肝损伤的代谢、遗传学机制[J]. 中国药理学通报,2016,32(7):898-902.
[5]Wang S J,Wang P,Li X T,et al. Metabolic and genetic mechanisms of drug-induced liver injury[J].ChinPharmacolBull,2016,32(7):898-902.
[6]蒋黎,王宇明. HepaRG细胞的生物学特点及其应用[J]. 肝脏,2010,15(5):380-3.
[6] Jiang L,Wang Y M. Biological characteristics of HepaRG cells and their application[J].ChinHepatol,2010,15(5):380-3.
[7]Wu Y,Geng X C,Wang J F,et al.The HepaRG cell line,a superiorinvitromodel to L-02,HepG2and hiHeps cell lines for assessing drug-induced liver injury[J].CellBiolToxicol,2016,32(1):37-59.
[8] Dragovic S,Vermeulen N P,Gerets H H,et al. Evidence-based selection of training compounds for use in the mechanism-based integrated prediction of drug-induced liver injury in man[J].ArchToxicol,2016,90(12):2979-3003.
[9] Kinnally K W,Peixoto P M,Ryu S Y,et al. Is mPTP the gatekeeper for necrosis,apoptosis,or both [J]?BiochimBiophysActa,2011,1813(4):616-22.
[10] 冯玥,霍璇,胡金芳,等.替芬泰对HepG2细胞的线粒体毒性[J].中国药理学通报,2017,33(9):1248-52.
[10] Feng Y,Huo X,Hu J F,et al. The mitochondrial toxicity of bentysrepinine on HepG2cells[J].ChinPharmacolBull,2017,33(9):1248-52.
[11] Zarmouh N O,Mazzio E A,Elshami F M,et al. Evaluation of the inhibitory effects of bavachinin and bavachin on human monoamine oxidases A and B[J].EvidBasedComplementAlternatMed,2015,2015:852194.
[12] 杨婷婷,江振洲,张陆勇. 经由线粒体损伤诱发的药源性肝损伤研究进展[J]. 药学进展,2014,38(11):809-18.
[12] Yang T T,Jiang Z Z,Zhang L Y. Research progress in drug-induced liver injury via mitochondrial damage[J].ProgPharmSci,2014,38(11): 809-18.
[13] Nagley P,Higgins G C,Atkin J D,et al. Multifaceted deaths orchestrated by mitochondria in neurons [J].BiochimBiophysActa,2010,1802(1):167-85.
[14] Kon K,Kim J S,Jaeschke H. Mitochondrial permeability transition in acetaminophen-induced necrosis and apoptosis of cultured mouse hepatocytes[J].Hepatology,2004,40(5):1170-9.
