腺苷对肝癌细胞自噬和增殖的作用
2018-04-12蒲泽锦周小涛李国平詹浩炼郭益添项梦琦刘丽璇吴灵飞
蒲泽锦, 周小涛, 李国平, 詹浩炼, 郭益添, 项梦琦, 刘丽璇, 谭 辉, 吴灵飞
(汕头大学医学院第二附属医院 1.消化内科、2.放射科,广东 汕头 515041)
肝癌为世界范围内发病率居男性第6位、女性第7位的常见肿瘤,在所有癌症相关性死亡中占第3位,在东亚和东南亚发病率高,在高收入的国家发病率偏低,我国肝癌发病和死亡病例数约占全世界一半左右[1-2]。单一、早期小肝癌可手术切除,不幸的是绝大多数肝癌发现时已经为巨大的晚期肝癌,多有侵袭转移,失去了手术机会,预后很差。化疗在目前仍是一种常用的肝癌治疗方法,但化疗药实际使用效果并不理想,病人的生存期短。在影响化疗药物的因素中,自噬的作用受到广泛的关注。
自噬是依赖溶酶体水解细胞内有害物质的过程,包括微自噬、巨自噬和分子伴侣介导的自噬。通过溶酶体膜或其他细胞器膜包裹需要降解的底物,或分子伴侣与底物结合后,再与溶酶体结合,最后在溶酶体内将底物降解。降解后产生氨基酸、游离脂肪酸等物质,有利于细胞过度缺氧或饥饿引起的不利环境[3]。自噬改变了肝癌细胞的生存能力,影响了肝癌细胞对化疗药物的反应敏感性[4-6]。
腺苷是一种嘌呤核苷,与相应的4种腺苷受体A1、A2A、A2B、A3结合而发挥作用。腺苷在细胞外以低浓度持续存在,在炎症或癌症等代谢应激下浓度明显增加,通过减少组织能量消耗,清除细胞内有害物质,腺苷施加了保护性效果。有研究显示,在实体肿瘤细胞外液中腺苷浓度增加10~20倍,腺苷可调节单核巨噬细胞,抑制炎症因子如白介素-12的释放,有利于肿瘤细胞生长和转移[7]。腺苷诱导肝癌细胞凋亡,也可通过降低甲基化激活p53和线粒体相关凋亡通路,引起肝癌细胞凋亡[9],但腺苷是否引起肝癌细胞内自噬水平变化目前尚未见相关报道。
1 材料与方法
1.1 材料
1.1.1细胞HepG2细胞购自中科院上海细胞库。
1.1.2试剂DMEM培养基购自Gibco公司;腺苷、单丹(磺)酰戊二胺(monodansylcadaverine, MDC)、DMSO、LC3B兔多抗购自Sigma公司;β-tubulin鼠单抗购自Abcam公司;山羊抗兔IgG(H+L)、山羊抗小鼠IgG(H+L)购自Jackson公司;预染蛋白Marker购自Thermo公司;BCA蛋白定量试剂盒购自上海生工;ECL化学发光底物检测试剂盒购自Millipore公司;CCK-8试剂盒购自日本同仁化学研究所。
1.1.3仪器生物倒置光学显微镜、生物正置荧光显微镜购自Olympus公司;酶标仪购自Thermo公司;电泳仪、垂直电泳槽、湿转转膜槽购自Bio-Rad公司。
1.2细胞培养HepG2细胞用含10%胎牛血清的DMEM培养液重悬后,转至细胞培养皿,加入10 mL含10%胎牛血清的DMEM培养液,吹打混匀细胞;培养皿放于二氧化碳培养箱中,37℃、5% CO2条件下培养,次日进行换液。每1~2 d换1次培养基,细胞铺满95%培养皿时用质量浓度为0.25 g·L-1的胰蛋白酶消化传代。
1.3CCK-8检测腺苷对HepG2细胞增殖的影响按2×103个/孔将对数期细胞接种于96孔板。待细胞贴壁后,吸去培养液,分别加入含不同浓度腺苷(0、1.0、2.0、3.0、4.0 mmol·L-1)的10%胎牛血清DMEM培养液,使用CCK-8检测试剂盒,检测细胞增殖情况,选择观察时间点分别为0、12、24、48 h。每组实验重复3次。
1.4Westernblot检测LC3表达按5×105个/孔将对数期细胞接种于6孔板。待细胞贴壁后,吸去培养液,分别加入含有不同浓度腺苷(0.2、0.5、1.0、2.0、4.0 mmol·L-1)的10%胎牛血清DMEM培养液,继续培养24 h后收集细胞;或者加入1 mmol·L-1腺苷后,于0、6、12、24 h收集细胞。裂解细胞,4℃、13 000 r·min-1离心30 min,吸取上清液,测定总蛋白浓度,水浴煮沸变性5 min。配制12%分离胶和5%浓缩胶,按每孔10 μg总蛋白量进行上样,SDS-PAGE电泳,转膜,TBST室温封闭30 min。加入LC3B兔多抗和β-tubulin鼠单抗,4℃孵育过夜。TBST洗膜5次,添加二抗,37℃室温摇晃孵育40 min,TBST洗膜5次,ECL发光液处理后胶片曝光、显影、定影。每组实验重复3次。
1.5MDC染色观察自噬体形成待细胞处于对数期,胰酶消化收集细胞并计数,将免洗爬片置于24孔培养板中,按5×104个/孔细胞数量接种于24孔板。加入腺苷(1.0 mmol·L-1)后,于0、6、12、24 h加入MDC染色液,37℃避光孵育30 min。PBS漂洗2次,取载玻片并滴加少量抗荧光猝灭剂,荧光显微镜观察拍照。每组实验重复3次。

2 结果
2.1不同浓度腺苷作用不同时间对HepG2细胞增殖的影响腺苷(1.0~4.0 mmol·L-1)作用于HepG2细胞,在0~48 h进行检测。如Tab 1所示,腺苷处理组与未添加腺苷组相比较,细胞增殖均受到明显抑制(P<0.01);腺苷(2.0、3.0、4.0 mmol·L-1)抑制细胞增殖组间差异无显著性,1.0 mmol·L-1与2.0~4.0 mmol·L-1腺苷在作用于细胞48 h后,抑制细胞增殖有明显差异(P<0.01)。
2.2不同浓度腺苷对HepG2细胞自噬的影响如Fig 1所示,腺苷处理HepG2细胞24 h,与未加腺苷组相比,腺苷(0.2、0.5、1.0 mmol·L-1)均引起细胞内LC3-Ⅱ/LC3-Ⅰ比值明显降低,1.0 mmol·L-1浓度的腺苷引起细胞内LC3-Ⅱ/LC3-Ⅰ比值最低(P<0.01),4.0 mmol·L-1腺苷引起HepG2细胞内自噬增强(P<0.05)。
2.3腺苷作用于HepG2细胞后不同时间点自噬的变化1.0 mmol·L-1浓度的腺苷作用于HepG2
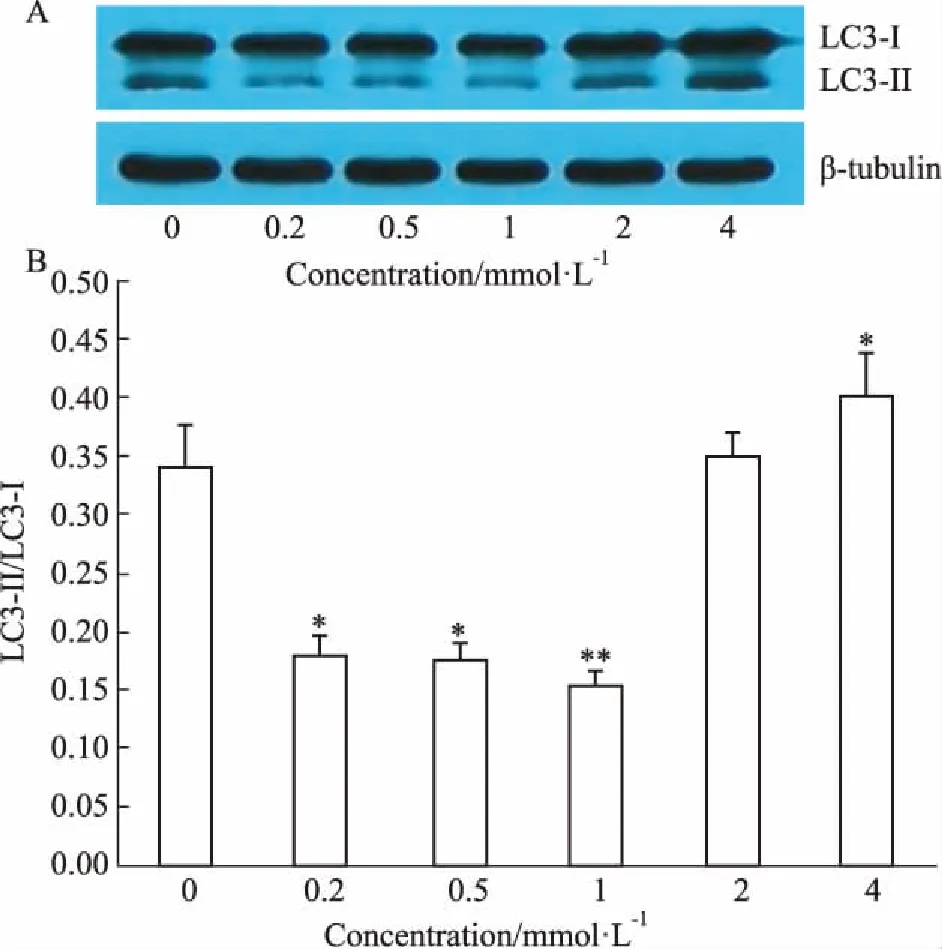
Fig 1 Effect of adenosine on autophagy in HepG2 cells (±s, n=3)
A: Western blot showed LC3-Ⅱ and LC3-Ⅰ expression in HepG2 cells incubated with adenosine (0.2, 0.5, 1.0, 2.0, 4.0 mmol·L-1) for 24 h; B: Quantitative analysis of the ratio of LC3-Ⅱ/LC3-Ⅰ.*P<0.05,**P<0.01vs0 mmol·L-1group.

Tab 1 Effect of adenosine on viability of HepG2 cells in 48-hour period(±s, n=3)
**P<0.01vscontrol;##P<0.01vs1 mmol·L-1adenosine
细胞后,在0~24 h细胞自噬的变化结果见Fig 2所示,腺苷引起细胞内LC3-Ⅱ/LC3-Ⅰ比值明显降低,在12 h最低(P<0.01)。
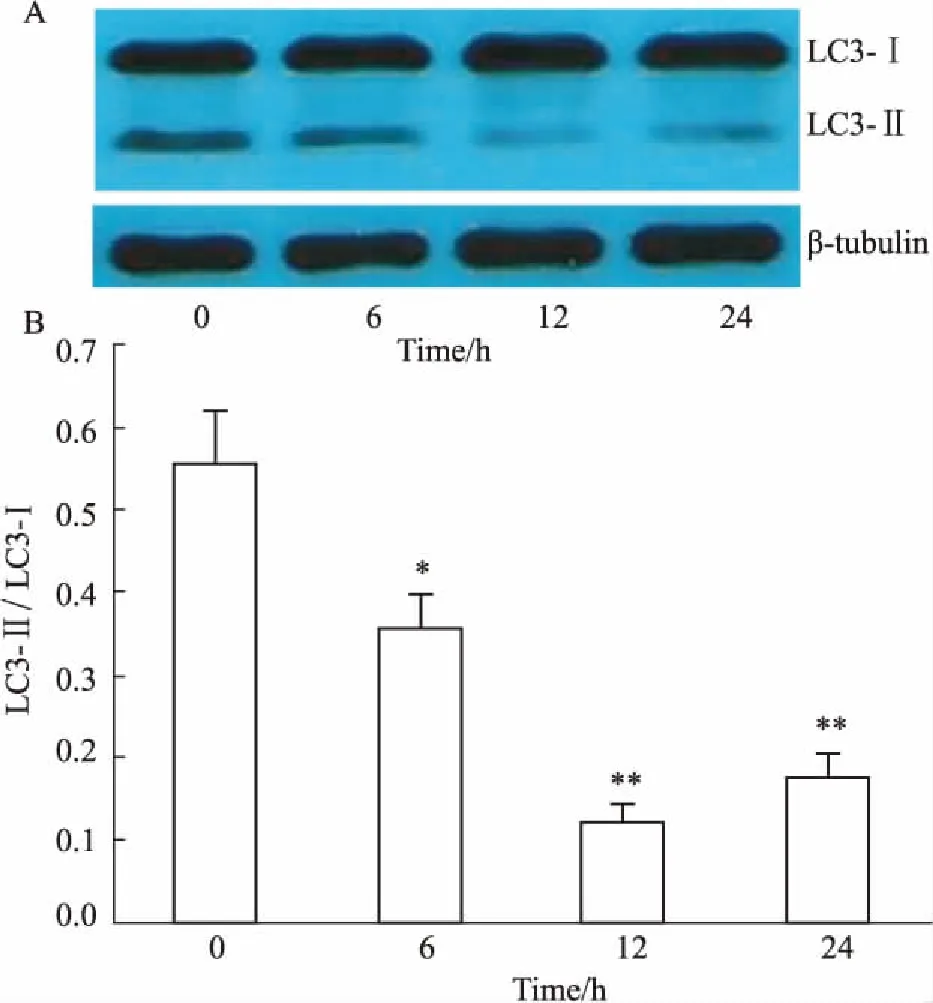
Fig 2 Effect of adenosine (1.0 mmol·L-1) on autophagy in HepG2 cells in 24-hour period(±s, n=3)
A: Western blot assay showed LC3-Ⅱ and LC3-Ⅰ expression in HepG2 cells; B: Quantitative analysis of the ratio of LC3-Ⅱ/LC3-Ⅰ.*P<0.05,**P<0.01vs0 h group.
2.4腺苷对HepG2细胞内自噬体形成的影响1.0 mmol·L-1浓度的腺苷作用于HepG2细胞,在0、6、12、24 h MDC染色检测细胞内自噬体。Fig 3结果显示,腺苷作用使自噬体减少,在12 h细胞内自噬体基本消失,24 h可出现极少量自噬体。
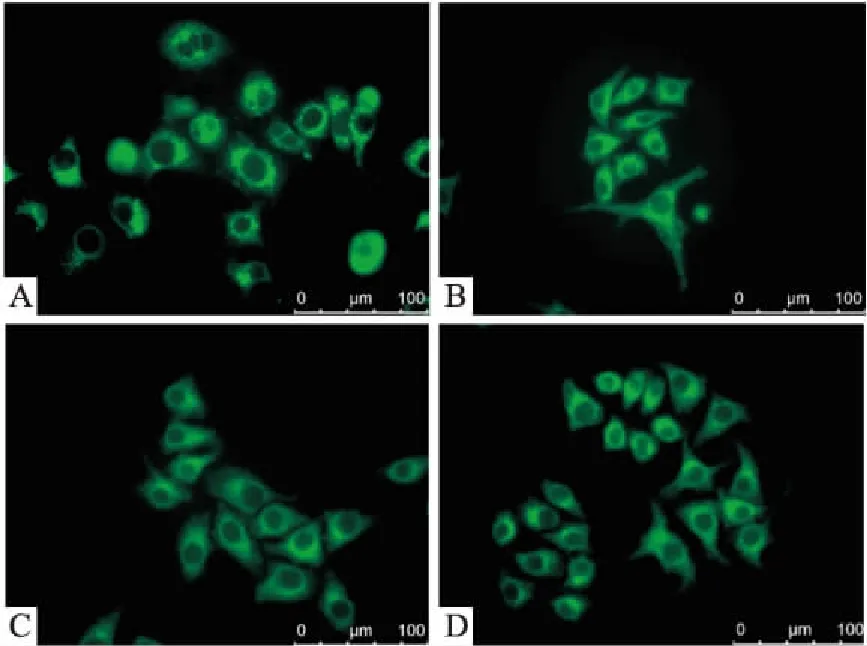
Fig 3 Autophagosomes reduced by adenosine (1.0 mmol·L-1) in HepG2 cells showed by MDC
A: Autophagosomes at 0 h; B: Autophagosomes at 6 h; C: Autophagosomes at 12 h; D: Autophagosomes at 24 h. In 24 h period, minimal autophagosomes were observed at 12 h detecting point.
3 讨论
自噬是细胞内溶酶体参与分解未折叠蛋白或处理变异蛋白的一个过程,形态学上以形成自噬体为特征,近年来关于多种组织中自噬的研究快速发展。评估自噬反应,主要通过免疫印迹测定脂化的微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)和显微镜下观察荧光自噬小体的方法。在营养物质如氨基酸缺乏的饥饿环境等应激条件下,存在于细胞质中的LC3-Ⅰ蛋白被清除,脂化成LC3-Ⅱ,嵌入吞噬泡膜中,因此,小分子LC3-Ⅱ蛋白增多和LC3-Ⅱ/LC3-Ⅰ比值增大是自噬增加的明显标志[3]。自噬体为双层或多层膜包被的圆形或椭圆形结构,内含细胞质、变异蛋白质、损伤的细胞器等,可被嗜酸性染色剂MDC染色,在荧光显微镜下可见核周区域和其他部位细胞质阳性显色。
腺苷在体内可发挥抗肿瘤作用的环节较多,可通过与腺苷受体结合直接诱导肿瘤凋亡[10],也可通过转化为环磷酸腺苷(cAMP)和其他磷酸化腺苷等途径,影响肿瘤细胞凋亡或转移[11]。既往课题组研究发现,腺苷通过去甲基化方式和影响内质网应激途径诱导肝癌细胞凋亡[8-9]。本实验发现,腺苷抑制细胞增殖活力,增大腺苷浓度,肝癌细胞的增殖被抑制程度并非同等地增强,1.0 mmol·L-1浓度的腺苷能有效抑制肝癌细胞增殖,但实验也发现时间延长到48 h,增大腺苷浓度(2~4 mmol·L-1)能更有效地抑制肝癌细胞增殖。低浓度的腺苷(不超过1.0 mmol·L-1)抑制肝癌细胞内自噬,加大腺苷浓度至4.0 mmol·L-1,细胞自噬活动反而增强。低浓度腺苷在作用于肝癌细胞12 h后抑制自噬最为明显,MDC染色也显示此时自噬体明显减少,其后自噬体再次增多,自噬功能有恢复迹象。这也反映出腺苷在体内参与核苷酸代谢,腺苷可能被细胞利用合成腺嘌呤核苷酸,参与能量代谢或其他生理过程,腺苷被消耗,失去了自噬抑制功能。
自噬对肿瘤具有双重作用机制,早期自噬通过对未折叠或变性蛋白的清除以清除肿瘤细胞,抑制自噬则有利于肿瘤生长[12-13]。也有文献显示,抑制自噬可促进肿瘤细胞凋亡,如增强自噬则减少肿瘤细胞凋亡,削弱抗癌药物效果[14-15,5]。进展期肿瘤组织中细胞快速增殖,血供相对缺乏,在缺氧和营养不足的应激条件下,自噬被大量活化,降解未折叠蛋白或变性蛋白,使得肿瘤细胞存活能力增强,凋亡减少。许多抗肿瘤药物在诱导肿瘤细胞凋亡的同时,也引起肿瘤细胞自噬增加,联合运用自噬抑制剂可增强药物治疗效果[14,4]。腺苷诱导肝癌细胞凋亡,本实验结果显示低浓度的腺苷在抑制肿瘤细胞增殖同时,还降低肝癌细胞内自噬,可以设想当与其他抗肝癌药物联用后,更有利于发挥协同抗癌效果。
总之,本研究提示抗肿瘤药物腺苷不仅抑制肝癌细胞增殖,同时可影响肝癌细胞内的自噬,低浓度腺苷可有效抑制自噬,增加腺苷的浓度并不伴随着细胞自噬抑制加强,高浓度腺苷能诱导自噬增强。迄今的化疗药物对肝癌细胞并不敏感,腺苷不仅可以通过自身诱导肝癌细胞凋亡和抑制细胞增殖而发挥抗肿瘤作用,而且可以通过调节细胞内自噬反应程度,增强其他抗肝癌药物的治疗效果,是一种有希望的肝癌化疗药物。
(致谢:本研究在汕头大学医学院中心实验室完成,在此致以由衷的感谢!)
参考文献:
[1]Bosetti C, Turati F, La Vecchia C. Hepatocellular carcinoma epidemiology [J].BestPractResClinGastroenterol, 2014,28(5): 753-70.
[2]Shen Y, Guo H, Wu T, et al. Lower education and household income contribute to advanced disease, less treatment received and poorer prognosis in patients with hepatocellular carcinoma [J].JCancer, 2017,8(15): 3070-7.
[3]Wang A L, Boulton M E, Dunn W A Jr, et al. Using LC3 to monitor autophagy flux in the retinal pigment epithelium [J].Autophagy, 2009,5(8): 1190-3.
[4]Rong L W, Wang R X, Zheng X L, et al. Combination of wogonin and sorafenib effectively kills human hepatocellular carcinoma cells through apoptosis potentiation and autophagy inhibition [J].OncolLett, 2017,13(6): 5028-34.
[5]Liu J, Ren H, Liu B, et al. Diosmetin inhibits cell viability and induces apoptosis by regulating autophagy via the mammalian target of rapamycin pathway in hepatocellular carcinoma HepG2 cells [J].OncolLett, 2016,12(6): 4385-92.
[6]Li P, Du Q, Cao Z, et al. Interferon-gamma induces autophagy with growth inhibition and cell death in human hepatocellular carcinoma (HCC) cells through interferon-regulatory factor-1 (IRF-1) [J].CancerLett, 2012,314(2):213-22.
[7]Kumar V. Adenosine as an endogenous immunoregulator in cancer pathogenesis: where to go[J].PurinergicSignal, 2013,9(2): 145-65.
[8]Wu L F, Guo Y T, Zhang Q H, et al. Enhanced antitumor effects of adenoviral-mediated siRNA against GRP78 gene on adenosine-induced apoptosis in human hepatoma HepG2 cells [J].IntJMolSci, 2014,15(1): 525-44.
[9]项梦琦, 刘丽璇, 邓巍, 等.去甲基化机制在腺苷及同型半胱氨酸诱导肝癌HepG2细胞凋亡中的作用 [J]. 中国药理学通报, 2014,30(7): 973-9.
[9]Xiang M Q, Liu L X, Deng W, et al. Effect of demethylation on adenosine and homocysteine- induced apoptosis in HepG2 cells [J].ChinPharmacolBull, 2014,30(7): 973-9.
[10] Sheth S, Brito R, Mukherjea D, et al. Adenosine receptors: expression, function and regulation [J].IntJMolSci, 2014,15(2): 2024-52.
[11] Song R, Yang B, Gao X, et al. Cyclic adenosine monophosphate response element-binding protein transcriptionally regulates CHCHD2 associated with the molecular pathogenesis of hepatocellularcarcinoma [J].MolMedRep, 2015,11(6): 4053-62.
[12] 李赫宁, 李兰芳, 陈临溪. 内质网自噬——疾病防治的新靶标 [J]. 中国药理学通报, 2015,31(3): 302-8.
[12] Li H N, Li L F, Chen L X. Reticulophagy-a new target for diseases prevention and treatment [J].ChinPharmacolBull, 2015,31(3): 302-8.
[13] 赵林, 吴鹏, 章平贵, 等. 雷公藤甲素对人结肠癌HCT116细胞增殖、自噬和凋亡的影响 [J]. 中国药理学通报, 2016,32(10): 1399-404.
[13] Zhao L, Wu P, Zhang P G, et al. Effect of triptolide on human colorectal cancer HCT116 cell proliferation, autophagy and apoptosis [J].ChinPharmacolBull, 2016,32(10):1399-404.
[14] Xia T, Wang J, Wang Y, et al. Inhibition of autophagy potentiates anticancer property of 20(S)-ginsenoside Rh2 by promoting mitochondria-dependent apoptosis in human acute lymphoblastic leukaemia cells [J].Oncotarget, 2016,7(19):27336-49.
[15] Guo X L, Li D, Sun K, et al. Inhibition of autophagy enhances anticancer effects of bevacizumab in hepatocarcinoma [J].JMolMed(Berl), 2013,91(4):473-83.
