Cdk5介导的凋亡与自噬交互作用对脑缺血的调控
2018-04-12周小江陈乃宏
刘 芳,周小江,陈乃宏,3
(1. 湖南中医药大学药学院,2. 湖南省中药饮片标准化及功能工程技术研究中心,湖南 长沙 410208;3. 中国医学科学院药物研究所,北京协和医学院药物研究所,北京 100050)
脑缺血是一类重要的中枢神经系统疾病,是指突发的脑组织局部供血不足或停止供血、供氧、供糖等,使该局部脑组织崩解破坏,进而产生神经功能障碍的一种脑血管疾病。在全球人口老龄化趋势日益加速的环境下,脑缺血的危害日益突出,发病者约30%死亡,而70%的生存者有偏瘫、失语等残障,给家庭和社会带来沉重负担[1]。从缺血发生到神经细胞死亡虽然极为短暂,但是却需要经历“漫长”且“复杂”的生化代谢和细胞间信号传递、转导,这个“漫长”的进程为我们提供了可能并可以被干预的机会[2]。因此,探明错综复杂的脑缺血损伤分子机制和其引发的信号传导过程,寻找合适的调控脑缺血损伤后神经元保护的作用靶点对该病的防治具有重要意义。
随着现代免疫学和分子生物学的迅速发展,认为脑缺血损伤的病理生理机制是一个快速级联反应过程[3],包括能量障碍、神经兴奋性毒性、脑内炎症和程序性细胞死亡等多种分子、细胞事件,其中程序性细胞死亡包括凋亡和自噬两种途径。脑缺血一旦发生,脑内能量将很快被耗竭,神经细胞程序性死亡迅速发生,凋亡和自噬途径被激活[4],并参与神经元的损伤过程,具体调控机制受到科研工作者们的广泛关注。本文将重点讨论细胞周期素依赖性蛋白激酶5(cyclin-dependent protein kinase 5, Cdk5)介导的凋亡与自噬交互作用对脑缺血进程的调控。
1 Cdk5介导的凋亡与自噬对脑缺血的调控
Cdk5作为一种主要在神经元内表达的脯氨酸限定的丝/苏氨酸蛋白激酶,在调控神经元分化、皮质的形成、神经元细胞的迁移和神经轴突的生长过程中至关重要,具有潜在的调控神经元功能[5]。1999年,Patrick等[6]发现p35在钙激活性蛋白酶水解作用下裂解成p25,继而导致Cdk5长期连续不可调控性激活,从而加速神经元损伤。由于Cdk5广泛且复杂的生理作用,部分脑缺血病的研究者们也一直关注Cdk5,如采用局限性脑缺血模型和缺氧处理的神经细胞模型等进行研究,发现Cdk5活性和p25表达增加与海马神经细胞凋亡有关[7]。最新研究亦表明[8-9],采用Cdk5抑制剂能降低局灶性缺血新生大鼠中半胱氨酸天冬氨酸蛋白酶3 (caspase-3)的表达、成年缺血性中风大鼠模型中的细胞凋亡率,进一步证实了Cdk5信号通路对脑缺血后神经元凋亡调控的关键作用。本课题组前期研究在局灶性脑缺血大鼠模型中,同样发现Cdk5表达异常,证实了Cdk5信号途径对脑缺血后神经元凋亡调控的重要性[10],且最近研究结果表明,凋亡相关蛋白caspase-3、Bax/Bcl-2的表达也相应增加,提示脑缺血后神经细胞的凋亡与Cdk5的异常活化具有一定的关联性。
由于缺血性脑损伤的原发性和继发性分子机制十分复杂,凋亡并非决定细胞死亡命运的唯一途径,脑缺血还能激活Ⅱ型程序性细胞死亡途径——自噬,它是一种细胞利用自身溶酶体途径降解细胞生物大分子、细胞器或病原微生物的过程[11]。近年研究表明,在神经退行性疾病中Cdk5与自噬间也具有关联性,如Su等[12]发现Cdk5的异常活化将诱导自噬活性增加,从而加重神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的神经毒性和突触核蛋白的聚集,采用Cdk5抑制剂则可有效阻断这一途径;Cdk5还可通过磷酸化多种底物,如介导Raf激酶抑制剂蛋白的磷酸化[13]和吞蛋白B1磷酸化[14],或通过内质网应激途径有效调控神经元死亡[15],证实了Cdk5是自噬发生的关键调控子,且其底物具有多样性。综上,Cdk5作为神经元调控的关键上游蛋白,对凋亡和自噬均具有重要意义。
2 凋亡与自噬及其交互作用对脑缺血的调控
尽管自噬与凋亡在代谢途径和形态学方面存在明显区别,但它们的信号通路却有着千丝万缕的联系,二者之间存在多种信号交互方式,如合作、对抗、协作等[16]。合作方式表现为二者的调控目标都是促进细胞死亡;对抗关系中,二者的目标及过程背道而驰,自噬并不引发细胞死亡,相反促进细胞存活。无论何种关系,凋亡与自噬之间必须通过二者的共享调节子如Bcl-2家族蛋白、caspase等进行搭桥串话,双向调节。大量研究报道了凋亡与自噬对脑缺血的调控。然而,因实验资料的不同,尚存在两种不同的观点:① 激活自噬加速神经元的凋亡[17-18]。研究者们通过对自噬标志性蛋白LC3- II/Beclin-1的研究发现,自噬的激活可提高凋亡因子caspase-9活性而加剧神经元凋亡程度;而采用LC3- II/Beclin-1蛋白抑制剂干预后,能抑制细胞凋亡。② 激活自噬可抑制神经元凋亡,防止脑损伤[19-20]。研究者们发现药物发挥神经保护作用的主要途径是通过上调LC3- II和Beclin-1激活自噬,而凋亡蛋白caspase-3、caspase-8、caspase-9、聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase,PARP)、Bcl-2/Bax则表达下调,自噬诱导剂可增加药物对脑缺血损伤的保护作用;自噬抑制剂则加剧凋亡的发生。无论何种观点,脑缺血过程中凋亡和自噬的交互作用将对神经元产生调控是不争的事实,故二者的相互作用网络研究将为脑缺血后神经细胞的死亡途径提供更加详实的证据。
3 Cdk5介导的凋亡与自噬交互网络
磷脂酰肌醇3激酶-蛋白激酶B-哺乳动物雷帕霉素靶蛋白(PI3K-Akt-mTOR)是自噬膜形成和成熟的关键信号通路[11],其中,Akt作为一种丝氨酸/苏氨酸蛋白激酶,除了通过mTOR对自噬具有调控作用外,还能影响下游多种凋亡相关因子的活化状态,根据文献报道[21-22]归纳为3条信号传导途径:① Akt激酶通过使Bad的Ser136位点磷酸化, 阻断Bad与Bcl-2和/或Bcl-xl形成二聚体,有效阻断细胞凋亡;② Akt磷酸化Bcl-2家族成员Bax的Ser184位点, 负调控促凋亡功能;③ 活化的Akt还可以使caspase-9在Ser196 位点磷酸化而失活, 从而抑制caspase-3,有效抑制凋亡。3种途径均表明Akt是凋亡与自噬共享调节子关键上游蛋白。此外,研究表明[23],Cdk5可通过调节Akt激酶的活化水平,进而影响下游相关蛋白的表达,证实了Cdk5与Akt之间存在信号转导关系;Cdk5还能影响caspase-3和Bcl-2的表达水平,进而调控凋亡[8-9],而Bcl-2又可与自噬的关键基因Beclin-1结合直接调控自噬[24],通过Bcl-2在Ser70位点磷酸化,导致Bcl-2/Beclin1复合物降解,激活自噬,而采用Akt激酶抑制剂则可通过降低Bcl-2的磷酸化水平,从而降低自噬水平。综上,推测Cdk5经由Akt激酶调节凋亡与自噬的共享调节子,进而调控二者的交互作用网络,对脑缺血后神经元发挥双重调节作用,具体信号途径见Fig 1。
4 展望
由于脑缺血的病理生理机制的复杂性,且随着脑缺血的进程发生变化,因此,有关脑缺血后Cdk5介导的凋亡与自噬之间的交互作用到底如何?自噬对脑缺血后神经细胞元凋亡是产生正向调控还是负向调控?这些问题答案并非一成不变,脑缺血过程必须动态研究才能更加真实地反映其分子机制。在前期研究基础和充分的文献调研基础上,基于Cdk5对神经元调控的关键性,针对凋亡与自噬的交互作用方式在脑缺血调控中存在的不同观点,推测Cdk5介导的凋亡与自噬交互作用对脑缺血进程的调控可能如下:① 脑缺血初期,Cdk5通过Akt激酶介导凋亡与自噬的产生,二者以合作的形式共同清除受损细胞器,维持细胞正常功能。② 随着脑缺血的进程,Cdk5异常活化,Akt激酶活性被抑制,导致Akt对细胞凋亡的抑制作用通过凋亡与自噬的共享调节子被阻断;同时,Akt的活性降低直接导致mTOR被激活,从而抑制自噬。此时,凋亡与自噬的交互作用形式表现为对抗关系,自噬并不引发细胞死亡,相反促进细胞存活,但是由于脑缺血加剧期自噬活性的降低导致神经元持续大规模死亡。后续本课题组将以此为方向展开深入研究,为缺血性脑损伤治疗靶点的寻找提供有价值的线索。此外,课题组前期分别从体外和体内两个角度,采用体外氧化应激细胞模型和体内局灶性脑缺血模型(middle cerebral artery occlusion,MCAO)证实了补阳还五汤类方对脑缺血损伤疗效明显[10,25],据本文思路,推测补阳还五汤类方可能通过对凋亡与自噬的共享调节子如Bax、Bcl-2家族蛋白和caspase等途径,对脑缺血后神经元的自噬和凋亡产生干预,恢复机体内阴阳平衡,有效发挥抗脑缺血损伤作用,将从新的视角阐明补阳还五汤类方抗脑缺血作用机制,并有望在此基础上进行创新药物研发。
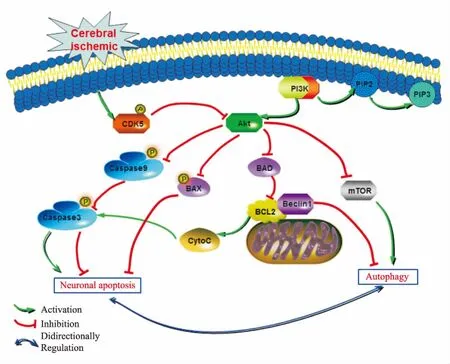
Fig 1 Intercross effect of apoptosis and autophagy mediated by Cdk5
(致谢:本文研究思路的形成得到了湖南中医药大学裴刚教授的大力指点,在此表示感谢。)
参考文献:
[1]Feigin V L, Mensah G A, Norrving B, et al. Atlas of the global burden of stroke (1990-2013): the GBD 2013 Study [J].Neuroepidemiology, 2015,45: 230-6.
[2]Anrather J, Iadecola C. Inflammation and stroke: an overview [J].Neurotherapeutics, 2016,13(4): 661-70.
[3]Martynov M Y, Gusev E I. Current knowledge on the neuroprotective and neuroregenerative properties of citicoline in acute ischemic stroke [J].JExpPharmacol,2015,7: 17-28.
[4]Jeong J H, Yu K S, Bak D H, et al. Intermittent fasting is neuroprotective in focal cerebral ischemia by minimizing autophagic flux disturbance and inhibiting apoptosis [J].ExpTherMed, 2016,12(5): 3021-8.
[5]Cheung Z H, Ip N Y. Cdk5: a multifaceted kinase in neurodegenerative diseases [J].TrendsCellBiol, 2012,22(3): 169-75.
[6]Patrick G N, Zukerberg L, Nikolic M, et al. Conversion of p35 to p25 deregulates CDK5 activity and promotes neurodegeneration [J].Nature, 1999,402(6762): 615-22.
[7]Rashidian J, Iyirhiaro G, AleyasinH, et al. Multiple cyclin-dependent kinases signals are critical mediators of ischemia-hypoxic neuronal deathinvitroandinvivo[J].PNAS, 2005,102(39): 14080-5.
[8]Tan X, Chen Y, Li J, et al. The inhibition of Cdk5 activity after hypoxia/ischemia injury reduces infarct size and promotes functional recovery in neonatal rats [J].Neuroscience, 2015,290: 552-60.
[9]Ji Y B, Zhuang P P, Ji Z, et al. TFP5 peptide, derived from CDK5-activating cofactor p35, provides neuroprotection in early-stage of adult ischemic stroke [J].SciRep, 2017,7: 40013.
[10] 刘芳, 王宇红, 邵乐,等. 补阳还五汤精简方对大脑中动脉阻塞模型大鼠海马组织Cdk5的调控 [J]. 中国药理学通报, 2017,33(8): 1176-81.
[10] Liu F, Wang Y H, Shao L, et al. Regulation of thin recipe of Buyang Huanwu decoction on Cdk5 expression of rats after cerebral ischemia [J].ChinPharmacolBull, 2017,33(8): 1176-81.
[11] Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues [J].Cell, 2011,147(4): 728-41.
[12] Su LY, Li H, Lv L, et al. Melatonin attenuates MPTP-induced neurotoxicity via preventing CDK5-mediated autophagy and SNCA/a-synuclein aggregation [J].Autophagy, 2015,11(10): 1745-59.
[13] Wen Z, Shu Y, Gao C, et al. CDK5-mediated phosphorylation and autophagy of RKIP regulate neuronal death in Parkinson’s disease [J].NeurobiolAging, 2014,35(12): 2870-80.
[14] Wong A S, Lee R H, Cheung A Y, et al. Cdk5-mediated phosphorylation of endophilin B1 is required for induced autophagy in models of Parkinson’s disease [J].NatCellBiol, 2011,13(5): 568-79.
[15] Mahoney E, Byrd J C, Johnson A J. Autophagy and ER stress play an essential role in the mechanism of action and drug resistance of the cyclin-dependent kinase inhibitor flavopiridol [J].Autophagy, 2013,9(3): 434-5.
[16] Su M, Mei Y, Sinha S. Role of the crosstalk between autophagy and apoptosis in cancer [J].JOncol, 2013,2013:1027375.doi:1155/2013/102735.
[17] Gao L, Jiang T, Guo J, et al. Inhibition of autophagy contributes to ischemic postconditioninginduced neuroprotection against focal cerebral ischemia in rats [J].PLoSOne, 2012,7(9): e46092.
[18] Jeong J H, Yu K S, Bak D H, et al. Intermittent fasting is neuroprotective in focal cerebral ischemia by minimizing autophagic flux disturbance and inhibiting apoptosis [J].ExpTherMed, 2016,12(5): 3021-8.
[19] Buckley K M, Hess D L, Sazonova I Y, et al. Rapamycin up-regulation of autophagy reduces infarct size and improves outcomes in both permanent MCAL, and embolic MCAO, murine models of stroke [J].ExpTranslStrokeMed, 2014,21(6):8.
[20] Zhang Q, Bian H, Guo L, et al. Pharmacologic preconditioning with berberine attenuating ischemia-induced apoptosis and promoting autophagy in neuron [J].AmJTranslRes, 2016,8(2):1197-207.
[21] Song G, Ouyang G L, Bao S D. The activation of Akt /PKB signaling pathway and cell survival [J].JCellMolMed, 2005,9(1): 59-71.
[22] Xin M G, Deng X M. Nicotine inactivation of the proapoptotic function of bax through phosphorylation [J].JBiolChem, 2005,280(11): 10781-9.
[23] Zhang S, Lu Z, Mao W, et al. CDK5 regulates paclitaxel sensitivity in ovarian cancer cells by modulating AKT activation, p21Cip1- and p27Kip1-mediated G1 cell cycle arrest and apoptosis [J].PLoSOne, 2015,10(7): e0131833.
[24] Qi Z, Dong W, Shi W, et al. Bcl-2 phosphorylation triggers autophagy switch and reduces mitochondrial damage in limb remote ischemic conditioned rats after ischemic stroke [J].TranslStrokeRes, 2015,6(3): 198-206.
[25] 刘芳,刘青萍,王宇红,等. 补阳还五汤及其精简方抗脑缺血损伤功效比较[J]. 中国中医药信息杂志, 2014,21(9): 46-9.
[25] Liu F, Liu Q P, Wang Y H, et al. Comparison of the effects of Buyang Huanwu decoction and its recipe composition on cerebral ischemic injury[J].ChinJInforTCM, 2014,21(9): 46-9.
