内质网自噬在Cajal间质细胞内质网应激损伤中的作用
2018-04-11张丽敏凌江红周洲徐宽张钰琴谢天一王煜姣
张丽敏,凌江红,2,周洲,徐宽,张钰琴,谢天一,王煜姣
(1 广西医科大学第一附属医院,南宁530021;2上海健康医学院附属周浦医院)
Cajal间质细胞(ICCs)是胃肠活动的起搏者和调节者,对胃肠运动的调节起重要作用[1]。在人类[2]或动物[3]中,ICCs的数量减少或缺失、细胞网络结构异常等应激损伤是导致该细胞活性减弱或消失,进而引发胃肠动力障碍的主要原因。因此,减轻ICCs的应激损伤,维持其细胞存活是一种有效促进胃肠动力的方法。内质网(ER)是调控细胞功能和维持细胞存活的重要细胞器之一,众多因素可引起内质网稳态的改变,使内质网功能缺陷或丧失,引发内质网应激(ERS)。RES可导致细胞损伤,为避免损伤,细胞将通过激活自噬的一个新分支,选择性地降解受损内质网以维持细胞内稳态。此自噬新分支由Bernales等[4]首先提出,称其为内质网自噬。自噬具有双向调节作用[5],因此,抑制或激活内质网自噬成为潜在防治疾病的新靶点。但内质网自噬在ICCs的ERS损伤中的作用尚未明确。本研究旨在探讨ERS引起ICCs损伤过程中内质网自噬的发生及其作用,为改善胃肠动力障碍提供新的靶标。
1 材料与方法
1.1材料实验动物:SPF级SD大鼠,鼠龄8周,体质量(150±10)g,雌雄不限,购自广西医科大学动物实验中心,动物生产许可证号:SCXK 桂 2015-0003。适应性喂养于室温25 ℃、光照周期12 h/12 h的环境中1周,自由进食、进水。实验前禁食不禁水8 h。主要试剂和仪器:胎牛血清(Gibco, USA),M199培养基(Hyclone, USA),Ⅱ型胶原酶、0.25%胰蛋白酶+0.02%EDTA、大鼠干细胞因子SCF、三甲基腺嘌呤3-MA、雷帕霉素(Rapa,Sigma),CD117/c-kit山羊抗大鼠多克隆抗体(Pierce),异硫氰酸荧光素(FITC)-山羊抗兔多克隆抗体(Life),逆转录试剂盒(Thermo Fisher),qPCR试剂盒(Qiagen),CCK-8试剂盒(Dojindo),衣霉素(TM)、Ficoll400、4%多聚甲醛溶液、抗荧光淬灭封片液(Solarbio),青霉素-链霉素溶液、两性霉素B、PBS溶液(Genom, China),水合氯醛、戊二醛(Kelong)。医用超净工作台(Airtech),CO2培养箱(Thermo Forma),高速冷冻离心机(Eppendorf),解剖显微镜(Luxikj),倒置相差显微镜、正置荧光显微镜(Olympus),实时荧光定量PCR仪(Applied Biosystems),酶标仪(Multiskan Ascent)。
1.2ICCs的分离和培养参考文献[6, 7],采用酶解法分离大鼠胃窦ICCs。取SD大鼠3只/次,雌雄不限,禁食不禁水8 h。10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,25%戊二醛术前消毒。开腹取胃,沿胃小弯剪开,取长约3 cm胃窦,用4 ℃预冷的PBS溶液(含1%青霉素-链霉素溶液)清洗3次。在解剖显微镜下用锐性镊子剥离黏膜层及黏膜下层,取胃肌条剪碎成1 mm×1 mm大小,加入Ⅱ型胶原酶消化液(M199培养基配置,终浓度1.3 mg/mL)。置于37 ℃恒温水浴箱消化组织碎块45~50 min,1 300 r/min离心1.5 min,弃上清,PBS溶液重悬,再次离心弃上清后加入M199培养基。缓慢吹打15 min重悬,过200目筛网,收集于离心管内,加入等量Ficoll400密度梯度液,1 900 r/min离心15 min,取交界面细胞。加入完全培养基(含10%胎牛血清、M199培养基、1%青霉素-链霉素溶液、0.5%两性霉素B和25 ng/mL干细胞因子)重悬细胞,调整细胞密度至1×106/mL,接种于25 cm2培养瓶中(约4 mL/瓶),于5%CO2、37 ℃细胞培养箱培养。24 h后首次换液,此后细胞换液2~3 d/次,并使用倒置显微镜观察细胞特征及生长状态。取对数生长期的ICCs进行实验。
1.3ICCs鉴定采用c-kit特异性抗体免疫荧光染色法。取对数生长期的ICCs,经0.25%胰蛋白酶消化,1 300 r/min离心1.5 min并弃上清,加完全培养基调整细胞密度,将细胞接种于含无菌圆形细胞爬片的24孔板中(1×104/孔)。贴壁24 h后弃去旧培养基,PBS溶液清洗3次,5 min/次。预冷的4%多聚甲醛固定10 min,PBS溶液清洗3次,5 min/次。5%脱脂奶粉封闭10 min,PBS溶液清洗3次,5 min/次。加入兔抗大鼠c-kit抗体(1∶100),设立阴性对照组以PBS溶液代替c-kit抗体,4 ℃冰箱孵育过夜。次日使用PBS溶液清洗3次,5 min/次,加入山羊抗兔FITC二抗(1∶200)后于37 ℃孵育1 h, PBS溶液清洗3次。将细胞爬片取出,滴加抗淬灭封片剂封片后于荧光显微镜下观察并拍照。
1.4实验分组与处理采用TM诱导ICCs构建内质网应激模型。参考文献[8]予2 μg/mL的TM作用6 h时可介导内质网自噬,结合预实验予4 μmol/mL 3-MA和2 μmol/mL Rapa分别作用ICCs 6 h时细胞的存活率为最高,故以上述浓度进行实验。将细胞随机分为4组,ICCs组给予正常培养;ERS组给予2 μg/mL TM处理[8];3-MA组给予2 μg/mL TM和4 μmol/mL 3-MA联合作用;Rapa组给予2 μg/mL TM和2 μmol/mL Rapa联合作用。各组时间均为6 h。
1.5GRP78、LC3B的mRNA表达检测采用实时荧光定量qPCR法。各组ICCs根据分组要求加入相应的TM、3-MA或Rapa进行干预,采用TRIzol法提取总RNA,用紫外分光光度计测定样品RNA纯度。按照反转录试剂盒说明书操作,将总RNA反转录为cDNA,于-20 ℃保存备用。进一步以SYBR Premix(10 μL)+cDNA模板(2 μL)+正/反向引物(各1 μL)+无核酸酶超纯水(6 μL)的反应体系,上荧光定量PCR仪进行扩增反应。GAPDH为内对照。引物序列:GAPDH正向引物:5′-ACAGCAACAGGGTGGTGGAC-3′,反向引物:5′-TTTGAGGGTGCAGCGAACTT-3′。GRP78正向引物:5′-ACCTATTCCTGCGTCGGTGT,反向引物:5′-TTCCAAGTGCGTCCGATGAG-3′。LC3B正向引物:5′-CGGAGCTTCGAACAAAGAGTG-3′,反向引物:5′-TGCCTTGGTAGGGGCTTAAC-3′。每个样品设立3个复孔,采用2-ΔΔCt法计算各组mRNA的相对表达量。
1.6各组ICCs活性检测采用CCK-8法。取对数生长期的ICCs,经消化、离心、收集后,使用完全培养基重悬计数,以1×104/孔的细胞量接种于96孔板中,将培养板放入培养箱(37 ℃、5%CO2条件下),24 h贴壁后常规更换培养基。按照分组要求加入相应的TM、3-MA或Rapa进行干预,每组重复6个孔,置于培养箱中6 h,每孔分别加入10 μL CCK-8(避免在孔中生成气泡),再于培养箱中孵育3 h,用酶标仪测定在450 nm波长处各孔的光密度值(OD值)。实验重复3次,取平均值。设不含ICCs的培养基为空白孔(Ab),正常培养的ICCs组为对照孔(Ac),ERS组、3-MA组和Rapa组为实验孔(As),细胞存活率为[(As- Ab)/( Ac- Ab)]×100%。

2 结果
2.1ICCs镜下细胞形态及免疫荧光染色鉴定对数生长期的ICCs细胞形态清晰,呈梭形、菱形或三角形,细胞核大、核周胞质少,胞体发出2~5条长突起,与相邻ICCs的突起、胞体紧密连接成网络状,如图1A。c-kit蛋白为ICCs的特异性蛋白,c-kit免疫标志的荧光染色法可对ICCs细胞进行特异性鉴定,如图1B所示,阳性表达呈绿色。

图1 ICCs的形态及荧光鉴定(×200)
2.2各组GRP78、LC3B mRNA表达比较与ICCs组比较,ERS组、3-MA组和Rapa组的GRP78、LC3B的mRNA表达均升高(P均<0.05)。与ERS组比较,3-MA组的GRP78 mRNA表达升高(P<0.05),LC3B mRNA表达降低(P<0.05);Rapa组的GRP78 mRNA表达降低(P<0.05),LC3B mRNA表达升高(P<0.05)。见表1。

表1 各组GRP78、LC3B的mRNA表达比较
注:与ICCs组比较,*P< 0.05;与ERS组比较,#P<0.05。
2.3各组ICCs活性比较与ICCs组比较,ERS组、3-MA组和Rapa组细胞活性的OD值均降低(P均<0.05);与ERS组相比,3-MA组细胞活性的OD值降低(P<0.05),Rapa组细胞活性的OD值升高(P<0.05)。见表2。
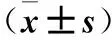
表2 各组ICCs活性情况比较
注:与ICCs组比较,*P<0.05;与ERS组比较,#P<0.05。
3 讨论
胃肠道的慢波节律紊乱和神经递质信号传导异常是胃肠动力障碍性疾病发生的共同原因,Cajal间质细胞是胃肠动力的基本单位,各种应激导致该细胞生理功能异常是多种胃肠疾病的关键机制[9]。已有临床研究证实诸多胃动力障碍性疾病,如贲门失弛缓症[10]、胃轻瘫[11]、慢性特发性肠梗阻[12]及慢性传输型便秘[13]等与ICCs的功能异常有关。因此,修复ICCs的应激损伤,恢复细胞内稳态是促进胃肠动力的基础。原代培养的大鼠胃窦ICCs较好保存了原组织细胞的遗传特征和生物学特性,为研究胃肠动力障碍性疾病的发病机制提供了细胞模型。本实验根据镜下细胞形态学特征和免疫荧光染色鉴定[7],结果提示所培养的原代细胞为ICCs。
既往认为,自噬是非特异性降解细胞内成分及细胞器的代谢过程,但最新研究发现,部分自噬具有选择性,如内质网应激可介导自噬[14]。内质网是蛋白质合成、折叠和分泌的重要场所,起到调节细胞内稳态的重要作用。然而,细胞在受到氧化应激、细胞能量水平下降、钙代谢紊乱等生理和病理因素的刺激下,内质网会出现未折叠或错误折叠蛋白的大量积累,引起内质网损伤,最终导致ERS反应。此时,内质网分子伴侣GRP78解离,参与调控未折叠蛋白反应,因此GRP78被作为ERS发生的标志性分子[15]。当未折叠或错误折叠蛋白过多,形成聚泛素化、稳定难溶而且对蛋白酶体功能有一定毒性的蛋白聚集物时,将激活自噬清除细胞内受损的内质网,消除未折叠蛋白反应和降解有毒蛋白质聚集物,维持细胞的存活[16]。自噬发生时,LC3B结合并始终位于自噬体膜上,被作为检测自噬表达水平的特异性方法[17]。本实验以经典的ERS诱导剂TM作用于ICCs构建ERS模型,与ICCs组比较,ERS组GRP78的mRNA表达升高,提示ERS模型成立。同时,LC3B表达亦升高,说明在ICCs的ERS过程中伴随内质网自噬的发生。
巨自噬是最常见的自噬形式,是非选择性的形成双层膜包裹的自噬体,再与溶酶体融合为自噬溶酶体的过程,巨自噬具有双向调节作用[5]。Bernales等[4]在酵母中发现ERS的未折叠蛋白反应可引起内质网膨胀并重构,重构的内质网被双层膜包裹扩展成囊泡,采用特异性内质网蛋白免疫标记证实囊泡膜来自内质网,因此提出这种选择性自噬为内质网自噬。同样,内质网自噬存在双向调节作用[18]。ERS时,内质网自噬降解受损内质网积累的未折叠蛋白或错误折叠蛋白,从而预防疾病;但在病理情况下,过度激活的自噬亦可清除正常的内质网结构,反而使机体病变加剧。本研究结果表明,与ERS组比较,用自噬抑制剂3-MA干预后GRP78的表达升高,用自噬诱导剂Rapa干预后GRP78表达降低,且CCK-8法检测结果进一步证实了3-MA使 ICCs的活性下降,而Rapa使ICCs的活性升高,结果提示内质网自噬可减轻ICCs的ERS损伤。
综上所述,ICCs的ERS过程伴发内质网自噬,内质网自噬可减轻ICCs的ERS损伤。在胃肠动力障碍疾病中,如能通过促进内质网自噬以维持ICCs的存活,将为改善胃动力障碍提供新的靶点。但ERS介导ICCs内质网自噬的具体分子机制尚未明确,仍需进一步研究。
参考文献:
[1] Sanders KM. A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract[J]. Gastroenterology, 1996,111(2):492-515.
[2] Geraldino R, Ferreira A, Lima M, et al. Interstitial cells of Cajal in patients with chagasic megacolon originating from a region of old endemicity[J]. Pathophysiology, 2006,13(2):71-74.
[3] Ueshima S, Nishida T, Koike M, et al. Nitric oxide-mediated injury of interstitial cells of Cajal and intestinal dysmotility under endotoxemia of mice[J]. Biomedical Research, 2014,35(4):251-262.
[4] Bernales S, Schuck S, Walter P. ER-phagy: selective autophagy of the endoplasmic reticulum[J]. Autophagy, 2007,3(3):285-287.
[5] Mehrpour M, Esclatine A, Beau I, et al. Autophagy in health and disease. 1. Regulation and significance of autophagy: an overview[J]. Am J Physiol Cell Physiol, 2010,298(4):C776-C785.
[6] 张智,凌江红,宁海恩,等.柴胡疏肝散含药血清对大鼠胃Cajal 间质细胞增殖及细胞周期的影响[J].世界华人消化杂志,2015,23(30):4792-4799.
[7] 宁海恩,凌江红,张智,等.酶解法分离与同源血清培养SD大鼠胃Cajal间质细胞的实验研究[J].广西中医药大学学报,2016,19(1):8-12.
[8] Ogata M, Hino S, Saito A, et al. Autophagy is activated for cell survival after endoplasmic reticulum stress[J]. Mol Cell Biol, 2006,26(24):9220-9231.
[9] Yin J, Chen JD. Roles of interstitial cells of Cajal in regulating gastrointestinal motility: in vitro versus in vivo studies[J]. J Cell Mol Med, 2008,12(4):1118-1129.
[10] Villanacci V, Annese V, Cuttitta A, et al. An immunohistochemical study of the myenteric plexus in idiopathic achalasia[J]. J Clin Gastroenterol, 2010,44(6):407-410.
[11] Forster J, Damjanov I, Lin Z, et al. Absence of the interstitial cells of Cajal in patients with gastroparesis and correlation with clinical findings[J]. J Gastrointest Surg, 2005,9(1):102-108.
[12] Streutker C, Huizinga J, Campbell F, et al. Loss of CD117 (c-kit)-and CD34-positive ICC and associated CD34-positive fibroblasts defines a subpopulation of chronic intestinal pseudo-obstruction[J]. Am J Surg Pathol, 2003,27(2):228-235.
[13] Lee JI, Park H, Kamm MA, et al. Decreased density of interstitial cells of Cajal and neuronal cells in patients with slow‐transit constipation and acquired megacolon[J]. J Gastroenterol Hepatol, 2005,20(8):1292-1298.
[14] Kouroku Y, Fujita E, Tanida I, et al. ER stress (PERK/eIF2 [alpha] phosphorylation) mediates the polyglutamine-induced LC3 conversion, an essential step for autophagy formation[J]. Cell Death Differ, 2007,14(2):230.
[15] Chen HY, Tsai WC, Chiu YL, et al. Triglyceride to high-density lipoprotein cholesterol ratio predicts cardiovascular outcomes in prevalent dialysis patients[J]. Medicine, 2015,94(10):e619.
[16] Volmer R, van der Ploeg K, Ron D. Membrane lipid saturation activates endoplasmic reticulum unfolded protein response transducers through their transmembrane domains[J]. Proc Natl Acad Sci U S A, 2013,110(12):4628-4633.
[17] Mizushima N. Methods for monitoring autophagy[J]. Int J Biochem Cell Biol, 2004,36(12):2491-2502.
[18] Ameri K, Harris AL. Activating transcription factor 4[J]. Int J Biochem Cell Biol, 2008,40(1):14-21.
