下调MTDH基因表达对乳腺癌MCF-7细胞增殖及凋亡的影响
2018-04-11董超罗春香陈印曾佳佳吴仕贤杨润祥
董超,罗春香,陈印,曾佳佳,吴仕贤,杨润祥
(1昆明医科大学第三附属医院,昆明 650118;2昆明医科大学第一附属医院;3曲靖市第一人民医院)
自20世纪90年代以来,我国乳腺癌的发病率呈持续上升态势,已跃居女性恶性肿瘤发病第1位,新发病例占全球的12.2%,病死率占9.6%,严重威胁中国女性的健康[1]。由于公众意识和早期筛查的普及度不够,确诊乳腺癌的患者分期较晚且占多数。而早期乳腺癌患者在接受辅助治疗后,仍有30%最终会出现复发转移,这亦是乳腺癌死亡的主要原因。MTDH基因即转移黏附基因(MTDH),已被证实是多种恶性肿瘤的癌基因,在肿瘤细胞增殖、凋亡、迁移、侵袭及化疗耐药等过程中发挥重要作用[2~4]。已有研究证实,MDTH基因过表达与乳腺癌的侵袭转移及化疗耐药密切有关,可作为乳腺癌病情进展和不良预后的预测指标[5,6]。2016年5月,我们应用小干扰RNA技术(siRNA)下调乳腺癌MCF-7细胞中MTDH表达,探讨对乳腺癌细胞增殖、细胞周期和凋亡的影响。
1 材料与方法
1.1材料乳腺癌MCF-7细胞株购自云南昆明动物所,MTDH-siRNA和Control-siRNA由上海吉玛公司设计合成,按说明书操作配成溶液备用。荧光标记的siRNA(FAM-siRNA)和转染试剂LipofectamineTM2000均购自上海吉玛制药技术有限公司。MTDH-siRNA-1432抗体和β-actin蛋白购自Santa Cruz公司。
1.2细胞培养、MTDH-siRNA的构建和转染效率测算乳腺癌MCF-7细胞株用含10%胎牛血清的DF-12培养基培养,放入37 ℃、5%CO2的培养箱中培养。常规消化细胞并接种,按照LipofectamineTM2000说明书进行转染,转染组转染MTDH-homo-1432,对照组转染等剂量的control-FAM。将0.5×105个细胞接种于六孔培养板中,转染组取10 μL/孔Lipofectamin2000(使用前轻轻摇匀),用250/μL Opti-MEM 1 Reduced Serum Medium稀释。对照组取10 μL FAM-siRNA,用250 μL Opti-MEM 1 Reduced Serum Medium 稀释,轻轻混合均匀。空白组只加转染试剂。转染24 h后即可检测转染效率。使用荧光标记的siRNA(FAM-siRNA)检测转染效率。只有成功转染的细胞才可看到FAM绿色荧光。
1.3MTDH基因表达检测采用RT-PCR法。总RNA提取试剂和PCR试剂盒购自昆明丰科生物科技有限公司。MTDH引物由大连宝生物公司合成,β-actin基因引物来自云南省肿瘤研究所实验室序列,MTDH正向引物:5′-AAATAGCCAGCCTATCAAGACTC-3′,反向引物:5′-TTCAGACTTGGTCTGTGAAGGAG-3′,引物大小为334 bp;β-actin正向引物:5′-GTTGCTGTTCGAAAGCATCTTG-3′,反向引物:5′-AATATCGAGCCAAACGGTGAA-3′,引物大小为100 bp。细胞转染48 h后,胰酶消化并收集细胞,TRIzol酚氯仿法提取总RNA,紫外分光光度计检测,0D260/280值。将RNA反转录为cDNA,所得cDNA按照说明书进行PCR反应:95 ℃变性,50 ℃退火,60 ℃延伸,反应40个循环。PCR产物于琼脂糖凝胶电泳,成像拍照。
1.4MTDH蛋白表达检测采用免疫印迹法(Western blotting)。取对数生长期的转染前后MCF-7细胞,将细胞悬液离心,弃上清,加新鲜培养液重悬,计数后稀释到1×106细胞/mL,然后将其吹打混匀后取3 mL接种于六孔板内。培养48 h后,PBS漂洗细胞2次,6孔板每孔加入100 μL RIPA冰上裂解细胞30 min,每孔收集所有裂解物至1.5 mL离心管中,4 ℃离心机,12 000 g×10 min,取上清即为细胞总蛋白。采用蛋白试剂盒(BCA)进行蛋白定量,酶标仪567 nm读取吸光度值,计算得到样品实际浓度,制备10% SDS-PAGE凝胶,每泳道加蛋白50 μg进行电泳,全程稳压120 V电泳对目的蛋白样品进行分离。将分离出来的蛋白进行转膜,5%脱脂牛奶封闭液室温下封闭1 h。按1∶1 000比例稀释一抗抗体MTDH-siRNA-1432,4 ℃孵育过夜。回收一抗抗体,TBST洗膜液洗膜,用辣根过氧化物酶(HRP)标记的二抗室温孵育1 h,TBST洗膜液洗膜3次,每次5 min。加入ECL发光底物,均匀滴到膜上,反应1 min,放入化学发光成像仪中检测目的蛋白。
1.5细胞增殖情况检测采用MTT法。转染组(MTDH-siRNA-1432)、对照组(Negative control FAM /GAPDH Positive control)、空白组(Blank),每组各设3个复孔。取对数期生长的转染前后MCF-7细胞,以1×103/孔接种于96孔板中;然后在96孔板中加100 μL的培养液,铺板均匀后放入37 ℃细胞培养箱。分别于转染24、48、72、96、120、144 h后加MTT溶液(20 μL/孔),37 ℃避光孵育4 h后,缓缓小心吸弃上清,每孔加入150 μL DMSO,待沉淀振荡溶解后,将酶标仪调定在490 nm波长处,测定吸光度值并计算5个复孔的平均值和标准差。
1.6细胞凋亡情况检测 采用流式细胞术。转染48 h后MCF-7细胞以1×106/孔接种于6孔板贴壁培养24 h,胰酶消化,用-20 ℃预冷的磷酸盐缓冲溶液冲洗细胞3次。取200 μL缓冲液将细胞重悬于流式管中,加入5 μL碘化丙啶(PI)溶液(50 μg/mL)和 10 μL FITC-Annexin V 溶液(10 μg/mL),暗盒中孵育20 min后再加入300 μL,结合缓冲液,上流式细胞仪进行细胞凋亡检测。
1.7细胞周期检测收集转染MCF-7细胞8×106个于1.5 mL离心管中,加入500 μL预冷70%乙醇重悬,冰上固定30 min后离心,分别加入TDT反应液及阴性对照液30 μL,置37 ℃下,孵育,洗涤,离心。加入100 μg/mL的PI溶液1 mL,避光放置15~30 min,流式细胞仪进行细胞周期分析。

2 结果
2.1转染对MTDH表达的影响根据参考文献合成MTDH-siRNA,转染效率达90%。转染48 h,MTDH-siRNA-1432对MTDH表达的干扰作用最为显著,抑制效率达89%。琼脂凝胶证实siRNA-1432对MTDH有显著抑制作用(图1)。Western blotting检测结果显示,转染组对MTDH蛋白表达有干扰作用 (图2)。
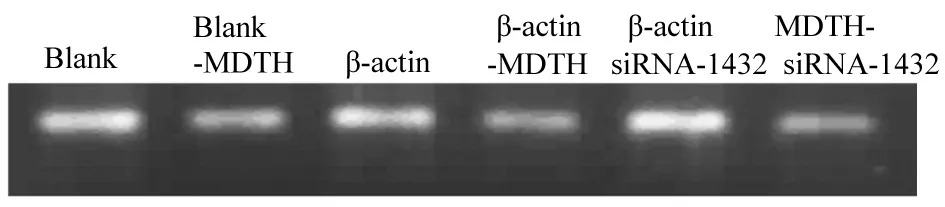
图1 琼脂糖凝胶电泳检测MTDH抑制效果
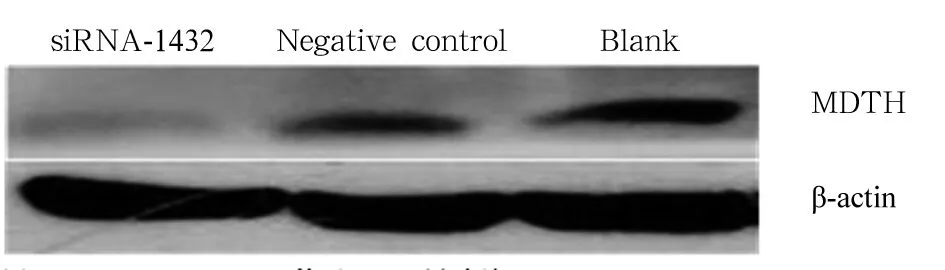
图2 Western blotting检测MTDH蛋白表达
2.2乳腺癌MCF-7细胞增殖情况比较与对照组、空白组相比,转染组细胞增殖能力受到明显抑制,且随着作用时间的延长抑制作用增加(P均<0.05)。见表1。
2.3乳腺癌MCF-7细胞干扰前后细胞周期、凋亡和坏死比例比较 转染组G1期细胞较空白组及对照组增加,差异有统计学意义(P均<0.01);转染组G2+S期细胞较空白组及对照组减少(P均<0.01)。转染组凋亡和坏死比例较空白组和对照组增加(P均<0.01),见表2。
3 讨论
MTDH是近年来研究较多的一个癌基因,在肿瘤的发生发展和信号传导中发挥重要的调节作用。其参与和激活PI3K/AKT途径、NF-κB途径、MAPK途径等多个信号传导通路,加速肿瘤细胞增殖和侵袭转移的进程[7]。大量研究提示,MDTH可作为肿瘤诊断潜在的生物标志物和治疗靶点,通过下调MDTH的表达可阻断肿瘤的转移,抑制肿瘤生长,提高化疗疗效[8]。MTDH在乳腺癌侵袭转移和化疗耐药中发挥重要作用[9]。

表1 各组不同时点MCF-7细胞增殖情况比较(OD值,
表2 各组MCF-7细胞周期、凋亡和坏死细胞
RNA干扰(RNAi)是指利用具有同源性的双链RNA诱导目标基因的沉默,能迅速阻断基因活性。siRNA是RNAi发挥关键作用的必需因子,对靶序列的识别有高度特异性。通过基因干扰技术降低目标基因的表达,既可阻断肿瘤细胞增殖转移的相关信号通路,亦可增加肿瘤细胞对临床放化疗的敏感性。本研究通过RNAi技术下调乳腺癌MCF-7细胞MDTH的表达,并应用RT-PCR和Western blotting技术对基因沉默的效果进行检测。结果显示,转染48 h后,MTDH-siRNA-1432对MTDH表达的干扰作用最为显著,抑制效率达89%。此与国内学者对乳腺癌细胞株MDA-MB-453和MDA-MB-231的研究结果一致[10]。MTDH高表达可促进乳腺癌细胞的侵袭和增殖能力,并上调HER2/neu表达,推测其可能是通过上调HER2/neu表达促进乳腺癌细胞增殖和侵袭[11]。研究表明,MDTH可能是肺癌的一个潜在治疗靶点,下调MDTH表达可能促进肺癌细胞凋亡[12]。本研究结果显示,MTDH基因下调对MCF-7细胞增殖有明显的抑制作用。siRNA下调MTDH基因表达后,与对照组和空白组相比,MCF-7乳腺癌细胞转染组G1期细胞明显增加,G2+S期细胞明显减少。表明MTDH-siRNA可将细胞阻滞于DNA合成前期(G1),而在DNA合成期(S)和合成后期(G2)细胞比例下降,进一步证实增殖周期的细胞减少。提示MTDH基因可能参与乳腺癌细胞的细胞周期调控过程,下调MTDH表达可阻止细胞进入增殖周期,让细胞停滞于G1期。流式细胞结果还显示,转染组细胞的凋亡和坏死比例亦较空白组和对照组增加,提示siRNA下调MTDH基因表达可诱导乳腺癌MCF-7细胞凋亡和坏死。
综上所述,下调MTDH表达,可抑制乳腺癌MCF-7细胞的增殖,促进其凋亡和坏死。
参考文献:
[1] Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014,15(7):e279-e289.
[2] Wang Z, Wei YB, Gao YL, et al. Metadherin in prostate, bladder, and kidney cancer: A systematic review[J]. Mol Clin Oncol, 2014,2(6):1139-1144.
[3] Zhao H, Wang QT, Geng SQ, et al. Protein expression of metadherin and sensibility of breast cancer MDA-MB-231 cells to treatment before and after transfection[J]. J Biol Regul Homeost Agents, 2015,29(2):459-464.
[4] Yao Y, Gu X, Liu H, et al. Metadherin regulates proliferation and metastasis via actin cytoskeletal remodelling in non-small cell lung cancer[J]. Br J Cancer, 2014,111(2):355-364.
[5] Tokunaga E, Nakashima Y, Yamashita N, et al. Over expression of metadherin/MTDH is associated with an aggressive phenotype and a poor prognosis in invasive breast cancer[J]. Breast Cancer, 2014,21(3):341-349.
[6] Hou Y, Yu L, Mi Y, et al. Association of MTDH immunohistochemical expression with metastasis and prognosis in female reproduction malignancies: a systematic review and meta-analysis[J]. Sci Rep, 2016,5(6):38365-38369.
[7] Shi X, Wang X. The role of MTDH/AEG-1 in the progression of cancer[J]. Int J Clin Exp Med, 2015,8(4):795-807.
[8] Huang Y, Li LP. Progress of cancer research on astrocyte elevated gene-1/Metadherin (Review)[J]. Oncol Lett, 2014,8(2):493-501.
[9] Wan L, Kang Y. Pleiotropic roles of AEG-1/MTDH/LYRIC in breast cancer[J]. Adv Cancer Res, 2013,120:113-134.
[10] 杜成,刘兆喆,马初东,等.MTDH基因下调抑制人乳腺癌MDA-MB-453细胞增殖同粘附和迁移的研究[J].中国肿瘤临床,2012,39(8):425-428.
[11] Zhang X, Zhang N, Zhang MX. Astrocyte elevated gene-1 induces breast cancer proliferation and invasion through upregulating HER2/neu expression[J]. Chin Med J (Engl),2011,124(21):3546-3550.
[12] Ke ZF, Mao X, Zeng C, et al. AEG-1 expression characteristics in human non-small cell lung cancer and its relationship with apoptosis[J]. Med Oncol, 2013,30(1):383.
