大麦-小麦无抗型日粮添加壳聚糖和非淀粉多糖酶对肉鸡生长性能和盲肠微生物组成的影响
2018-04-10王世雄刘丽仙霍海龙保志鹏
王世雄,刘丽仙,霍海龙,保志鹏,赵 筱
(云南农业职业技术学院,云南昆明 650212)
随着人们对抗生素耐药性的广泛关注以及国家对抗生素使用的限制,开发无抗型日粮和添加剂成为当前研究的热点。大麦和小麦在我国种植面积大,产量多,是较好的饲料资源,但由于其含非淀粉多糖(木聚糖、葡聚糖、甘露聚糖),影响营养物质利用,因此限制其作为家禽饲料原料的应用(冯定远等,2001)。目前已有相关研究报道,木聚糖酶和葡聚糖酶可以降低饲料原料中非淀粉多糖的水平,将饲料中常规养分分解成利于胃肠道吸收的小分子,提高饲料利用率(Bedford,1996;王冬群等,2013)。此外,由自然界中广泛存在的几丁质脱乙酰得到壳聚糖被认为是一种天然、无毒的碱性多糖,其氨基可以被免疫系统识别,具有免疫增强和抗炎抗菌功能(Kong等,2014)。本试验在大麦—小麦型无抗日粮中添加壳聚糖和非淀粉多糖酶,考察其对1~42 d肉鸡生长性能、空肠组织结构和盲肠微生物组分的影响,为壳聚糖和非淀粉多糖酶在无抗饲料中的应用提供新见解。
1 材料与方法
1.1试验材料 壳聚糖(脱乙酰度91.20%)购自嘉兴科瑞生物科技有限公司,非淀粉多糖酶(NSP酶,含2000 U木聚糖酶、2000 U葡聚糖酶)购自帝斯曼(中国)有限公司。
1.2试验动物与日粮设计 选取健康、体重一致(50.77±0.45)的1 d雌性ROSS 30商品代肉仔鸡720只,采用完全随机设计分为4个组,每组6个重复,每个重复30羽。试验日粮参考NRC(1994)肉鸡饲养标准和《中国鸡饲养标准2004》配制,对照组饲喂以大麦—小麦为主的基础日粮,壳聚糖组(CTS)、NSP酶组和壳聚糖+NSP酶组(CTS+NSP)饲粮为在基础日粮中分别添300 mg/kg CTS、200 mg/kg NSP 酶和 150 mg/kg CTS+100 mg/kg NSP酶,各组日粮均不添加任何抗生素药物。肉鸡分两阶段饲养,1~21 d和22~42 d基础日粮组成及营养水平见表1。

表1 0~21 d和22~42 d肉鸡基础日粮组成及营养水平
1.3饲养管理 鸡只采用分层笼养,鸡舍利用红外灯加温,鸡舍第一周温度控制在33~35 ℃,第二周控制在30 ℃,之后每周调节温度直至温度控制在22 ℃,舍内相对湿度控制在60%,采用自然光照和人工光照结合,光照强度控制在30 lx。试验鸡只全期自有采食、饮水,每天清粪一次,按照商品肉鸡常规程序进行免疫和消毒。饲养试验时间为42 d。
1.4测定指标
1.4.1 产性能 每天观察鸡群的健康、采食、粪便状况和鸡只死淘数,试验期间每周按重复记录采食量,分别在试验当天、22 d、43 d清晨对试验鸡只按重复进行称重,记录期末体重,计算1~21 d和22~42 d各重复鸡只平均日采食量、平均日增重和料重比。
1.4.2免疫器官指数 在43 d清晨饲喂前(42 d晚供水禁食),各重复随机选取8只鸡进行屠宰,采集胸腺、脾脏和法氏囊,称重后用于计算免疫器官指数。
免疫器官指数/(g/kg)采集空肠中段2~3 cm及左侧盲肠(两端结扎),-80 ℃保存。
1.4.3空肠结构和盲肠微生物组成 将2 cm空肠肠段样本用中性缓冲液冲洗干净后,固定在10%福尔马林溶液,样本经过脱水、透明、包埋(石蜡)后,进行HE染色,显微镜下(40×)观察并测量绒毛高度、隐窝深度、绒毛高度/隐窝深度(V/C)和杯状细胞的数量。
在超净工作台上无菌取出盲肠内容物0.5 g,加入9.5 mL灭菌生理盐水,混匀后,取0.5 mL于试管中,加入4.5 mL灭菌生理盐水,后续操作参考陈天寿(1995)的方法对大肠杆菌、乳酸杆菌和双歧杆菌进行培养。大肠杆菌培养基、乳酸杆菌培养基和双歧杆菌培养基均购自赛默飞世尔科技(中国)有限公司。
1.4.4数据统计与分析 试验数据使用Excel 2013处理后,采用SPSS19.0单因子方差分析,各组均值采用Tukey氏多重比较进行差异显著性检验,以P<0.05作为差异显著标准,结果以“平均值±标准差”表示。
2 结果与分析
2.1日粮添加CTS和NSP酶对1~42 d肉鸡生长性能的影响 由表2可知,日粮添加CTS、NSP酶或CTS+NSP酶肉鸡生长前期平均日采食量和料重比及全期平均日采食量均无显著影响(P>0.05)。与对照组相比,CTS组、NSP酶组和CTS+NSP酶组显著提高了21 d、42 d肉鸡末重和1~21 d、1~42 d肉鸡平均日增重(P<0.05)。与对照组相比,CTS组+NSP酶组显著降低22~42 d及1~42 d料重比(P<0.05),分别降低了2.91%(P<0.05)和3.03%(P<0.05)。CTS组和CTS+NSP酶组显著降低了试验期肉鸡死亡率(P<0.05),分别较对照组降低了48.96%(P<0.05)和51.64%(P<0.05)。

表2 日粮添加CTS和NSP酶对1~42 d肉鸡生长性能的影响
2.2日粮添加CTS和NSP酶对1~42 d肉鸡免疫器官指数的影响 日粮添加CTS、NSP酶或CTS+NSP酶对1~42 d肉鸡脾脏指数和法氏囊指数均无显著影响(P> 0.05)(表 3)。CTS组和CTS+NSP酶组1~42 d肉鸡胸腺指数显著高于对照组和NSP酶组(P<0.05),其中CTS+NSP酶组肉鸡胸腺指数表现为最高,较对照组和NSP酶组均提高43.75(P<0.05)。

表3 日粮添加CTS和NSP酶对1~42 d肉鸡免疫器官指数的影响 g/kg
2.3日粮添加CTS和NSP酶对1~42 d肉鸡空肠组织结构的影响 由表4可知,日粮添加CTS、NSP酶或CTS+NSP酶对空肠绒毛高度和杯状细胞数量均无显著影响(P>0.05)。日粮添加CTS+NSP酶较其他各组显著降低了空肠隐窝深度(P<0.05),显著提高了空肠绒毛高度与隐窝深度比值(P<0.05);与对照组相比,CTS+NSP酶组空肠隐窝深度降低了8.84%(P<0.05),空肠绒毛高度与隐窝深度比值提高了13.36%(P< 0.05)。
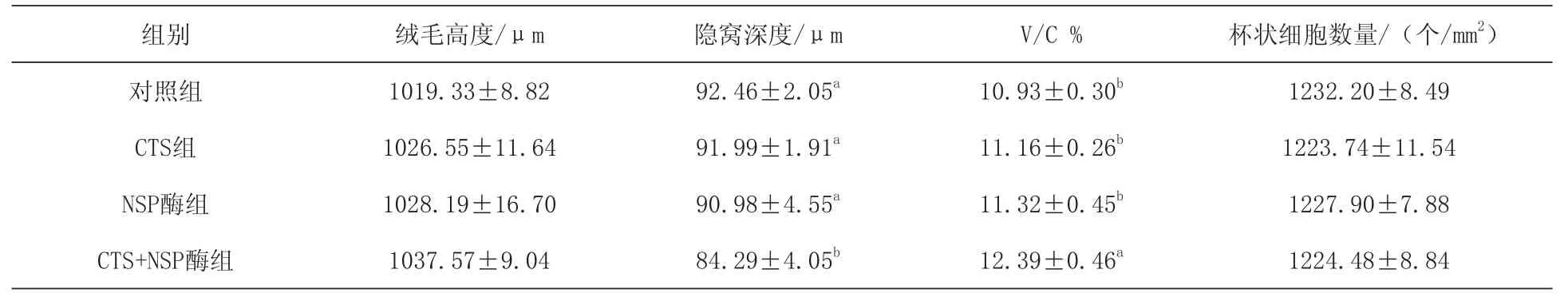
表4 日粮添加CTS和NSP酶对1~42 d肉鸡空肠组织结构的影响
2.4日粮添加CTS和NSP酶对1~42 d肉鸡盲肠微生物组成的影响 由表5可见,对照组与各处理间肉鸡盲肠双歧杆菌含量均无显著差异(P>0.05)。日粮添加NSP酶或CTS+NSP酶较对照组和CTS组显著提高了盲肠乳酸杆菌含量(P<0.05),其中CTS+NSP酶组盲肠乳酸杆菌含量表现为最高,较对照组提高了13.83%(P<0.05)。与对照组相比,CTS组、NSP酶组或CTS+NSP酶组均显著降低了盲肠大肠杆菌数量(P< 0.05),分别降低了 16.56%(P< 0.05)、16.60%(P<0.05)和18.58%(P<0.05)。
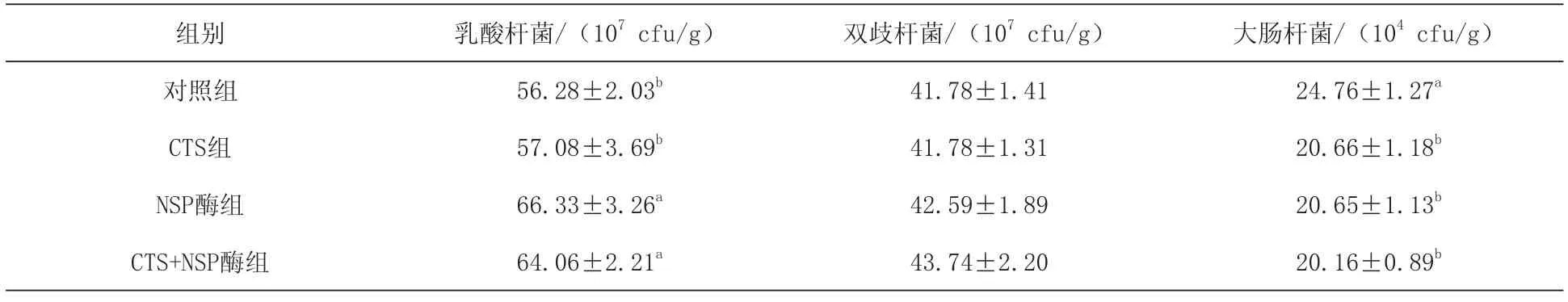
表5 日粮添加CTS和NSP酶对1~42 d肉鸡盲肠微生物组成的影响
3 讨论
3.1日粮添加CTS和NSP酶对肉鸡生长性能的影响 本试验利用大麦—小麦型日粮饲喂1~42 d肉鸡,结果发现,在无任何抗生素药物添加的情况下,对照组肉鸡全期死亡率最高(6.72%),同时42 d末重、日增重和料重比均表现不理想,这与本试验添加大麦和小麦有关,因为这两种谷物都含有大量可溶性非淀粉多糖(Non-Starch Polysaccharide,NSP),由于NSP具有较高的吸水力,从而会增加食糜的黏度,影响营养物质的消化吸收(Rodriguez等,2012)。综合评价1~42 d肉鸡的生产性能,本试验发现单独添加300 mg/kg CTS组或200 mg/kg NSP酶组效果均不如150 mg/kg CTS+100mg/kg NSP酶组,这可能与CTS或NSP酶其在某些功能方面发挥的作用与其添加剂量有关。有研究报道,增加NSP含量会降低日粮中包括淀粉在内的营养素消化率,如蛋白质、脂肪和矿物质(Choct等,1996),肉鸡日粮添加木聚糖酶可以改善小麦日粮高水平NSP带来的负面作用(Wu等,2004;王冬群等,2013),这与本试验研究结果一致。此外,本试验发现单独添加NSP酶主要影响肉鸡生长前期(1~21 d)生长性能,可能与肉鸡在幼龄阶段体内消化酶合成和分泌较少有关,添加NSP酶提高其对营养物质的利用。
本试验发现添加300 mg/kg CTS对1~42 d肉鸡平均日增重和料重比均无显著影响,这可能与高水平CTS会增加肠道内容物黏度有关(Razdan和 Pettersson,1994),降 低 肠 道 蠕动,从 而 增加 机 体 饱 感(Edwards,1990)。Shi等(2005)报道,肉仔鸡CTS适宜添加水平为0.05% ~ 0.1%,而 Khambualai等(2008)报道的水平为0.06%,本试验中0.01% CTS添加水平较0.03%对肉鸡的生产性能较好,这可能与试验所选的动物品种、日粮和饲养管理条件不同有关。
3.2日粮添加CTS和NSP酶对肉鸡免疫器官指数的影响 本试验中通过称量脾脏、胸腺和法氏囊的重量来间接考察日粮添加CTS和NSP酶对肉鸡免疫器官指数的影响。有研究报道,胸腺重量可以用于评价T细胞的发育状况(Elmore,2006),而脾脏重量与免疫细胞的增殖情况有关(Pozo等,2009)。CTS的氨基可以被免疫系统识别,进而刺激免疫细胞增殖和分化,释放免疫球蛋白(Tokura等,1999)。Xiao等(2013)在断奶仔猪日粮添加50mg/kg盐酸金霉素或300 mg/kg CTS,结果发现,CTS组空肠黏膜分泌型IgA含量高于金霉素组。上述结果均能解释本试验中添加CTS能提高1~42 d肉鸡胸腺指数的原因,但CTS对肉鸡免疫功能影响的作用机制还有待进一步研究。
3.3日粮添加CTS和NSP酶对肉鸡空肠组织结构的影响 肠绒毛高度、隐窝深度及绒毛和隐窝深度比是肠道健康、修复和功能的重要指标。杯状细胞分泌的黏蛋白在保护肠上皮细胞避免感染及维持肠道黏膜屏障和免疫止血方面扮演着重要角色(McGuckin等,2011)。本研究发现,日粮添加CTS、NSP酶或CTS+NSP酶对空肠绒毛高度和杯状细胞数量均无显著影响。但日粮添加CTS+NSP酶显著降低空肠隐窝深度及显著提高空肠绒毛高度与隐窝深度比值。空肠绒毛发育与动物生长性能密切相关,动物受到细菌感染、应激等影响后,肠绒毛受损,例如绒毛萎缩、隐窝深度增加,降低肠道消化吸收功能,最终造成动物生长受阻(王玉梅等,2006)。日粮中NSP会通过影响肠道微生物区平衡来间接影响小肠壁形态(陈加祥等,2010)。肉鸡采食以大麦为主的日粮,回肠绒毛高度显著低于采食以玉米为主的日粮;在大麦日粮中添加葡聚糖酶和木聚糖酶后,提高绒毛高度与隐窝深度的比值(Engberg等,2004),这与本试验研究结果一致,说明添加NSP酶可以降低日粮中NSP对肠道的损伤,维持肠道完整的结构和功能。
3.4日粮添加CTS和NSP酶对肉鸡盲肠微生物组成的影响 肠道微生物菌群组成是构成消化系统的一个重要部分,其影响动物对营养物质的消化吸收。肠道食糜中大量的NSP会导致肠道有害微生物的大量繁殖,降低动物对营养物质的利用率,改变肠道pH,降低消化酶活性。李成良等(2009)、丁雪梅等(2010)研究发现,肉鸡日粮中添加NSP酶或木聚糖酶可显著增加盲肠乳酸杆菌数量,同时显著降低大肠杆菌数量,这与本试验日粮添加NSP酶对1~42 d肉鸡盲肠微生物组成的影响结果一致。但也有研究报道,在大麦日粮中添加NSP酶增加盲肠大肠杆菌数量,而在小麦日粮中添加NSP酶对大肠杆菌、双歧杆菌和乳酸杆菌的数量均无显著影响(Garry等,2007),研究结果存在差异的原因可能与试验时选用的饲料类型、NSP酶种类和添加比例不同有关。此外,本研究也发现日粮添加CTS较对照组显著降低盲肠大肠杆菌的数量,这与Carolina等(2017)同样使用大麦—小麦型日粮添加CTS在肉鸡上的研究结果一致,但目前关于CTS对肠道微生物组成影响的具体作用机理尚不清楚。
4 结论
在大麦—小麦无抗型日粮中添加壳聚糖和NSP酶可以显著提高1~42 d肉鸡的生产性能,改善空肠组织结构,显著降低盲肠大肠杆菌数量。综合考虑,本试验中150 mg/kg壳聚糖+100 mg/kg NSP酶应用效果最佳。
[1]陈家祥,张仁义,王全溪,等.地衣芽孢杆菌对麻羽肉鸡肠道组织结构及盲肠微生物区系的影响[J].动物营养学报,2010,22(3):757~761.
[2]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995.
[3]丁雪梅,张克英.玉米-杂粕型日粮添加木聚糖酶对肉鸡免疫功能、肠道形态和微生物菌群的影响[J].中国畜牧杂志,2010,46(23):26~30.
[4]冯定远,吴新连.非常规饲料原料的合理使用[J].广东饲料,2001,10(3):13~ 15.
[5]李成良,张海燕.非淀粉多糖酶对肉鸡生产性能、养分利用率及盲肠微生物的影响[J].饲料工业,2009,30(6):11~14.
[6]王冬群,丁雪梅,白世平,等.不同非淀粉多糖复合酶在肉鸡玉米-豆粕型饲粮中的应用效果[J].动物营养学报,2013,25(10):2459~2473.
[7]王玉梅,李朝华,王雪莲.益生菌对肉仔鸡小肠组织结构和生产性能的影响[J].中国兽医科技,2006,11:59~60.
[8]Bedford M R. The effect of enzymes on digestion[J]. The Journal of Applied Poultry Research,1996,5(4):370~ 378.
[9]Carolina P Q,Amelia C,Raquel A,et al.Changes in broiler performance,duodenal histomorphometry,and caeca microbiota composition in response to wheat-barley based diets supplemented with non-antibiotic additives[J]. Animal Feed Science and Technology,2017,234(12):1~ 9.
[10]Choct M,Hughes R J,Wang J,et al.Increased small intestinal fermentation is partly responsible for the anti-nutritive activity of non-starch polysaccharides in chickens[J]. British Poultry Science,1996,37(3):609~ 621.
[11]Danzeisen J L,Kim H B,Isaacson R E,et al.Modulations of the chicken cecal microbiome and metagenome in response to anticoccidial and growth promoter treatment[J].PLoS One,2011,6(11):e27949.
[12]Edwards C. Mechanisms of action on dietary fiber on small intestinal absorption and motility[A]. New Developments in Dietary Fiber[C]. 1990. 95~104.
[13]Elmore S A. Enhanced histopathology of the thymus[J].Toxicologic Pathology,2006,34(5):656 ~ 665.
[14]Engberg R M,Hedemann M S,Steenfeldt S,et al.Influence of whole wheat and xylanase on broiler performance and microbial composition and activeity in digestive tract[J].Poultry Science,2004,83(6):925~ 938.
[15]Garry B P,Fogarty M,Curran T P,et al.The effect of cereal type and enzyme addition on pig performance,intestinal microflora,and ammonia and odour emissions[J].The Animal Consortium,2007,1(5):751~757.
[16]Khambualai O,Yamauchi K,Tangtaweewipat S,et al.Effects of dietary chitosan diets on growth performance in broiler chickens[J].The Journal of Poultry Science,2008,45(3):206~ 209.
[17]Kong X F,Zhou X L,Lian G Q,et al.Dietary supplementation with chitooligosaccharides alters gut microbiota and modifies intestinal luminal metabolites in weaned Huanjiang mini-piglets[J]. Livestock Science,2014,160(2):97 ~ 101.
[18]McGuckin M A,Linden S K,Sutton P,et al.Mucin dynamics and enteric pathogens[J]. Nature Reviews:Microbiology,2011,9(4):1426~1431.
[19]Pozo A L,Godfrey E M,Bowles K M. Splenomegaly:investigation,diagnosis and management[J].Blood Reviews,2009,23(3):105~111.
[20]Razdan A,Pettersson D. Effect of chitin and chitonsan on nutrient digestibility and plasma lipid concentratios in broiler chickens[J].British Journal of Nutrition,1994,72(2):277~ 288.
[21]Rodriguez M L,Rebole A,Velasco S,et all. Wheat and barleybased diets with or without additives influence broiler chicken performance,nutrient digestibility and intestinal microflora[J].Journal of the Science of Food and Agriculture,2012,92(1):184~ 190.
[22]Shi B L,Li D F,Piao X S,et al.Effects of chitosan on growth performance and energy and protein utilization in broiler chickens[J].British Poultry Science,2005,46(4):516 ~ 519.
[23]Tokura S,Tamura H,Azuma I. Immunological aspects of chitin and chitin derivatives administered to animals[J].Experientia Supplementum,1999,87:279~292.
[24]Wu Y B,Ravindran B,Thomas D G,et al.Influence of phytase and xylanase individually or in combination,on performance,apparent metabolizable energy,digestive tract measurements and gut morphology in broilers fed wheat-based diets containing adequate level of phosphorus[J].British Poultry Science,2004,45(1):76~84.
[25]Xiao D F,Tang Z R,Yin Y L,et al.Effects of eitary administering chitosan on growth performance,jejunal morphology,jejunal muscosal sIg A,occludin,claudin-1 and TLR4 expression in weaned piglets challenged by enterotoxigenic Escherichia coli[J].Ineternational Immunopharmacology,2013,17(3):670~ 676.
