肌动蛋白染色协助分析肠上皮增殖和分化的相对定量研究
2022-08-22张如珍王锋超胡先成
张如珍,陈 胜,王锋超,胡先成
(1.重庆师范大学 生命科学学院,重庆 401331;2.陆军军医大学 军事预防医学系,重庆 400038)
0 引言
细胞骨架是一种相互连接的精细结构,主要由肌动蛋白、微管和中间丝组成。其作为膜突出的支架,如微绒毛、纤毛和鞭毛[1]等调节细胞的形态和生理活性。许多上皮细胞,如小肠上皮细胞、肾上皮细胞和支气管上皮细胞具有大量微绒毛[2]。微绒毛数量和结构的异常变化与生理功能有关,如分泌和吸收[3]。此外,肌动蛋白在很多关键的细胞进程中起着重要作用,包括迁移、内吞、细胞内运输、蛋白质和mRNA拼接、附着、信号转导、膜皱褶和胞质分裂等[4],并且它在很大程度上决定了细胞的形状以及细胞质中细胞器的位置和形状[5]。在哺乳动物中,至少有6种肌动蛋白亚型由单独的基因编码,并根据其等电点分为α、β和γ 3类[6]。到目前为止,有关肌动蛋白的研究多集中在其结构和功能上[7],而缺乏利用肌动蛋白在不同细胞中的差异进行形态学和定量学的分析。鉴于肠道上皮细胞独特的细胞组分及结构,本研究旨在通过对肠道隐窝-绒毛细胞β-Actin的免疫荧光染色、蛋白免疫印迹法、流式细胞检测和细胞周期分析,以判断β-Actin在不同肠道细胞中的表达量和表达模式,为利用β-Actin协助区分肠道增殖和分化细胞及细胞周期的分析提供参考。
1 材料与方法
1.1 小鼠和试剂
1.1.1 实验小鼠
C57BL/6J小鼠,雄性,8~10周龄12 只,体重25~30 g,购自成都集萃药康生物科技公司。动物饲养环境SPF级,小鼠饲料喂养,自由食水,自然光暗周期,室温22~25℃。本实验操作均经过陆军军医大学动物伦理学审核通过。
1.1.2 主要试剂和材料
Actin-Tracker Green-488(碧云天货号C2201S)、PE anti-mouse CD24(BioLegend 货号101808)、PE/Cy7 anti-mouse/human CD44(BioLegend 货号103030)、FVD(invitrogen Firable Viability Dye 660 货号65-0864-14)、 Alexa Fluor 647anti-mouse CD45(BioLegend 货号103124)、DAPI(索莱宝)、β-Actin(beyotime 货号:AA128-1)、Akt(beyotime 货号:AA326-1)、PCNA(CST 货号:2586T)、Goat anti-Mouse IgG(H+L)(联科生物 货号:GAM007)、Anti-rabbit IgG (CST 货号:7074S)、BCA试剂(TakaRa 货号:T9300A-1)、免疫印迹一抗稀释液(Beyotime 货号:P0023A)、Super ECL Plus Western Blotting Substrate(葆光生物 货号:BG0001)、PAGE凝胶快速制备试剂盒(10%)(雅酶 货号:PG112升级版)、 T-PERTMTissue Protein Extraction Reagent(Thermo 货号:78510)、TrypLETMExpress(thermo 货号:12604013)、中性甲醛(重庆川东化工)、多聚甲醛(thermo货号305362)、EDTA(碧云天 货号:ST066)、EGTA(国药集团 货号10809717)、Trition X-100(索莱宝 货号T8200)、防脱载玻片。
1.2 样本制备
处死小鼠后取出小肠浸泡于盛有冰冷的PBS缓冲液培养皿中(置于冰上),冲洗干净肠内残余物,纵向剪开小肠,轻柔涮洗小肠内壁,对折后剪取2 cm左右空肠,置入螯合液中(1×解离buffer:EDTA:EGTA 100∶1∶1)于4℃冰箱的在摇床上螯合40 min,而后用玻片刮取肠上皮,用1×PBS吹散,自然沉降,4℃冰箱存放。
1.3 荧光探针染色
将制备好的隐窝绒毛样本使用10%中性甲醛常温固定30 min,而后用1×PBS洗涤3次,自然沉降,而后用0.5%的Triton X-100常温破膜2 h,后用1×PBS洗涤3次,自然沉降,而后用Actin-Tracker Green-488 (1∶200)探针室温染色1h,1×PBS洗涤3次,滴加UEA(1∶100)孵育30 min,洗涤3次,防荧光淬灭剂混匀封片。
1.4 蛋白免疫印迹分析
将收集的隐窝和绒毛结构用RIPA裂解液作用30 min,离心收集上清液,取出10 μL用BCA法进行蛋白定量分析。根据标准曲线公式计算样品蛋白浓度,并将所有蛋白配制成等量关系,然后置于99℃的金属浴中变性10 min,待蛋白冷至室温后,以每孔18 μL的量加入准备好的凝胶中进行电泳(恒压135 V)。之后采用三明治法进行转膜(恒流400 mA),接着用5%脱脂奶粉封闭90 min,配制一抗(β-Actin 1∶5000、Akt 1∶1000、PCNA 1∶1000)在4℃下孵育过夜后用1× TBST洗涤3次,并室温孵育二抗(Goat anti-Mouse IgG(H+L)1∶1000、 Anti-rabbit IgG 1∶1000)90 min,再用TBST洗涤3次,配制化学发光液(1∶1)上机进行曝光分析。
1.5 流式分析
1.5.1 隐窝细胞表面标记染色流式分析
将螯合结束的肠段通过震摇方式分离隐窝绒毛,并通过70 μm滤器过滤,将富集隐窝滤液放入预冷过的4℃离心机上700 rpm离心5 min,弃上清液,向隐窝沉淀中加入1 mL TryPLETM裂解液和250 μL的胰蛋白酶(4∶1),在恒温37℃金属浴中将隐窝裂解成单细胞后终止裂解,1×PBS洗涤3次,1500 rpm离心5 min,100 μL液体重悬后转移至1.5 mL EP管中,分别加入PE Anti-mouse CD24(1∶200)、PE/Cy7 Anti-mouse/human(1∶100)、CD45(1∶1000)荧光抗体以及FVD(1∶500)荧光染料,充分混匀,冰上孵育30 min后洗涤3次,1500 rpm离心5 min,400 μL 1×PBS重悬上机。
1.5.2 隐窝细胞周期流式分析
如上法将制备好的单细胞悬液加入PE Anti-mouse CD24(1∶200)、FVD(1∶500)、CD45(1∶1000)冰上孵育30 min,而后1500 rpm离心5 min,加入400 μL 4% PFA冰上固定30 min,1500 rpm离心5 min,0.1% Triton X-100室温破膜15 min,1500 rpm离心5 min加入DAPI原液400 μL室温染色30 min,洗涤,离心后400 μL 1×PBS重悬后上机。
1.6 数据采集和统计分析
流式数据使用SonyMA900流式分析/分选仪进行样本分析,使用奥林巴斯显微镜进行免疫荧光图片采集。使用ImageJ对蛋白免疫印迹条带进行灰度值测定。使用FlowJoV10版本软件进行流式数据处理,通过流式荧光参数进行Actin定量分析。使用Image-Pro plus 6.0版本对荧光图片进行荧光定量分析,RGB模式选区,其通道阈值分别为R 0~255、G 14~255、B 0~255。通过SPSS 19.0版本进行独立样本t检验统计学分析,以P<0.05认为差异具有统计学意义,运用Graphpad 8.0版本进行统计图绘制。
2 结果
2.1 β-Actin 在隐窝-绒毛结构中的分布
β-Actin作为细胞骨架蛋白在细胞中广泛表达,为探究肠道绒毛-隐窝结构β-Actin分布及表达情况,将获得的隐窝-绒毛结构进行免疫荧光染色(图1A),发现绒毛的荧光强度较强,隐窝的荧光强度相对较弱。通过对其荧光密度进行量化统计,结果表明隐窝和绒毛间β-Actin的表达存在显著差异(P<0.05);为了进一步证实结果的可靠性,通过震摇方法分别富集高纯度的隐窝细胞和绒毛结构(图1B),并进行蛋白免疫印迹分析(图1C),结果同样表明隐窝和绒毛间β-Actin表达存在显著差异(P<0.05),即绒毛β-Actin表达量约是隐窝的1.74倍。
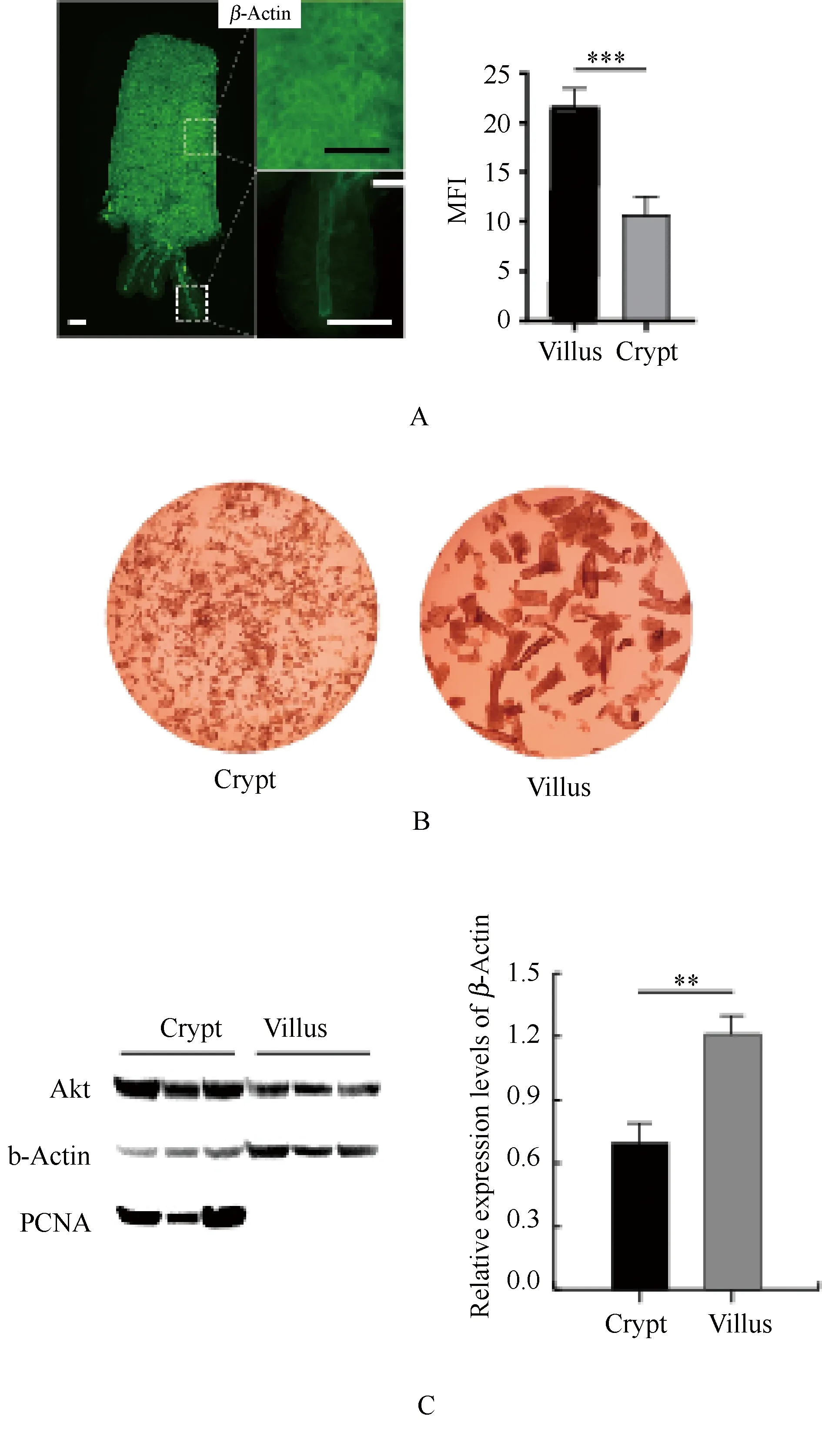
图1 β-Actin在隐窝-绒毛结构中的表达A:小鼠隐窝-绒毛免疫荧光染色,荧光密度定量(P<0.05 T-test(scale bar= 50μm);B:小鼠隐窝和绒毛结构;C:小鼠隐窝-绒毛免疫印迹结果,β-Actin密度定量(P<0.05 T-test)
2.2 UEA染色分析增殖细胞和非增殖细胞β-Actin的表达
鉴于隐窝复杂的细胞组分及隐窝各细胞不同的功能,存在处于增殖和非增殖两种状态的细胞,肠道β-Actin蛋白主要参与肠上皮细胞的形态和迁徙。为了探究隐窝底部细胞β-Actin表达情况,研究发现隐窝底部干细胞龛中存在一群高密度荧光细胞群(图2A),为进一步探究其是否具有增殖能力,我们进行了荆豆凝集素(Ulex Europaeus Agglutinin, UEA)染色,一种分泌系细胞如潘氏细胞(Paneth cells PC)、内分泌细胞(Endocrine cells EEC)和杯状细胞(Goblet cell GC)等染料,以区分干细胞龛增殖与非增殖细胞群。通过荧光强度曲线分析发现,隐窝底部红色荧光区域可见绿色荧光相对较强,提示非增殖的细胞具有更高β-Actin蛋白的表达。
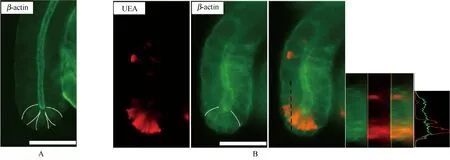
图2 β-Actin在非增殖细胞中高表达(scale bar =50 μm)A:小鼠隐窝免疫荧光染色;B:非增殖细胞与β-Actin免疫荧光共染
2.3 β-Actin 在隐窝和绒毛细胞表达的流式细胞分析
为了进一步定量隐窝-绒毛细胞β-Actin表达情况,选择流式细胞技术对隐窝和绒毛进行定量分析。通过分别制备绒毛、隐窝细胞单细胞悬液,在保证染色条件相同前提下,经过β-Actin荧光探针染色后通过流式细胞技术对隐窝和绒毛细胞进行荧光定量分析,如图3A所示,隐窝细胞荧光跨度较大,提示隐窝细胞中各细胞成分之间存在增殖、分化及功能上的较大差异。作为分化后的绒毛细胞β-Actin表达相对集中,进一步提示增殖细胞相较于非增殖细胞的低表达β-Actin的结论。但就细胞的平均表达量而言(图3B),绒毛细胞β-Actin表达量是隐窝细胞均值的1.46倍,这种差异性提示β-Actin作为整个肠上皮蛋白内参的局限性[8],同时,也可为内参校正提供参考。
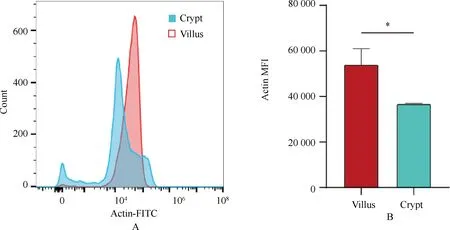
图3 β-Actin蛋白在绒毛细胞和隐窝细胞表达比较A:隐窝和绒毛细胞的荧光密度峰图;B:隐窝和绒毛细胞荧光密度定量图(流式荧光定量分析 *P<0.05 T-test)
2.4 CD24表面标记区分下的各谱系细胞β-Actin表达的流式分析
隐窝细胞成分包含干细胞、前体细胞和分化后细胞,通过CD24表面标记可实现隐窝细胞成分的区分[9],如图4A所示。通过SSC-A和CD24流式参数将隐窝细胞分为潘氏细胞、内分泌细胞、增殖细胞以及其他分化细胞,通过对其荧光定量分析发现(图4B、4C)各细胞系间存在β-Actin表达上的差异,其中Paneth细胞β-Actin表达量分别是内分泌细胞的1.46倍、增殖细胞的2.49倍,与成像结果非增殖细胞表达较高相一致,而内分泌细胞是增殖细胞的1.7倍,这些结果提示,β-Actin蛋白在分化后分泌细胞中具有更高表达量,可能参与了细胞分化和相关功能的执行。
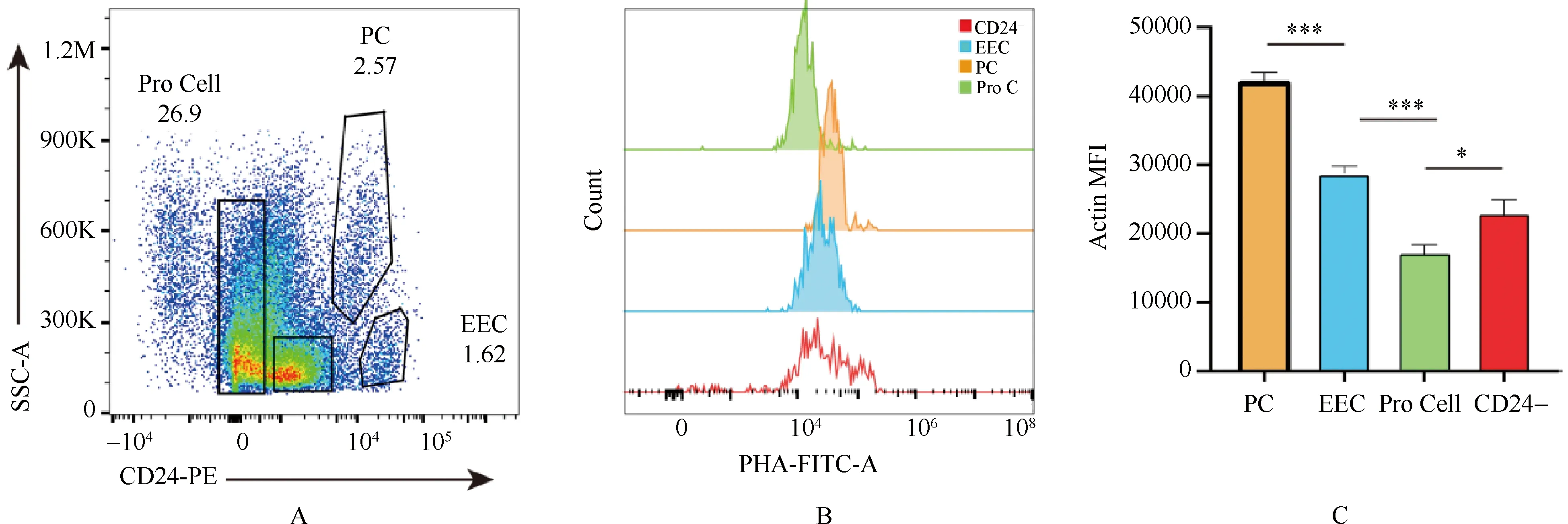
图4 β-Actin在增殖细胞、内分泌细胞、Paneth细胞中表达情况A:隐窝细胞CD24染色细胞分群(Progenitor cells, Pro Cells);B:隐窝细胞β-Actin表达荧光峰图;C:隐窝细胞β-Actin表达荧光定量分析柱状图(流式荧光定量分析 *P<0.05 T-test)
2.5 β-Actin表达与细胞周期的关系
肠道隐窝细胞是一群快速增殖的细胞,干细胞分化后通过TA(transient amplifying)区域快速扩增来确保绒毛细胞的更新换代。这种快速的增殖和迁徙势以及分化势必会引起细胞骨架蛋白的表达变化,为探究隐窝细胞β-Actin与细胞周期的关系,对不同β-Actin表达的细胞群进行周期分析。如图5A所示,隐窝细胞呈现出不同β-Actin表达量的细胞群,通过β-Actin-H和β-Actin-L细胞群周期分析发现(图5B、5C),β-Actin-H细胞主要处于G0/G1期,约占整个细胞群80%以上,与β-Actin-L细胞群(约占整个细胞群的50%~60%)具有显著差异,这种周期上的差异表明,β-Actin在细胞增殖过程中为维持自身骨架重构的流动性而处于相对低表达状态,一旦细胞停止增殖走向分化,将伴随骨架蛋白的表达增高,以维持细胞结构的稳定和功能的发挥。
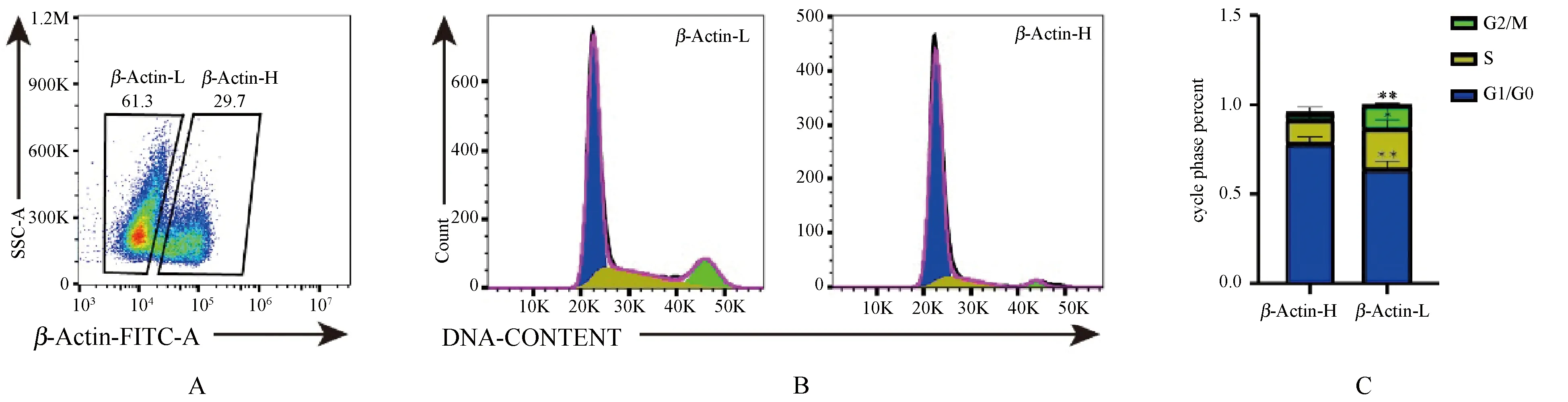
图5 隐窝细胞β-Actin表达水平不同的细胞的细胞周期分析A:隐窝细胞鬼笔环肽染色后细胞分群;B、C:不同β-Actin表达水平细胞的细胞周期分析(*P<0.05 T-test)
3 讨论
肠道是哺乳动物重要的消化、吸收、排泄、免疫和内分泌器官,肠道上皮的更新依靠位于隐窝底部肠道干细胞的增殖分化来实现[10]。肠道干细胞扩增后通过向上迁移至绒毛顶端最后脱落至肠腔,在3~5天内完成肠上皮细胞的一次更新过程[11]。肠道干细胞关键细胞事件离不开细胞骨架的作用。细胞骨架是细胞在分裂、生长和发育过程中发生变化的动态结构[12]。肌动蛋白丝、微管和中间丝是哺乳动物细胞骨架的主要成分。肌动蛋白丝代表在分化过程中经历广泛重塑的细胞骨架系统,是负责细胞刚度和韧性的细胞骨架的主要组成部分[13]。
本研究免疫荧光染色结果显示,隐窝β-Actin的表达量低于绒毛的,与蛋白免疫印迹结果一致。原因可能为处于未分化状态的细胞形态需要处于一个动态变化的过程,以适应关键细胞增殖和分化进程的发生;此时肌动蛋白丝处于解聚状态,在细胞中形成不连续的网络结构,故增殖细胞中β-Actin的表达量低于分化细胞的[14]。另外,通过隐窝细胞流式细胞检测结果显示,隐窝底部Paneth细胞β-Actin的表达量较其他隐窝细胞高,揭示了处于高度活跃增殖状态的细胞其β-Actin的表达量最低。研究表明,动物细胞在进行胞质分裂事件,即处于中后期时,肌动蛋白丝开始聚集在细胞质中各细胞器的周围并参与形成中央纺锤体及收缩环,相互间形成丰富的网络结构,以完成最后的胞质分裂事件[14]。本实验结果中也发现类似的现象:流式细胞周期结果显示,大部分处于G0/G1期的细胞和少量G2/M期的细胞,β-Actin的荧光密度较强(未发表数据)。这些结果提示在整个细胞周期中,处于活跃的细胞分裂时期,细胞形态的变化较大,故需要相关骨架蛋白成分发生较大的变动使细胞骨架阵列的重排,来满足细胞分裂所需的形态学改变和细胞极化[15-16]。
本研究完成了对隐窝-绒毛细胞群β-Actin相对定量分析,测量出隐窝-绒毛细胞的β-Actin平均表达量差异比值,这一结果可为β-Actin作为内参蛋白在研究绒毛-隐窝蛋白表达量时提供校正依据。同时,利用流式细胞技术进一步分析肠道各细胞群包括前体细胞、潘氏细胞和内分泌细胞的β-Actin蛋白表达相对定量值,揭示了肠道隐窝细胞群β-Actin蛋白表达上的差异,而这种差异致使在选用β-Actin蛋白作为内参时不可避免的产生误差,因为在某些模型和疾病条件下隐窝细胞成分是存在差异的[17],即使不同肠段细胞成分占比也存在明显差异[18],而本文相对定量研究结果可为研究小肠上皮隐窝细胞β-Actin蛋白作为内参提供校正加权值。另外,在β-Actin与周期分析中揭示了β-Actin的表达可能与细胞的增殖活性有关,处于高度增殖活性的细胞,其细胞骨架处于一个高度动态重组状态,以适应细胞形态变化,并完成细胞增殖分化的关键细胞进程。同时,也提示当细胞退出细胞周期可能需要β-Actin蛋白来稳定细胞骨架参与隐窝细胞终末分化。鉴于这一结果,肌动蛋白染色和定量分析在一定程度上可以作为一种标记来协助对肠上皮细胞增殖和分化状态进行区分,甚至可以结合流式细胞技术,测算隐窝细胞中成熟分泌系细胞的比例,这都为研究肠上皮增殖和分化机制以及相关疾病模型提供了新的方法。接下来,我们将把注意力集中在β-Actin蛋白和骨架调控在肠干细胞和前体细胞分化中的具体作用上,为了解肠上皮组织再生和癌症发生等病理现象提供新的数据。
