肝切除、射频消融和肝移植三种方案治疗小肝癌的临床疗效比较*
2018-04-09矫学黎陈建锋
矫学黎,陈 燚,李 霞,陈建锋
原发性肝癌是最常见的恶性肿瘤之一,为全球第5位常见恶性肿瘤,占恶性肿瘤死亡的第3位[1,2]。其中小肝癌(小肝细胞癌)及微小肝癌恶性程度较低,发生转移的可能性较小,治疗方法较多,治疗效果也较好[3]。目前小肝癌的根治性治疗措施主要为肝切除和肝移植术,射频消融对于选择的病例能达到根治性切除的效果。笔者回顾分析所在医院2006年1月—2015年12月连续开展的660例小肝癌的治疗资料,评价肝切除、射频消融以及肝移植3种治疗方案的临床疗效。
1 资料与方法
1.1一般资料 选取2006年1月—2015年12月笔者所在医院治疗的所有符合《中华医学会原发性肝癌诊疗规范(2011版)》[4]的原发性小肝癌病例882例,收集符合纳入标准的病例862例,其中失访165例,失访率19.37%,采用其他方法治疗37例,实际纳入该研究的病例为660例,其中行肝切除352例,射频消融271例,肝移植37例。按肿瘤直径和数目分为4个试验组,分别为0~2.0 cm、2.1~3.0 cm、3.1~5.0 cm和多发组。见表1。

表1 660例小肝癌一般资料
1.2治疗方法
1.2.1肝切除手术方法 切缘距离肿瘤≥1 cm或行肝段、半肝切除。运用超声乳化吸引刀分离肝组织,用双极电凝、氩气刀、连发钛夹或结扎止血。肝硬化患者采用Pringe's手法阻断第一肝门。
1.2.2射频消融手术方法 采用美国Radionics射频消融系统进行。术中超声引导下将电极针经皮经肝穿刺进入瘤体深面。消融区域要求超过瘤体边缘0.5~1 cm,每个位点治疗时间约为 10~15 min,电极温度约为105℃。多发病灶可多次射频消融。射频消融也可作为肿瘤复发的治疗办法。
1.2.3肝移植手术方法 采用改良背驮式原位肝移植术,切除病肝,保留肝后下腔静脉。将修剪好的供肝原位植入受者体内,将供肝肝后下腔静脉与受体下腔静脉做侧侧吻合。再依次端端吻合门静脉、肝动脉和胆总管。胆总管内一般不放置T形管。术后常规给予免疫抑制药治疗。
1.3随访 利用电话、书信、电子邮件、网站以及来院检查等途径进行随访。所有病例随访至术后6~36个月,除非患者死亡、失联或者退出。所有检查均在笔者所在医院进行。
1.4观察指标 观察患者的整体生存时间、整体生存率、无瘤生存时间以及无瘤生存率。
1.5统计学处理 所有数据均采用SPSS 17.0软件进行分析,计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用LSD法;生存曲线用乘积极限法(Kaplan-meier)绘制,组间差异采用对数秩 (Log-rank)检验,两两比较采用Pairwise comparison法。当P<0.05时差异有统计学意义。
2 结果
2.1各处理组间整体生存率对比
2.1.10~2.0cm组各处理组整体生存Kaplan meier曲线 肝切除组3年整体生存率为67.16%,射频消融组3年整体生存率为63.00%,肝移植组3年整体生存率为100%。两两比较发现肝切除组与射频消融组差异无统计学意义(P>0.05),肝切除组与肝移植组差异有统计学意义(p<0.05),射频消融组与肝移植组差异有统计学意义(p<0.05)。 见图1。
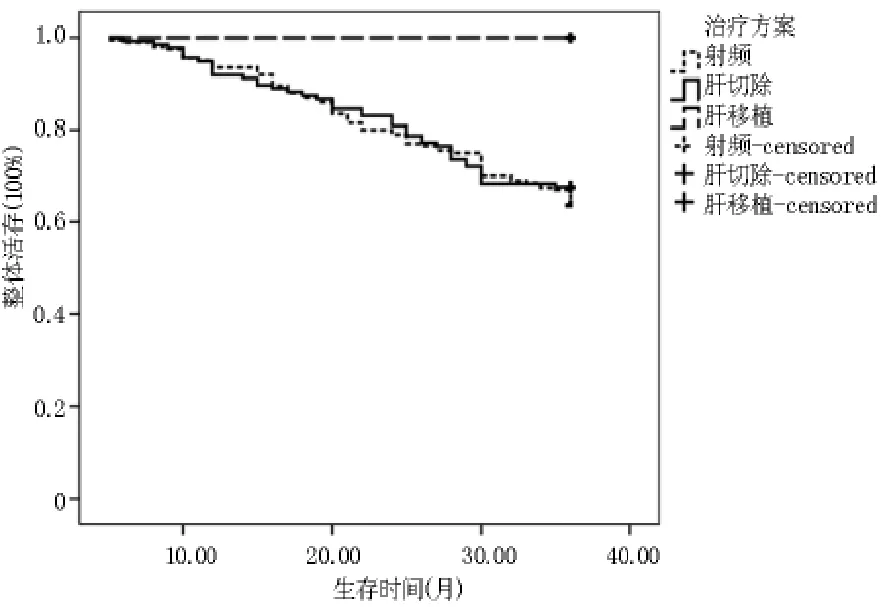
图1 0~2.0 cm组各处理组整体生存Kaplan meier曲线
2.1.22.1~3.0 cm 组 各 处 理 组 整 体 生 存 Kaplan meier曲线 肝切除组3年整体生存率为61.41%,射频消融组3年整体生存率为56.80%,肝移植组3年整体生存率为100%。两两比较发现肝切除组与射频消融组差异无统计学意义(P>0.05),肝切除组与肝移植组差异有统计学意义(p<0.01),射频消融组与肝移植组差异有统计学意义(p<0.01)。 见图2。
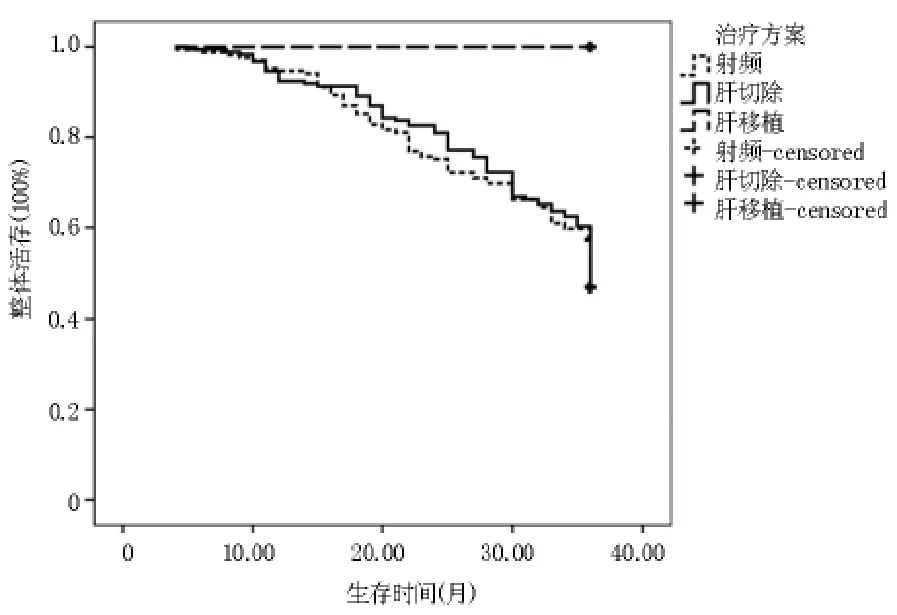
图2 2.1~3.0 cm组各处理组整体生存Kaplan meier曲线
2.1.33.1~5.0 cm 组 各 处 理 组 整 体 生 存 Kaplan meier曲线 肝切除组3年整体生存率为50.56%,射频消融组3年整体生存率为30.56%,肝移植组3年整体生存率为92.00%。两两比较发现肝切除组与射频消融组差异有统计学意义(p<0.01),肝切除组与肝移植组差异有统计学意义(p<0.01),射频消融组与肝移植组差异有统计学意义(p<0.01)。见图3。
2.1.4多发组各处理组整体生存Kaplan meier曲线 肝切除组3年整体生存率为6.15%,射频消融组3年整体生存率为8.77%,肝移植组3年整体生存率为72.73%。两两比较发现肝切除组与射频消融组差异无统计学意义(P>0.05),肝切除组与肝移植组差异有统计学意义(p<0.01),射频消融组与肝移植组差异有统计学意义(p<0.01)。 见图4。
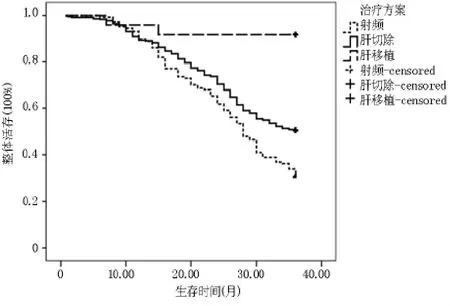
图3 3.1~5.0 cm组各处理组整体生存Kaplan meier曲线

图4 多发组各处理组整体生存Kaplan meier曲线
2.2各处理组无瘤生存率对比
2.2.10~2.0 cm组各处理组无瘤生存Kaplan meier曲线 肝切除组3年无瘤生存率为57.50%,射频消融组3年无瘤生存率为53.50%,肝移植组3年无瘤生存率为100%。两两比较发现肝切除组与射频消融组差异无统计学意义(P=0.593),肝切除组与肝移植组差异有统计学意义(P=0.018),射频消融组与肝移植组差异有统计学意义(P=0.012)。见图5。

图5 0~2.0 cm组各处理组无瘤生存Kaplan meier曲线
2.2.22.1~3.0cm 组各处理组无瘤生存 Kaplan meier曲线 肝切除组3年无瘤生存率为56.00%,射频消融组3年无瘤生存率为45.00%,肝移植组3年无瘤生存率为100%。两两比较发现肝切除组与射频消融组差异无统计学意义(p<0.05),肝切除组与肝移植组差异有统计学意义(p<0.01),射频消融组与肝移植组差异有统计学意义(p<0.01)。 见图6。
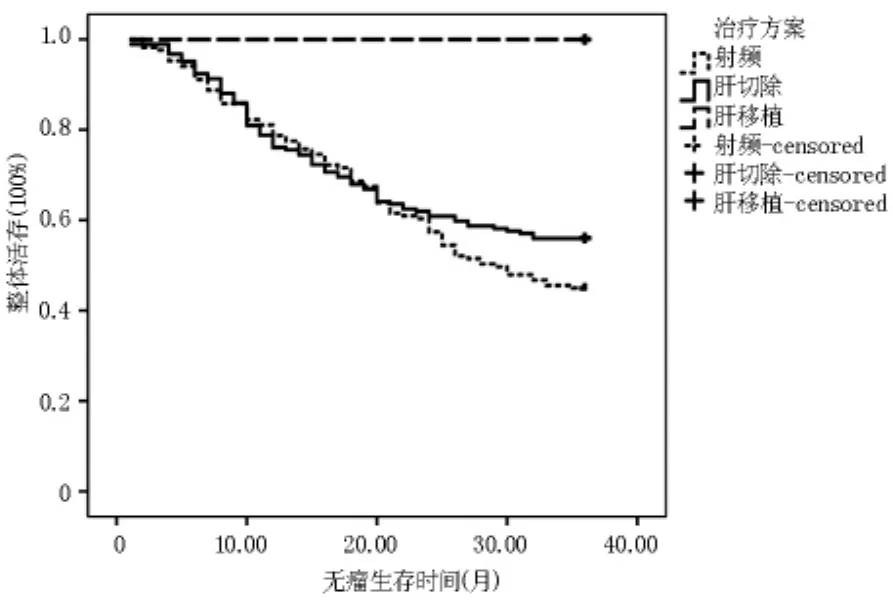
图6 2.1~3.0 cm组各处理组无瘤生存Kaplan meier曲线
2.2.33.1~5.0cm 组各处理组无瘤生存 Kaplan meier曲线 肝切除组3年无瘤生存率为40.80%,射频消融组3年无瘤生存率为23.60%,肝移植组3年无瘤生存率为91.70%。两两比较发现肝切除组与射频消融组差异有统计学意义(p<0.01),肝切除组与肝移植组差异有统计学意义(p<0.01),射频消融组与肝移植组差异有统计学意义(p<0.01)。 见图7。
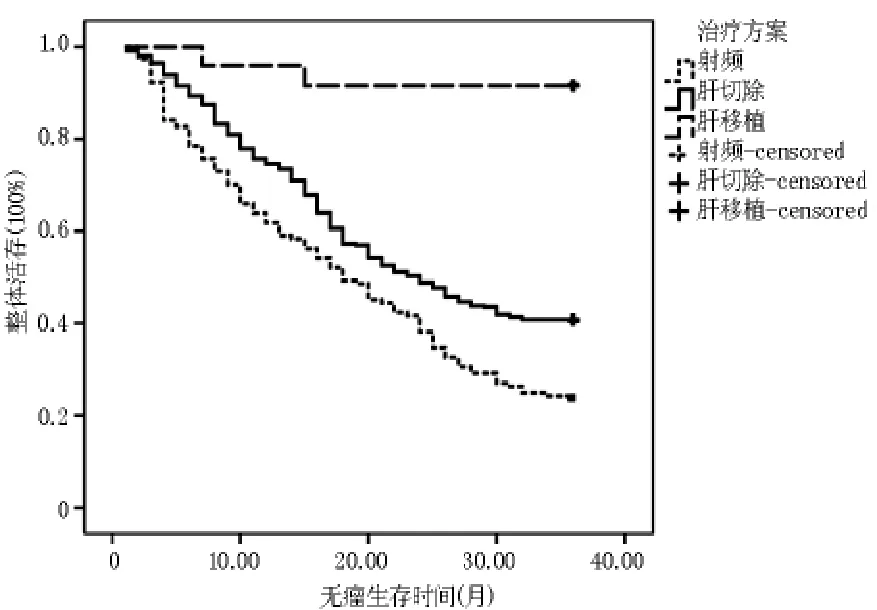
图7 3.1~5.0 cm组各处理组无瘤生存Kaplan meier曲线
2.2.4多发组各处理组无瘤生存Kaplan meier曲线 肝切除组3年无瘤生存率为4.60%,射频消融组3年无瘤生存率为5.30%,肝移植组3年无瘤生存率为83.30%。两两比较发现肝切除组与射频消融组差异无统计学意义(P>0.05),肝切除组与肝移植组差异有统计学意义(p<0.01),射频消融组与肝移植组差异有统计学意义(p<0.01)。 见图8。

图8 多发组各处理组无瘤生存Kaplan meier曲线
3 讨论
目前肝癌的主要治疗方式包括肝移植、肝切除、射频消融、TACE、PEI等,理论上讲肝移植是肝癌最有效的治疗手段[5-7],自20世纪90年代以来,国内肝移植技术取得突飞猛进地发展,但是肝源匮乏、等待期高丢失率以及巨额成本极大地限制了肝移植的临床应用[8]。
肝切除目前仍是肝癌诊疗规范中推荐的小肝癌首选治疗方案,具有普及率高、无瘤生存期长、复发率低等优势,并且可以切除在同一解剖区域内的多病灶、微小病灶和癌栓[9]。
射频消融范围应力求保证包括0.5 cm的癌旁组织,以获得“安全边缘”,彻底杀灭肿瘤,近10年来在小肝癌的治疗方面效果较好,能获得类似肝切除的根治效果,同时因其具有恢复快、出血量少、住院时间短、花费少、痛苦小、对肝储备功能要求较低等诸多优点,应用也越来越广泛[10,11]。
现在普遍认为射频消融治疗直径≤5 cm的单发肿瘤或最大直径≤3 cm的3个以内多发结节的肝癌可达到根治的效果,但是射频消融与肝切除在根治效果方面的比较存在较大差异。周铁等[12]报道射频消融与肝切除在术后第1年和第3年总生存率相似,但肝切除在术后1年和3年肿瘤复发率构成比方面低于射频消融。Chen等[13]报道射频消融和肝切除在术后第1年和第3年总生存率和无瘤生存率方面相似,差异无统计学意义。而Xu等[14]报道射频消融无论在第1年和第3年的总生存率还是无瘤生存率均不如肝切除组。Vivarlli等[15]报道肝功能为Child A的早期肝癌患者,射频消融在3年生存率方面不如HR组,但是对Child B级患者,两组差异无统计学意义。
该研究将小肝癌患者按肿瘤直径及数目进一步分为4组,即0~2.0 cm、2.1~3.0 cm、3.1~5.0 cm和多发组,比较各试验组的整体生存率及无瘤生存率。研究发现当单发肿瘤直径0~3.0 cm时,肝移植效果最佳,肝切除和射频消融的疗效相当,考虑肝移植的种种限制条件,在不能行肝移植的患者中,由于射频消融的微创优势,性价比也较高,应为首选治疗方案。当单发肿瘤直径在3.1~5.0 cm时,仍然是肝移植效果最佳,肝切除次之,而射频消融效果最差,其3年的整体生存率和无瘤生存率与肝移植、肝切除之间差异有统计学意义,这可能是由于直径较大的肝癌病灶存在影像学尚不能显示的微小子灶,因而造成射频消融治疗的遗漏。因而在不能行肝移植的患者中,应当首选肝切除。在多发肿瘤组中,肝移植效果依然最佳,肝切除和射频消融效果都很差,其3年的整体生存率和无瘤生存率均不理想,明显低于肝移植,这可能与肿瘤的早期肝内播散和多中心起源有关,因其还在米兰标准内,应尽量行肝移植治疗。
[1] MAGDY HA,SHAHIRA AE.Guide for diagnosis and treatment of hepatocellular carcinoma[J].World J Hepatol,2015,7(12):1632-1651.
[2] SONIA P,IVáN H,JAVIER I.New advances in hepatocellular carcinoma[J].World J Hepatol,2016,8(9):421-438.
[3] ASMAA IG,IMAM W.Recent advances in multidisciplinary management of hepatocellular carcinoma[J].World J Hepatol,2015,7(4):673-687.
[4]中华人民共和国卫生部.原发性肝癌诊疗规范(2011版)[J].临床肿瘤学杂志,2011,16(10):929-946.
[5] CLAIRE F,RONALD WB,ALI Z.A Surgical Perspective on Targeted Therapy of Hepatocellular Carcinoma[J].Diseases,2015,3(4):221-252.
[6] HYUNG JY,SANG JS,SOON HU.Current management of hepatocellular carcinoma:An Eastern perspective[J].World J Gastroenterol,2015,21(13):3826-3842.
[7] ROBERT W,CATHERINE F.Updates in the Management of Hepatocellular Carcinoma[J].Gastroenterol Hepatol,2011,7(1):16-24.
[8] JAMES FT.Controversies in Liver Transplantation[J].Gastroenterol Hepatol,2017,13(2):133-135.
[9] CHEN PD,WU CY,WU YM.Expanding the selection criteria of laparoscopic hepatectomy for hepatocellular carcinoma[J].Chin J Cancer Res,2014,26(4):360-361.
[10] ASHIL JG,PAUL M,PATRICIA DJ.Advances and Future Directions in the Treatment of Hepatocellular Carcinoma[J].Gastroenterol Hepatol,2017,13(7):398-410.
[11] GIULIANTE.Liverresection forhepatocellularcarcinoma≤3cm:results of an Itatian mulricenter study on 588 patients[J].J Am Collsurg,2012,215(2):244-254.
[12]周铁,仇毓东,孔文韬.小肝癌射频消融和肝切除的比较[J].肝胆外科杂志,2012,15(6):424-427.
[13] CHEN MS,LI JQ,ZHENG Y,et al.A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma[J].Ann Surg,2006,243(3):321-328.
[14] XU G,QI FZ,ZHANG JH,et al.Meta-analysis of surgical resection and radiofrequency ablation for early hepatocellular carcinoma[J].World J Surg Oncol,2012,10:163.
[15] VIVARELLI M,GUGLIELMI A,RUZZENENTE A,et al.Surgical resection versus percutaneous radiofrequency ablation in the treatment of hepatocellular carcinoma on cirrhotic liver[J].Ann Surg,2004,240(1):102-107.
