口蹄疫病毒O型抗体液相阻断ELISA试验的测量不确定度评估
2018-04-09杜鹃
杜 鹃
(北京市动物疫病预防控制中心,北京 102629)
测量不确定度是与测量结果关联的一个参数,用于表征合理赋予被测量值的分散性。测量结果的可信程度在很大程度上取决其不确定度的大小。1993 年由 ISO、IEC 和 IFCC 等 7个国际组织批准发布了《测量不确定度表示指南》(GUM),并于2008年最新修订[1]。1999年我国在等同采用GUM 的基础上,也发布实施了《测量不确定度评定与表示》,并于2012年最新修订[2]。近年来,不确定度概念逐渐引入兽医实验室检测领域。世界动物卫生组织(OIE)《陆生动物诊断试验和疫苗手册》[3]中也对测量不确定度提出了要求。
ELISA 具有快速、灵敏和高通量等特点,且无需昂贵仪器,是目前基层兽医检测部门应用的主要方法。本文对口蹄疫病毒O型抗体液相阻断ELISA试验的测量不确定度进行研究,希望能探索一种较为合理的ELISA检测结果不确定度评估模式,并为兽医实验室开展相关工作提供借鉴。
1 材料和方法
1.1 样品
口蹄疫病毒O型抗体阳性、阴性血清:中国农业科学院兰州兽医研究所提供。
1.2 试剂
口蹄疫病毒O型抗体液相阻断ELISA检测试剂盒:批准文号为(2006)新兽药证字42号,中国农业科学院兰州兽医研究所生产,有效期内使用。
1.3 仪器
酶标仪:型号sunrise,瑞士Tecan公司产品;移液器:单通道、多通道各量程数把,Eppendorf公司产品。
1.4 检测方法
应用液相阻断ELISA技术,检测牛、羊或猪等偶蹄动物血清中口蹄疫病毒O型抗体。
2 结果与分析
2.1 数学模型
根据中国农业科学院兰州兽医研究所口蹄疫病毒O型抗体液相阻断ELISA检测试剂盒说明书提供的检测结果计算及判定方法,建立数学模型:

其中,B为cutoff临界值与样品判定浓度的OD450mm值的比值(影响结果判定的样品稀释倍数为1:64和1:128,故样品判定浓度为1:64和1:128);C.O.为cutoff临界值;S为样品判定浓度的OD450mm值。

其中,ˉAg为抗原对照的OD450mm均值(4孔阳性对照,弃去最高和最低的OD450mm值,剩余2孔的平均OD450mm值)。
合并以上公式得:

2.2 不确定度来源分析
测量不确定度评定分为:A类评定,即重复样本检测引入的不确定度(uA);B类评定,即所有可能影响测量结果的因素,从人员、设备、材料、方法、环境及被测量对象等几个方面全面考虑,不可遗漏,也不可重复。根据检测方法原理发现,影响cutoff 临界值与样品判定浓度的OD450mm值比值(B)的因素有:试剂盒的稳定性,移液器加样量,各步骤反应时间、反应温度,洗板的清洗程度和酶标仪的测量等。但本实验室使用同批次试剂盒,严格控制各步骤反应时间在±2 min 范围内,反应温度在±1 ℃范围内,并严格使用同型号、同参数设定的洗板机洗板,通过试验发现经严格控制这些因素后,其对检测结果的影响较小,故本文不考虑其引入的不确定度。综合上述不确定度来源的分析和建立的数学模型,认为cutoff 临界值与样品判定浓度的OD450mm值的比值的不确定度来源主要包括:(1)抗原对照的OD450mm均值(ˉAg)的不确定度uAg;(2)检测样品判定浓度的OD450mm值(S)的不确定度us。
2.2.1抗原对照OD450mm均值(ˉAg)的不确定度(uAg)来源 根据检测原理、试剂盒说明书和试剂确认试验分析,发现抗原对照OD450mm均值(ˉAg)的不确定度主要由以下分量贡献:(a)抗原对照的A类不确定度(uA1);(b)抗原工作浓度引入的不确定度(uC1);(c)抗原加样量引入的不确定度(uV1);(d)口蹄疫病毒O型豚鼠抗体工作液加样量引入的不确定度(uV3);(e)兔抗豚鼠IgG-HRP工作液加样量引入的不确定度(uV4);(f)酶标仪的测量不确定度(uE)。
2.2.2检测样品判定浓度的OD450mm值(S)的不确定度(uS)来源 根据检测原理、试剂盒说明书和试剂确认试验分析,检测样品判定浓度的OD450mm值(S)的不确定度主要由以下分量贡献:(a)检测样品的A类不确定度(uA2);(b)抗原工作浓度引入的不确定度(uC1);(c)样品判定浓度引入的不确定度(uC2);(d)抗原抗体混合液加样量引入的不确定度(uV2);(e)口蹄疫O型豚鼠抗体工作液加样量引入的不确定度(uV3);(f)兔抗豚鼠IgG-HRP工作液加样量引入的不确定度(uV4);(g)酶标仪的测量不确定度(uE)。
2.3 测量不确定度评定
2.3.1抗原对照OD450mm均值的A类不确定度评定uA1是由抗原对照的重复检测引入的不确定度。5个工作浓度抗原对照,根据《测量不确定度要求的实施指南》(CNAS—GL05:2011)[4],按公式(4)计算重复测试引起的uA1。其中,S(xi)为样品重复检测的标准差;xi为每次重复的测量值;ˉX为重复测量值的平均值;n为重复次数。uA1计算结果见表1。


表1 抗原对照OD450mm均值的A类不确定度评定
2.3.2检测样品判定浓度的OD450mm值的A类不确定度评定uA2是由样品重复检测引入的不确定度。对5个重复样品血清,分别进行倍比稀释,取1:64/1:128稀释倍数下的5个重复测量数值,根据CNAS—GL05:2011,由公式(4)计算重复测试引起的uA2。计算结果见表2。

表2 检测样品判定浓度的A类不确定度评定
2.3.3移液器加样引入的不确定度(uV)
2.3.3.1移液器容量误差引入的不确定度 《移液器检定规程》[5-6]要求:50 μL 移液器在25、50 μL检定点的容量允许误差a分别为±4.0%、±3.0%;1 000 μL移液器在500、1 000 μL检定点的容量允许误差a均为±1.0%。按矩形分布计算,根据公式(5)计算得出:uV25-P=0.023 094(μL);uV50-P=0.017 321(mL);uV500-P=uV1000-P=0.005 773(μL)。

2.3.3.2环境温度对水体积效应引入的不确定度 移液器在20 ℃下检定,假设实验室温度在20 ℃±4 ℃之间波动(a=4),水的膨胀系数(r)为2.1×10-4/℃,按矩形分布计算,根据公式(6)计算得出:uV25-T=0.012 124(μL);uV50-T=0.024 249(μL);uV500-T=0.242487(μL);uV1000-T=0.484 974(μL)。

容量误差和温度-体积效应引入的不确定度相互独立,故移液器加样引入的不确定度根据公式(7)计算得出:=0.485 008(μL)。根据试剂盒说明书:抗原对照转板加样量、抗原抗体混合液转板加样量、口蹄疫O型豚鼠抗体工作液加样量、兔抗豚鼠IgG-HRP工作液加样量均为50 μL /孔,故uV1=uV2=uV3=uV4=uV50=0.029 803(μL)。

2.3.4抗原工作浓度引入的不确定度uC1抗原工作浓度(1:15)配制过程为:500 μL抗原中加7 000 μL PBST(分7次,1 000 μL/次)。抗原工作浓度(C1)根据公式(8)计算;抗原工作浓度的不确定度根据公式(9)计算:


2.3.5样品判定浓度(抗原抗体混合液)引入的不确定度uC2检测样品稀释过程:25 μL待检血清中加75 μL PBST(分25、50 μL加),混匀取50 μL混合液、50 μL PBST(判定浓度1:64时此步骤重复3次;判定浓度1:128时此步骤重复4次),取50 μL混合液,然后加入50 μL抗原工作液。样品判定浓度根据公式(10、11)计算;样品判定浓度引入的不确定度可由公式(9)计算:

2.3.6酶标仪的测量不确定度uE酶标仪(SUNRISE)的校准证书给出,示值稳定性为0.001,吸光度重复性为0.1%(标准为1.0),通道差异为0.006。依据经验假设酶标仪测量的吸光度值、吸光度重复性、通道差异等均匀地落在其区间内,按矩形分布计算,示值稳定性引入的不确定度=0.000 289;吸光度重复性引入的不确定度:uE2==0.000 289;通道差异引入的不确定度:uE3=酶标仪(SUNRISE)的校准证书给出,吸光度示值误差0.2~0.5:U=0.018(k=2);1.0~1.5:U=0.020(k=2);检定用滤光片标准物质吸光度(0.2~1.5):U=0.010×A(k=2),则吸光度示值误差引入的标准不确定度检定用滤光片标准物质引入的标准不确定度uE6=由于各标准不确定度分量互不相关,故酶标仪的测量标准不确定度(uE)为:
2.3.7评定合成抗原对照OD450mm均值测算引入的不确定度(uAg) 评定合成抗原对照OD450mm均值的测量不确定度,各不确定度分量的灵敏系数通过实验确定。结果见表3。由于各标准不确定度分量互不相关,抗原对照OD450mm均值测算引入的测量不确定度

表3 uAg的各不确定度分量的灵敏系数
2.3.8评定合成样品判定浓度的OD450mm值检测引入的测量不确定度(uS) 评定合成检测样品判定浓度的OD450mm值的测量不确定度,各不确定度分量的灵敏系数通过实验确定。结果见表4。由于各标准不确定度分量互不相关,故待检样品判定浓度的OD450mm值检测引入的测量不确定度为:待检样品判定浓度为1:64时

待检样品判定浓度为1:128时


表4 uS的各不确定度分量的灵敏系数
2.3.9评定合成cutoff 临界值与样品判定浓度的OD450mm值的比值(B)的不确定度 根据公式(3),cutoff 临界值与样品判定浓度的OD450mm值的比值(B)的不确定度可由公式(12)计算。本次检测抗原对照(弃去最高和最低孔后)的OD450mm均值为1.582,cutoff临界值为0.791,样品稀释倍数1:64的OD450mm值为0.156,稀释倍数1:128的OD450mm值为0.569,故本例样品判定浓度为1:128,cutoff临界值与样品判定浓度的OD450mm值的比值为1.390 158。将检测数据和各标准不确定度分量代入公式(12),得到cutoff 临界值与样品判定浓度的OD450mm值的比值(B)的标准不确定度为:
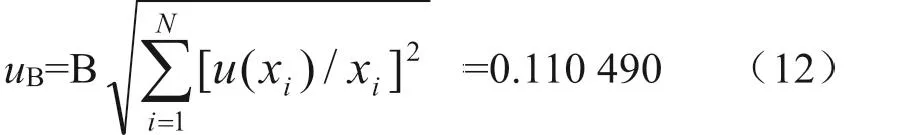
2.4 扩展不确定度评定
扩展不确定度按照公式(13)计算。取k=2,则本例样品cutoff 临界值与样品判定浓度的OD450mm值的比值的扩展不确定度为:U=kuB=2×0.110 490=0.220 980,进行数字修正后U=0.221。

2.5 测量结果表示
本例样品cutoff 临界值与样品判定浓度的OD450mm值的比值的检测结果和扩展不确定度为:B=1.390;U=0.221;k=2。
3 讨论
3.1 检测结果的判定
根据试剂盒说明书中血清抗体效价及结果判定:被检血清OD450mm值大于临界值的孔为阴性孔,小于等于临界值的孔为阳性孔。若临界值与稀释倍数最高阳性孔的OD450mm值相同,则以被检血清阳性孔的最高稀释倍数作为该份血清的抗体效价;若临界值处于两个稀释孔OD450mm值之间,抗体效价取相邻阳性孔和阴性孔稀释倍数的反对数值中间值。抗体效价大于或等于1:128判为口蹄疫O型抗体阳性;1:64~1:128时,判为可疑;小于1:64,判定为阴性。对可疑血清样品,可以重测。重测抗体效价大于或等于1:128,判为阳性,小于1:128,判为阴性。
即临界值大于等于被检血清稀释倍数1:128的OD450mm值时判定为阳性;临界值在被检血清稀释倍数1:64与1:128的OD450mm值之间时判为可疑;临界值小于被检血清稀释倍数1:64的OD450mm值时判定为阴性。对可疑样品可以重测。临界值大于等于被检血清稀释倍数1:128的OD450mm值时判定为阳性;临界值小于被检血清稀释倍数1:128的OD450mm值时判定为阴性。因此建立数学模型公式(1)。结果判定为:临界值更接近样品稀释倍数1:128的OD450mm值时,样品判定浓度为1:128,cutoff临界值与样品稀释倍数1:128的OD450mm值的比值(B)≥1判定结果为阳性;临界值更接近样品稀释倍数1:64的OD450mm值时,样品判定浓度为1:64,cutoff临界值与样品稀释倍数1:64的OD450mm值的比值(B1)<1判定结果为阴性,其他为可疑,可疑样品可以重测,并以1:128为判定浓度,cutoff临界值与样品稀释倍数1:128的OD450mm值的比值(B)≥1判定结果为阳性,cutoff临界值与样品稀释倍数1:128的OD450mm值的比值(B)<1判定结果为阴性。
若考虑其测量不确定度对结果的影响,则有:样品判定浓度为1:128时,(B±U)≥1判定结果为阳性;样品判定浓度为1:64时,(B±U)<1判定结果为阴性,其他为可疑,可疑样品可以重测。检测结果落在B±U区间内,若此区间与1有交叉,应谨慎对待并考虑重复检测,可有效降低假阳性、假阴性出现的风险。
可疑样品重复检测时,以1:128为判定浓度,(B±U)≥1判定结果为阳性,(B±U)<1判定结果为阴性。若重复检测时B±U区间与1有交叉,结合首次检测结果考虑,首次结果以1:128为判定浓度,(B±U)<1的判定结果为阴性,(B±U)与1仍有交叉的,考虑两次接近阳性判定值的可疑判为阳性。
3.2 各分量的相对贡献
通过分析各分量对检测结果的不确定度的相对贡献大小,可以看出影响检测质量的主要因素,并有针对性地改善或控制某些条件后,能有效提高检测质量,有利于实验室的质量控制。在各主要分量的研究过程中发现,酶标仪的测量对不确定度结果的影响最大,其次是1:128稀释倍数下的样品浓度(1:128判定浓度)。
酶标仪的测量引入的不确定度很难通过一次检测过程改善,可以通过良好的仪器使用习惯、严格按照仪器的期间核查规程、维护规程核查和维护,并合理利用检定校准数据进一步减小酶标仪的测量引入的不确定度。1:128判定浓度引入的不确定度改善,主要是在倍比稀释过程中提高警惕,每步吹打混匀的次数要达到7~9次,使每步稀释过程充分混匀,提高判定浓度的稳定性,从而减小其引入的不确定度,提高检测质量。
参考文献:
[1] BIPM,IEC,IFCC,ISO,IUPAC,IUPAP,OIML.Guide to the expression of uncertainty in measurement(GUM)[S]. Geneva:The International Organization for standardization,2008.
[2] 国家质量监督检验检疫总局. 测量不确定度评定与表示:JJF1059.1—2012[S]. 北京:中国标准出版社,2012.
[3] World Organization for Animal Health(OIE). Manual of diagnostic tests and vaccines for terrestrial animals[M].6th ed. Paris:OIE,2008.
[4] 中国合格评定国家认可委员会. 测量不确定度要求的实施指南:CNAS-GL05:2011[S]. 北京:中国合格评定国家认可委员会,2011.
[5] 国家质量监督检验检疫总局. 移液器检定规程:JJG646-2006[S]. 北京:中国计量出版社,2006.
[6] 史喜菊,马贵平,李冰玲,等. 牛布鲁菌病补体结合试验测量不确定度评估[J]. 中国兽医杂志,2013,49(5):65-69
[7] 谢军,殷锦堂,王然,等. ELISA 法检测血清 HIV 抗原抗体的测量不确定度评定[J]. 甘肃医药,2012,31(1):24-28