一例高致死性急性猪丹毒病例的综合诊断与防治
2018-04-09马梓承古金元王玉超刘照虎孟凡亮王宏宇胡东方刘思当
马梓承,古金元,彭 涛,王玉超,刘照虎,孟凡亮,王宏宇,胡东方,刘思当
(山东农业大学动物科技学院,山东泰安 271000)
猪丹毒是由红斑丹毒丝菌(以下简称丹毒丝菌)引起的一种急性热性传染病,表现为高热性败血症、亚急性皮肤疹块和慢性疣状心内膜炎,以及多发性非化脓性关节炎[1],是在全球流行的一种重要猪病,也是我国主要的猪传染病之一,给养猪业带来了严重经济损失。丹毒丝菌可感染脊椎动物和无脊椎动物,包括家畜、禽类和人,其中猪最敏感,主要感染3~12 月龄猪,引起的发病率一般为10%~15%,严重时死亡率可达50%。
猪蓝耳病病毒(PRRSV)和猪圆环病毒(PCV2)是国内猪场的常见病原,也是对养猪业造成巨大经济损失的病原,常引起条件致病菌的继发感染。PRRSV归属于动脉炎病毒科动脉炎病毒属。患病猪临床表现为厌食、高热,母猪怀孕后期流产,产死胎和木乃伊胎。近年来我国流行的猪蓝耳病基本上是由高致病性毒株所致,对易感猪群具有极高的死亡率,病理变化以急性弥漫性间质性肺炎及全身败血症病变为特征。PCV2为圆环病毒科圆环病毒属,可感染各年龄的猪,使感染猪发生严重的免疫抑制。成年猪感染PCV2后,一般不表现明显的临床症状,仔猪感染后常引起断奶仔猪多系统衰竭综合征。
1 病例背景
山东省高密市某猪场饲养育肥猪1 200头。猪群免疫程序:仔猪出生3 d后,进行伪狂犬病疫苗滴鼻;1月龄首免口蹄疫油苗和猪瘟活苗,隔1个月再加强免疫1次。未进行猪蓝耳病和圆环病毒病疫苗免疫。2017年8月,猪群突然发生高热性疾病,部分病猪死前体温高达43 ℃,病死亡率为80%左右。猪场兽医怀疑为急性猪丹毒,对病猪注射青霉素和板蓝根注射液,但效果不佳,未抑制猪群死亡。
2 临床症状与剖检
病猪主要表现精神极度沉郁,虚弱,卧地不起,不愿走动,行走时步态僵硬;全身发红或有明显的红色疹块,耳朵呈紫红色,体表淋巴结肿大;高热,体温在42 ℃左右;呼吸困难,黏膜发绀,急性死亡。
剖杀送检病猪,发现病猪呈败血症病变(图1):全身淋巴结呈暗红色,肿大、出血,呈浆液性出血性炎症;肾脏肿大,呈暗红色淤血;脾脏呈樱桃红色,肿大、充血,呈急性脾炎病变;肺肿胀,呈暗红色,并见间质水肿;胃肠道黏膜呈现不同程度的卡他性或出血性炎症;肝脏肿胀,呈暗红色。
采集组织器官病料(肺脏、脾脏、肝脏、肾脏、脑、淋巴结及扁桃体)。其中,一份用液氮保存,用于病原学检测;另一份用10%福尔马林溶液固定,用于病理组织学检查。同时,自肺脏及肝脏进行细菌分离鉴定。
3 实验室检测
3.1 病毒PCR检测
将冻存于液氮中的组织病料解冻后,取适量加入灭菌PBS并研磨成匀浆,12 000 r/min离心8 min,取上清,使用北京全式金EasyPure Viral DNA/RNA kit(批号K30217)提取病毒核酸。根据不同病毒的保守基因序列及参考文献,分别设计猪瘟病毒(CSFV)、蓝耳病病毒(PRRSV)、伪狂犬病病毒(PRV)及猪圆环病毒2型(PCV2)的特异性引物(表1)。引物经验证均具有较好的特异性和扩增效率。将提取的核算用PCR/RT-PCR方法扩增,将扩增产物在1.5%的琼脂糖凝胶中电泳,在紫外凝胶成像仪下根据条带位置判定病猪的病原感染状况。结果显示,该病例存在PRRSV和PCV2感染(图2)。

图1 临床剖检病理变化

表1 PCR/RT-PCR引物序列
3.2 细菌分离鉴定
3.2.1初步分离培养 用血琼脂平板培养基,自肝脏和肺脏中分离细菌;将培养基于37 ℃温箱中培养1 d后取出,观察血平板中菌落生长情况。

图2 琼脂糖凝胶电泳图(病毒)
3.2.2PCR鉴定及测序 在平板中根据不同菌落大小和形态,分别用灭菌白色枪头挑选完整菌落,打入20 µL灭菌PBS中,充分混合,反复吹打,直至PBS变浑浊且无菌体沉淀。本试验共挑取了12个原始菌落。将所取的12个菌落分别用16S(生工合成)进行PCR鉴定。引物序列为F:5´-AGAGTTTGATCMTGGCTCAG-3´;R:5´-GGTTACCTTGTTACGACTT-3´。20 µL体系为:酶10 µL、水5 µL、混合菌液3 µL,上下游引物各1 µL。根据电泳结果(图3)可知,1、2、3、7、10号菌落出现了条带。将其PCR产物送公司(生工)测序,对得到的基因序列与NCBI比对,证实1、2、10号菌落为丹毒丝菌,3、7号为类芽孢杆菌。
据了解,津巴布韦农业投入品市场由当地私营和国际公司主导,这些公司利用政府增加的农业支持计划,提高自己的利润,加强在该国的业务。

图3 琼脂糖凝胶电泳图(细菌)
3.2.3再提纯培养 将之前稀释的1、2、10号菌液从4 ℃冰箱中取出,用灭菌枪头,将其滴到血平板上,用涂菌棒涂匀,放入37 ℃温箱中培养1 d后,可见小的圆形菌落,直径为0.5~1 mm;同样条件培养2 d后,菌落直径增至0.5~1.5 mm。菌落有光滑型和粗糙型两种,有时也能观察到中间型(图4)。将纯化好的菌落接种到5 mL含有10%犊牛血清的马丁肉汤中,在37 ℃摇床中200 r/min振荡培养12 h;将菌液与甘油以2:1的比例混匀,放入1.5 mL离心管中,-80 ℃冻存备用。

图4 丹毒丝菌提纯培养及革兰氏染色镜检
3.2.4鉴定 革兰氏染色:取甘油菌凃板的单个菌落进行革兰氏染色镜检,可见蓝紫色、细小的短杆菌,亦见有少量丝状长杆菌,符合丹毒丝菌的镜检形态。生化实验:对纯化的可疑菌落按照青岛海博生物技术公司提供的生化鉴定试剂盒进行葡萄糖、麦芽糖、甘露醇、山梨醇、枸橼酸盐、硝酸盐、VP、MR等生化试验,发现该菌能发酵葡萄糖、乳糖、麦芽糖、果糖等,不能发酵甘露糖、蔗糖、木糖醇,硫化氢试验阳性,甘露醇、MR、VP和接触酶试验均呈阴性(表2)。将细菌纯培养物接种到生化管中,发现该菌能发酵葡萄糖,乳糖、麦芽糖、果糖等,不能发酵木糖醇,甘露醇和蔗糖,且MR、VP均为阴性,硫化氢试验阳性。由此,该细菌的生化试验鉴定结果与丹毒丝菌相符合。特异性引物PCR鉴定:根据文献[2]合成扩增的丹毒丝菌SpaA基因片段特异性引物为Erko-1F:5'-GTGAAACACCGTATTTTAGTA-3´;Erko-2R:5´-TTCAAGAAGTTCCTGTAGTTT-3´。预期扩增出的目的基因片段长度为432 bp。反应体系(总体积20 µL):Premix Taq TaKaRa 10 µL、水5 µL,引物各1 µL,丹毒丝菌液3 µL。PCR反应条件:94 ℃预变性5 min;35个循环的扩增(94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s);最后72 ℃,再延伸5 min。对PCR产物用1%琼脂糖凝胶进行电泳分析。共进行了8个样品的电泳验证,发现均出现432 bp条带,符合丹毒丝菌特性(图5)。
3.2.5分离株SD-GM2017基因序列同源性比较及遗传进化分析 采用Editseq和 Megalign分子生物学软件,对SpaA基因测序结果进行同源性比较并绘制系统发育树(图6、图7)。结果表明,分离株与NCBI已发表SpaA基因序列核苷酸同源性为98.9%~99.9%。其中,与2014年4月分离自我国东部的YC13115株(KJ645079.1)和2014年6月分离自我国东部的HX130709株(KJ645074)同源性为100%。由于该菌株分离自我国东部的高密市,与我国东部2014年分离株XC130710(KJ645075.1)和同年分离株GHT10(KJ645072.1)核苷酸同源性达到99.8%,与另3例分离株NZ130701(KJ645073.1)、SY091027(KJ645080.1)、SY1027(CP005079)的核苷酸同源性也较高,达到99.5%。因此,将分离株的血清型确定为1a型。

表2 生化鉴定结果
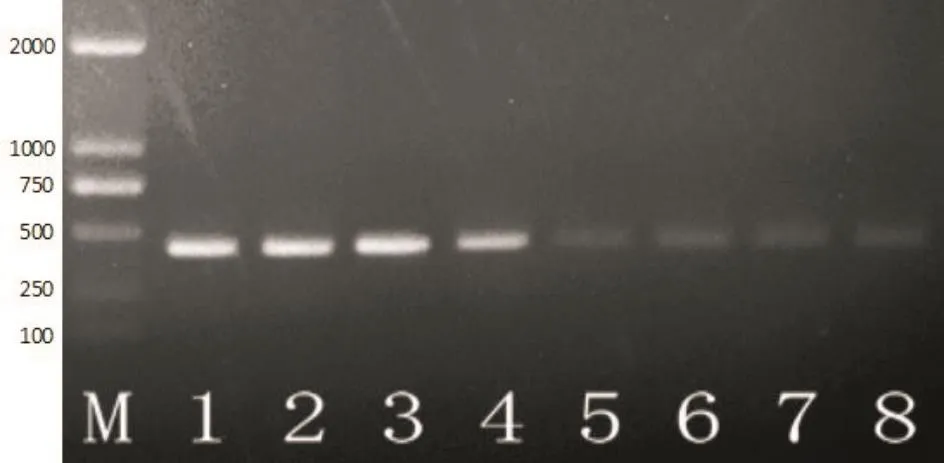
图5 琼脂糖凝胶电泳图(猪丹毒)

图6 分离株SD-GM2017基因全长的核苷酸序列进化树
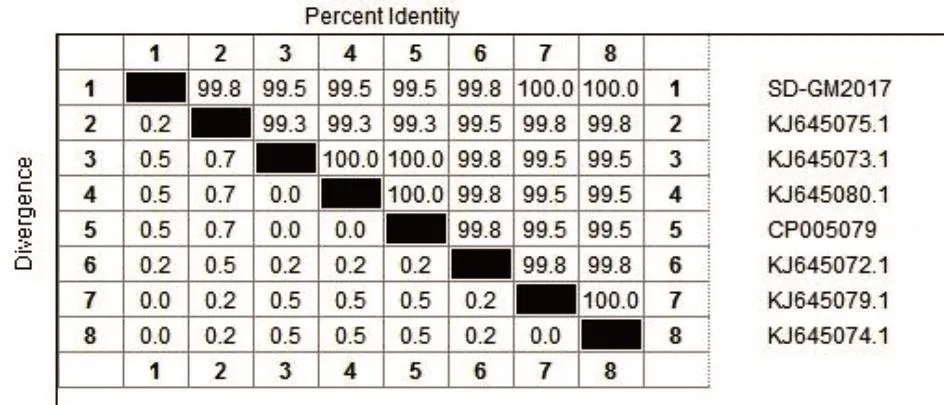
图7 不同分离菌株SpaA基因核苷酸序列同源分析
3.3 药敏试验
按常规方法,取0.5 mL菌液均匀涂布于血平板;分别将恩诺沙星、头孢噻呋、阿莫西林、链霉素、青霉素、林可霉素药敏片置于该平板上,贴放后用镊子轻压;37 ℃培养16~24 h,测量抑菌圈直径(φ)。结果显示:恩诺沙星、头孢噻呋、阿莫西林φ分别为25、18、8 mm,青霉素、链霉素、林可霉素无抑菌圈。根据抑菌环大小,确定本细菌对恩诺沙星和头孢噻呋较敏感,特别是对恩诺沙星极度敏感。
3.4 病理切片观察
取用福尔马林溶液固定好的病料,常规石蜡切片,HE染色,光镜下观察,发现组织病理变化主要表现为急性间质性肺炎、轻度病毒性脑炎、急性间质性肾炎、浆液性或坏死性淋巴结炎、间质性心肌炎及间质性肝炎(图8)。

图8 组织病理切片
4 病因分析及防控措施
根据临床观察、病例剖检、实验室检测结果分析,确定本病例因同时感染PRRSV 和PCV2,导致机体免疫抵抗力下降,造成急性猪丹毒暴发,印证了起于病毒病,死于细菌病的说法。病猪呈急性败血症死亡。经药敏试验得知,本病例中的丹毒丝菌对恩诺沙星极度敏感,而对青霉素耐药,致使在疫情暴发的第一时间使用青霉素注射,并未及时制止该病蔓延,造成了巨大损失。
基于诊断结果和病因分析,及时调整猪场免疫程序,对未发病猪群紧急免疫蓝耳病经典毒株活疫苗,全群用包被恩诺沙星和黄芪多糖拌料防治,对病猪注射恩诺沙星针剂,连续用药5 d,及时控制了疫情。
4.1 诱发原因
4.1.1疏于防范 猪丹毒是细菌病,可以用药物治疗,故一般农户对本病防控不够重视,很少注射疫苗,因而疏于防范成为诱发本病的重要原因。
4.1.2多种因素导致猪群抵抗力下降 混合感染、继发感染、免疫抑制等都是近几年猪病难防的重要原因,尤其是PRRSV和PCV2感染可导致猪群免疫力大幅下降,使得其他病原菌有了可乘之机。
4.1.3季节与饲养管理因素 8、9月份正值高温季节,气候湿热,猪处于热应激状态,环境又非常适于丹毒丝菌生存,从而导致猪丹毒疫情暴发。饲养管理中,突然更换日粮、转群等应激都为本病发生提供了条件。
4.2 防控措施
4.2.1提高警惕 金璐娟等[3]在2006年从44只突然发病死亡的猪群中分离到了猪丹毒丝菌,反映出猪丹毒在某些猪场流行严重。2008年周绪斌等[4]对我国10个省市的36个猪场进行了猪丹毒流行病学调查,选取近1年内未注射过任何猪丹毒疫苗的猪场进行统计与分析。结果显示,在所有33个猪场中,29个猪场检测出了猪丹毒阳性,阳性率高达87.88%,种猪检测样品阳性率为14.19%(110/775)。由此可见,猪丹毒的流行不可小觑,尤其是种猪群的慢性感染。猪场有必要进行猪丹毒疫苗免疫。
4.2.2降低应激,增强免疫 做好防暑降温工作,慎防天气突变带来的应激,可在饲料或者饮水中添加多维、黄芪多糖等抗应激、提高免疫力药物。
4.2.3坚持自繁自养,安全引种 要坚持自繁自养,全进全出制,保证自家猪群不受外来未知猪群影响,以免给猪群带来巨大风险。
4.2.4避免抗生素滥用 加强耐药性检测,选用合适抗生素,采取轮转用药、穿梭用药、交替用药等方式,将抗生素耐药性风险降低到最低。
4.2.5加强饲养管理 坚持做好猪舍卫生,定期消毒,保持猪舍清洁、通风,及时处理粪便,防止饮水和饲料污染,保持舍内温度恒定。
4.2.6疫苗预防 做好猪蓝耳病和圆环病毒病免疫。对猪丹毒流行猪场,建议每年春秋季定期进行猪丹毒疫苗免疫接种。
参考文献:
[1] 陈溥言. 兽医传染病学[M]. 5版. 北京:中国农业出版社,2006.
[2] 邹垚. 猪丹毒杆菌的分离鉴定和免疫特性分析[D]. 南京:南京农业大学,2015.
[3] 金璐娟,刘景霞,王迪. 肉仔鸡红斑丹毒丝菌感染的诊治[J]. 中国兽医杂志,2008,44(8):73-74.
[4] 周绪斌,丹尼,李聪,等. 猪丹毒——古老的传染病是否从中国规模化猪场消失了?[J].今日养猪业,2009,5:22-24.
