丁达尔效应定位伪狂犬病病毒密度梯度离心区带
2018-04-09齐安生宫枫举凌红丽张兴进邵卫星孙学强
齐安生,宫枫举,刘 爽,凌红丽,张兴进,邵卫星,,孙学强,
(1. 黑龙江省动物卫生监督所,黑龙江哈尔滨 150069;2. 青岛立见诊断技术发展中心,山东青岛 266114;3. 中国动物卫生与流行病学中心,山东青岛 266032;4. 青岛蔚蓝生物制品有限公司,山东青岛 266114)
英国物理学家John Tyndall在1869年发现当一束光线透过胶体时,从入射光的垂直方向可以观察到胶体里出现一条光亮“通路”。这条光亮“通路”是由于介质中粒子对光线散射形成的。这种现象被称为丁达尔现象,也称为丁达尔效应(Tyndall effect)[1]。
伪狂犬病病毒(Pseudorabies virus,PRV)学名猪疱疹病毒1型(Suid herpesvirus 1),属疱疹病毒甲亚科。猪为PRV的原始宿主,并作为贮主,可感染其它动物,如马、牛、绵羊、山羊、犬、猫,以及多种野生动物。人类对其有抗性。PRV颗粒直径约150 nm,内含直径为100 nm的20面体核衣壳,由162个中空的壳粒组成,包括150个六邻体及12个五邻体。核衣壳之内为线状卷轴样基因组,核外壳之外则是脂蛋白囊膜及许多糖蛋白的小纤突。因囊膜的差异,病毒颗粒直径范围为120~200 nm,其基因组为双链DNA,G+C含量高达73%。PRV在CsCl中的浮密度为1.731,在蔗糖中的浮密度为1.27~1.29,沉降系数为1 000~1 100 s[2]。
本实验用蔗糖密度梯度离心方法,离心PRV细胞培养上清;在离心结束后通过光束对离心区带产生的丁达尔效应进行精确分层取样,得到高纯度的病毒,以满足下游病毒学和免疫学研究需要。
1 材料和方法
1.1 病毒样品、试剂和仪器
伪狂犬病病毒Barth-K61细胞培养上清:青岛蔚蓝生物制品有限公司提供;蔗糖、PEG20000:国药产品;截留量为100 KD的透析袋:购自北京索莱宝科技有限公司;超速离心机:日本日立公司CP100WX;超速离心管:规格为15 mm×96 mm,容积为13 mL;水平转子:型号为P40ST;透射电镜:JEM-1200EX。
1.2 病毒液的浓缩和透析
取60 mL病毒细胞培养上清,经0.22 μm滤膜过滤;将滤液置透析袋中,用100 mmol/L pH7.2的PBS 4 ℃透析过夜,然后用PEG20000固体包埋透析袋后进行浓缩。浓缩后体积约为1 mL。
1.3 不连续蔗糖密度梯度的配制
以PBS配制质量分数为20%、30%、35%、40%、50%、60%的蔗糖密度梯度溶液;将其经0.22 μm滤器过滤后,按浓度由高到低依次加入超速离心管中。加入梯度蔗糖溶液时,可将离心管适度倾斜,沿着管壁缓慢加入,务求界面分明。总体积约为12 mL。
1.4 离心和区带取样
在密度梯度蔗糖界面上铺入1 mL病毒浓缩液,约为离心管体积的5%,确保离心管上部有较少空隙;距管口约2~3 mm时将铺入样品的离心管放入管套中,于精密天平称量并配平,然后将管套的螺纹盖拧紧后悬挂于水平转子P40ST上;在20 ℃条件下30 000 r/min离心4 h;离心结束后取出离心管,平稳置于试管架,用光束从管口垂直照射,标记光路上呈现丁达尔效应的离心区带,逐层吸取出现通路的离心区带至不同离心管,即区带样品。
1.5 区带样品的透析、浓缩和电镜观察
将约3 mL每个区带样品分别装入透析袋,于PBS中4 ℃透析过夜,用PEG20000固体包埋浓缩至1 mL。取适量浓缩液,滴至铜网,室温静置10 min,用滤纸吸干多余样品,滴加20 g/L磷钨酸负染5 min,晾干后透射电镜观察。
2 结果
2.1 离心区带观察
蔗糖密度梯度离心完成后,在自然光下直接观察,未见离心区带。用光束垂直照射离心管内液体,在与光路垂直的角度上观察,发现离心管内出现4个散射光斑,可观察到PRV细胞培养上清样品在不连续蔗糖密度梯度溶液中共出现4条离心区带,自上而下依次编号为区带1、2、3和4(图1)。经比对分析,区带1位于样品层和20%蔗糖之间,区带2位于30%~35%蔗糖浓度之间,区带3位于35%~40%之间,区带4位于40%~50%之间。

图1 密度梯度离心区带的丁达尔效应
2.2 区带样品电镜观察
区带样品经过处理后,透射电镜观察发现,区带1和2中未见病毒粒子形态的颗粒,仅存在小分子量杂蛋白、细胞膜碎片和结晶物(图2-A、图2-B);区带4中存在大量颗粒,直径约150~180 nm,但无明显的PRV病毒粒子形态学结构(图2-D);区带3中病毒颗粒呈球形,直径为120~150 nm,其中心是电子密度较高的核衣壳,外围是电子密度较低的囊膜,囊膜表面有呈放射状排列的纤突(图2-C),符合典型的PRV病毒粒子形态学特征。
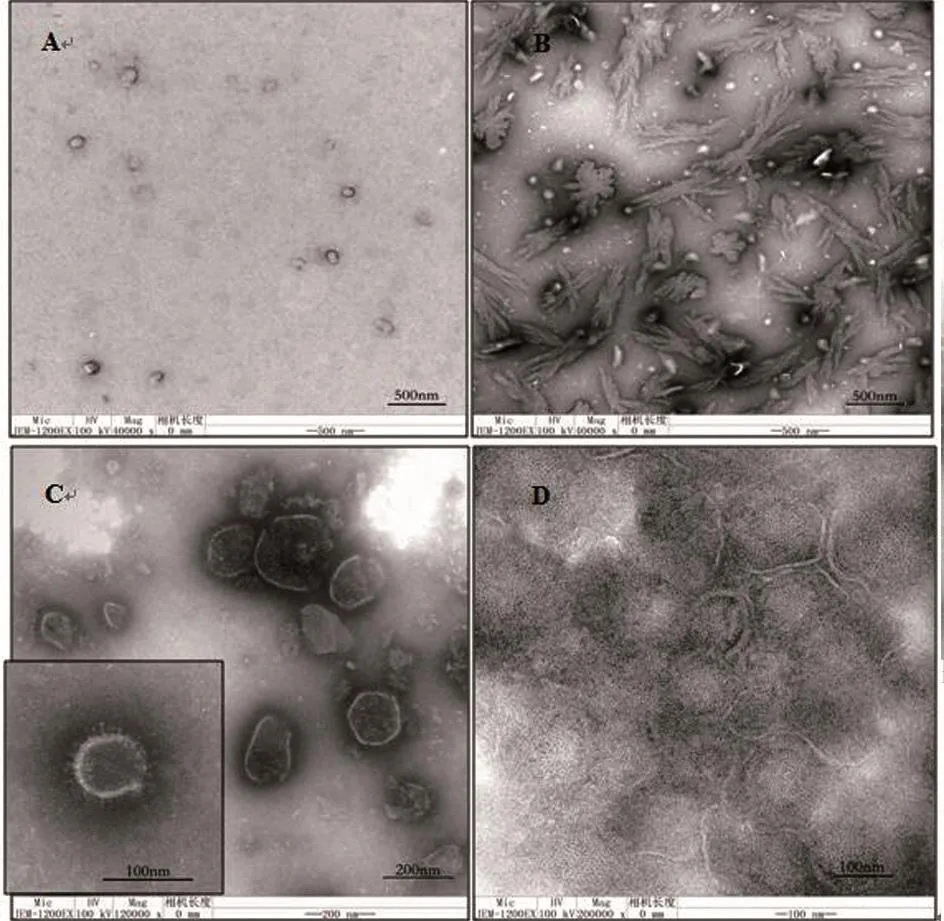
图2 密度梯度离心区带样品透射电镜图片
3 讨论
病毒提纯是应用各种物理和化学方法,以不使病毒受损和失活为前提,去除宿主细胞组分等非病毒物质,提取出高纯度浓缩的病毒样品。病毒提纯是病毒学研究的重要前提,病毒微细形态结构的研究、病毒抗原蛋白的分离提纯、病毒化学组分及其遗传物质—DNA或RNA的详细研究都需要高纯度的病毒样品[3]。病毒提纯方法包括沉淀法、层析法、红细胞吸附法、电泳法、超速离心法和超滤法等。每种方法因原理不同,从而对病毒的天然形态、活性和提取纯度都有不同影响。病毒提纯方法的选择,应根据病毒样品的来源特点、病毒粒子特性(如是否有血凝活性和囊膜、浮密度大小等)、纯度要求和下游实验要求,选择一种或几种方法结合进行。
超速离心法是病毒提纯常用方法之一。其主要原理是在强大的离心力作用下,不同大小的病毒粒子在介质中的沉降速度不同,从而达到提纯的目的。主要包括3种方法:差速离心法、速度区带离心法、等密度梯度离心法。速度区带离心法又可根据所使用的蔗糖、甘油和CsCl等介质密度的差异,分为连续密度梯度和不连续密度梯度[3]。超离心技术也是分离纯化生物大分子及亚细胞成份的最有用技术之一,而密度梯度离心法则是其中较为复杂的一种方法。它可以同时使样品中几个或全部组份分离,具有很好的分辨力[4]。密度梯度离心技术的发展,为进一步分离纯化亚细胞组分、染色体、病毒、RNA、DNA及其它生物大分子提供了有效方法,已成为细胞生物学、超微结构、分子生物学、免疫学、生物工程学等实验研究的得力手段[5]。
在密度梯度离心过程中,不同大小颗粒的病毒和蛋白在强大离心力作用下,沉降到与介质密度相等的区域后就不再沉降,不同分子形成不同区带,称为速度区带。在理论上,密度较小的粒子或成分停留在上面几层,密度较大的停留在下面几层,因而利用该法可以获得相当纯净的病毒样品。离心操作结束后,在普通自然光下,依据样品中蛋白浓度不同,通过肉眼直接观察的主观性较强,蛋白浓度高时可见速度区带,较低时不可见;部分型号离心机标配的离心管,为了满足强大离心力的要求,管壁较厚,透光性差,在自然光下通过肉眼观察蛋白区带难度更大。因此,在离心结束后,分层取样操作难度较大,常因操作的主观差异使本来已经离心分层的离心区带,在收集时又被混合,使病毒纯度不够,甚至导致试验失败,造成珍贵生物材料、实验仪器设备的巨大浪费。
丁达尔效应是一种光学物理现象。英国物理学家约翰·丁达尔(John Tyndall)在1869年首先研究发现光在粒子大小不同的介质中传播,当介质中的粒子小于入射光波长(400~700 nm),则发生光散射,可观察到光波环绕粒子而向其四周放射。这种散射现象称为丁达尔效应。当介质中粒子大于入射光波长很多倍,则发生光的反射;当粒子比入射光波长越小,则光的散射效果越弱。由于溶液粒子直径一般不超过1 nm,胶体中的粒子大小介于溶液中溶质粒子和浊液粒子之间,小于可见光波长(400~700 nm)。鉴于胶体能有丁达尔现象,而溶液几乎没有,所以可以采用丁达尔现象来区分胶体和溶液[1]。
密度梯度离心法一般用不同浓度的蔗糖、甘油或者CsCl,制备连续密度梯度或不连续密度梯度介质,用于分离大小不同的病毒和蛋白等。光束在粒子大小均一的溶液介质中直线传播。由于溶液粒子直径远远小于入射光波长,散射光强度因粒子体积相对较小而较弱,几乎不出现丁达尔效应。当病毒样品在离心力作用下,在密度梯度的蔗糖中形成不同的离心区带,不同区带之间以蔗糖等介质相隔,形成了“溶液1”-“区带1”-“溶液2”-“区带2”的多层结构。虽然每个溶液层浓度不同,但均不产生丁达尔效应;每个区带层中分别是浮密度相同、粒子大小相近的病毒或者蛋白等,而且一般情况下其粒子均小于入射光波长,能够产生丁达尔效应。因此,当以光束垂直照射离心管内容物表面时,在光路的垂直方向上用肉眼可以观察到明显的“断路-通路-断路-通路”现象。每1个“通路”代表1个离心区带。
病毒及亚单位的培养和提纯对疫苗、诊断试剂研究开发具有重要意义,但大多数研究都属于工艺性研究,具有一定的商业价值,所以相关研究报道较少[6-7]。在使用密度梯度离心法的研究报告中,尚未发现关于密度梯度离心区带定位的详细报道[8]。在本试验中离心用病毒样品浓度也较低,而且离心机配套使用的超速离心管管壁较厚,普通自然光下难以形成肉眼可见区带;利用垂直光束在离心管内容物的多层介质中形成的丁达尔效应,精确对各离心区带进行取样,对各层样品进行电镜观察发现,区带3为病毒层,病毒主要集中在35%~40%界面处,符合PRV的形态学特征,经分子生物学和免疫学鉴定为PRV,提取的病毒纯度达到了下游免疫学试验研究的需要(相关试验数据另文发表)。
密度梯度离心技术是经典的病毒纯化方法。殷震等[3]主编的经典著作《动物病毒学》(第2版)中关于超速离心提纯病毒的目的意义、方法、原理、步骤和注意事项进行了详细阐述,尤其是“密度梯度操作法的操作程序——梯度的分段收集(取样)”中列举了4种方法进行离心后取样,对试验操作人员的经验和技术要求较高。本研究将光学物理现象应用于病毒的经典病毒纯化方法,对完善提高密度梯度离心法进行了有益探索,大大提高了经典病毒纯化技术手段的成功率,对试验操作具有重要指导意义。
参考文献:
[1] GINELL R,GINELL A M,SPOERRI P E. Association phenomena;the growth of particles of silver chloride,and the higher-order Tyndall effect [J]. Journal of colloid science,1947,2(5):521-525.
[2] 陆承平. 兽医微生物学[M]. 5版. 北京:中国农业出版社,2013:555.
[3] 殷震,刘景华. 动物病毒学[M]. 2版. 北京:科学出版社,1997:1226.
[4] 杨苏. 密度梯度离心技术的探讨[J]. 宁德师专学报(自然科学版),1998(4):59-61.
[5] 赵凤章. 密度梯度离心技术[J]. 白求恩医科大学学报,1987(3):264-267.
[6] 李少丽,田朋飞,彭大新,等. 猪瘟病毒E2蛋白的高效表达及纯化[J]. 黑龙江畜牧兽医,2017(14):133-135.
[7] 田书苗,郅玉宝,王林建,等. 猪繁殖与呼吸综合征病毒纯化方法的建立[J]. 中国兽医科学,2016(5):568-572.
[8] 王大伟,李学伍,王丽,等. 猪伪狂犬病毒的增殖、纯化和鉴定[J]. 河南农业科学,2010(11):125-127.
