空气细颗粒物PM2.5对HaCaT细胞增殖、细胞周期及凋亡的影响
2018-04-09薛晨红张宏伟彭芬何聪芬王巧娥陈周张建中
薛晨红 张宏伟 彭芬 何聪芬 王巧娥 陈周 张建中
100044北京大学人民医院皮肤科[薛晨红(现在河南省人民医院皮肤科,450003郑州)、彭芬、陈周、张建中];中国疾病预防控制中心环境与健康相关产品安全所毒理室(张宏伟);北京工商大学 北京市植物资源研究开发重点实验室(何聪芬、王巧娥)
细颗粒物PM2.5是指悬浮于空气中空气动力学直径≤2.5 μm的固态或液态颗粒物。皮肤直接暴露于空气污染物中,时刻受到污染物的威胁[1]。PM2.5可能通过损害或降解角蛋白,破坏皮肤屏障致病[2]。研究表明,PM2.5不仅与外源性皮肤老化有关,而且与炎症性皮肤病,如湿疹、特应性皮炎(AD)的发生及严重程度相关[3⁃5]。毒理学研究表明,多环芳烃类为主的有机物、各种重金属元素(尤其是水溶性金属)及病原微生物可能是PM2.5起主要毒性作用的成分[6]。但基于PM2.5本身的特性及其吸附成分的复杂性,单一组分的研究并不能完全反映PM2.5对皮肤的整体危害效应。我们收集北京市采暖季雾霾天气PM2.5,探讨PM2.5对HaCaT细胞形态、增殖、周期及凋亡的影响,为PM2.5在皮肤科领域的相关研究奠定基础。
材料与方法
一、材料
永生化人角质形成细胞HaCaT细胞系来自北京大学人民医院皮肤科。澳洲胎牛血清及0.25%胰酶(美国Gibco公司),DMEM培养基(美国HyClone公司),CCK8细胞计数试剂盒(日本Dojindo公司),细胞全蛋白提取试剂盒、BCA法蛋白定量试剂盒(上海碧云天生物公司),鼠抗人细胞周期蛋白A2(cyclin A2)单克隆抗体、兔抗人细胞周期蛋白依赖性激酶1(CDK1)单克隆抗体(美国Abcam公司),鼠抗人GAPDH多克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗鼠、兔二抗(美国Santa Cruz公司),膜联蛋白V-异硫氰酸荧光素/碘化丙锭(annexin V⁃FITC/PI)细胞凋亡检测试剂盒(杭州联科生物公司)。
二、方法
1.PM2.5样品采集及处理:选择北京市东二环及东三环交界处,距地面约20 m的建筑物顶部为采样地点。在12月至次年1月,运用HY⁃1000智能大流量TSP采样器(选配PM2.5切割器,青岛恒远科技发展有限公司),使用石英滤膜采样。平均采样流量为1 000 L/min,每次连续采样24 h。采样后的石英滤膜于恒温恒湿条件下平衡24 h。将滤膜剪成1 cm×1 cm后浸于75%乙醇中,水浴超声振荡60 min以洗脱颗粒物,保持水温在20℃以下。洗脱液用70 μm滤网过滤到多个培养皿中,紫外灯杀菌,待大部分乙醇溶液挥发掉后再行冷冻干燥处理24 h,最后称重。用无菌水配制成高浓度储存液,-20℃保存。以上采集处理均由中国疾病预防控制中心环境与健康相关产品安全所毒理室完成。
2.实验分组及浓度设置:HaCaT细胞分为以下几组,空白组,仅用细胞培养基,无细胞及PM2.5;对照组,不加PM2.5,其他条件同实验组;实验组,不同浓度PM2.5处理。细胞形态学观察与CCK8法检测细胞增殖实验中设置50、100、200、400、800 mg/L 5个浓度组。流式细胞仪检测细胞周期、凋亡及Western印迹法检测细胞周期相关蛋白实验中设置100、200、400 mg/L 3个浓度组。
3.细胞培养与混悬液制备:在37℃、5%CO2、湿度饱和的细胞培养箱中用DMEM培养基常规培养HaCaT细胞。取对数生长期细胞,以1×105个细胞/ml的密度接种,贴壁生长至50%~60%融合度时进行下述实验。用DMEM培养基将PM2.5储存液稀释成低浓度工作液。
4.细胞形态学观察:HaCaT细胞接种于6孔培养板,每孔2 ml。倒置显微镜下观察PM2.5处理24 h后HaCaT细胞形态并拍照记录。
5.CCK8法检测细胞增殖:HaCaT细胞接种于96孔培养板,每孔100 μl。含不同浓度PM2.5培养基处理24 h后,吸弃培养基,磷酸盐缓冲液(PBS)洗涤1~2次,更换含1%胎牛血清的DMEM培养基每孔100 μl;加入10 μl CCK8检测试剂,孵育90 min。用酶标仪在双波长(450 nm、630 nm)模式下测定各孔吸光度(A值)。细胞存活率(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。每组设3个复孔,实验重复3次。
6.流式细胞仪检测细胞周期分布:将HaCaT细胞接种于6孔培养板,含不同浓度PM2.5培养基处理24 h后,消化离心收集细胞,4℃PBS洗涤细胞1次,270×g离心5 min,弃上清液;以4℃预冷的2 ml 75%乙醇固定细胞至少1 h,离心弃固定液。配制细胞染色液,加入一定体积染色液(0.6~1.0 ml)重悬细胞沉淀物,避光室温放置30 min;吹打混匀后用300目滤网过滤至流式管中上机检测。每组设3个复孔,实验重复3次。
7.Western印迹法检测细胞周期相关蛋白表达:PM2.5处理24 h后收集细胞样品,RIPA裂解液裂解细胞;BCA法测定蛋白浓度;每个加样孔加入20 μg样本蛋白进行SDS⁃PAGE电泳、转膜、封闭;按合适比例(1∶1 000~1∶4 000)稀释 cyclin A2、CDK1和GAPDH一抗,4℃摇床孵育过夜;次日洗膜后室温摇床孵育二抗(1∶5 000稀释)1 h,洗膜,曝光显影。使用ImageJ软件进行灰度值分析。根据目的条带与GAPDH条带的灰度比值计算相对灰度值,检测cyclin A2、CDK1蛋白的表达。实验重复3次。
8.流式细胞仪检测细胞凋亡:PM2.5处理24 h后,将细胞培养上清液及用0.25%胰酶消化下来的细胞全部收集于离心管中,360×g离心5 min,弃上清液;4℃预冷的PBS洗涤细胞2次,再次离心弃上清液;1×annexin⁃V结合缓冲液重悬细胞沉淀物,调整细胞密度为1 × 106个/ml;取100 μl细胞悬液置于流式管中,加入5 μl annexin⁃V溶液及10 μl PI工作液,室温避光孵育15 min后再加入400 μl 1×annexin⁃V结合缓冲液,混匀后立即上流式细胞仪检测。细胞总凋亡率=早期细胞凋亡率+晚期细胞凋亡率。每组设3个复孔,实验重复3次。
9.统计学分析:用SPSS16.0软件进行数据分析,实验结果以x±s表示,多组间及两两组间均值比较分别采用单因素方差分析(One⁃way ANOVA)及LSD法。P<0.05为差异有统计学意义。
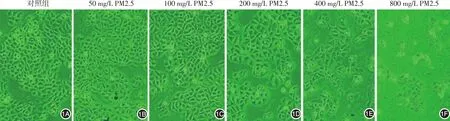
图1 不同浓度PM2.5对HaCaT细胞形态的影响(×100) 1A:对照组细胞形态均一,呈多角形;1B、1C:细胞形态及数目均无明显变化;1D:细胞数目有所减少,个别细胞形态不规则;1E:细胞数目明显减少,部分细胞失去正常形态,漂浮细胞明显增多;1F:可见大量漂浮细胞,仅少数细胞仍贴壁生长
结 果
一、PM2.5对HaCaT细胞形态的影响
见图1。对照组及不同浓度PM2.5组(50、100、200、400、800 mg/L)HaCaT细胞处理24 h后,对照组细胞形态均一,分布均匀,贴壁紧密,呈典型铺路石样增殖(图1A);50、100 mg/L组细胞形态及数目变化均不明显(图1B、1C);200 mg/L组细胞数目较对照组有所减少,个别细胞形态开始变得不规则(图1D);400 mg/L组细胞数目明显减少,部分细胞失去正常形态,漂浮死亡细胞明显增多(图1E);800 mg/L组可见大量漂浮死亡细胞,多数细胞肿胀变形(图1F)。
二、PM2.5对HaCaT细胞增殖的影响
各组间HaCaT细胞的存活率差异有统计学意义(F=471.25,P<0.001)。50 mg/L组细胞存活率为(98.49±1.44)%,对照组为(100±4.95)%,两组差异无统计学意义(P>0.05);100、200、400、800 mg/L组细胞存活率分别为(91.77±2.04)%、(80.01±1.57)%、(57.80 ± 1.56)%、(21.98 ± 0.86)%,与对照组相比,差异均有统计学意义(P<0.05),且随着PM2.5浓度升高,细胞存活率明显降低。
三、PM2.5对HaCaT细胞周期分布的影响
流式细胞仪检测发现,100~400 mg/L PM2.5处理HaCaT细胞24 h后,随着PM2.5浓度的升高,G1期细胞比例无明显变化,S期细胞比例逐渐增高,G2/M期细胞比例逐渐降低,并呈浓度依赖关系(r值分别为0.91、-0.97,均P<0.05),见表1。
四、PM2.5对细胞周期相关蛋白表达水平的影响
见表1。与对照组相比,100、200、400 mg/L组cyclin A2、CDK1蛋白表达量均降低,200 mg/L组降低最明显,差异有统计学意义(P<0.05),见图2。
五、PM2.5对HaCaT细胞凋亡的影响
对照组细胞总凋亡率为(6.24±0.17)%,100、200、400 mg/L组分别为(9.98±0.21)%、(12.56±0.74)%、(16.74± 1.48)%,细胞总凋亡率呈浓度依赖性升高(r=0.97,P<0.05)。见图3。
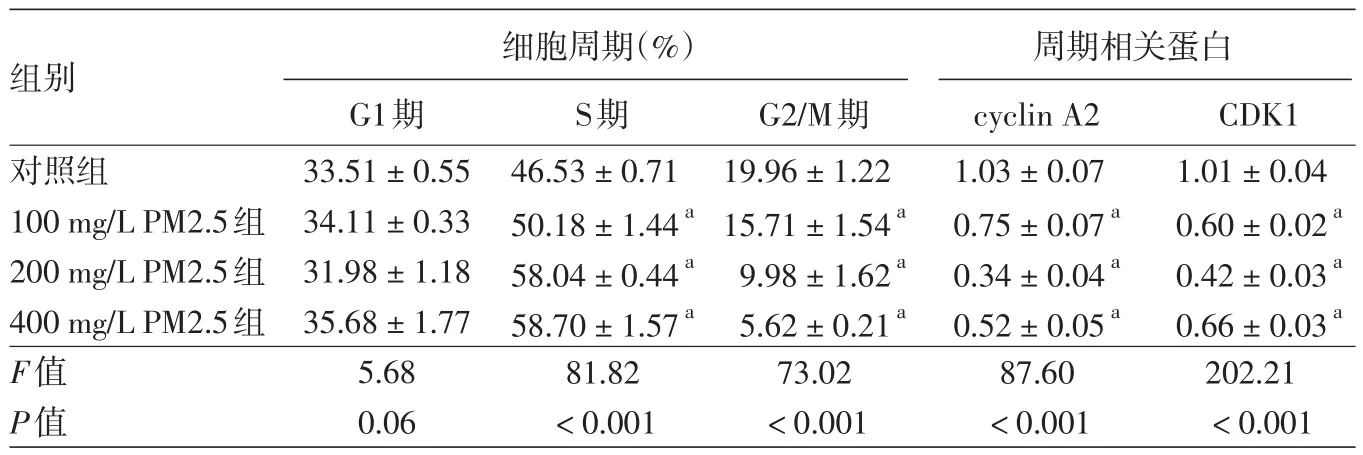
表1 不同浓度PM2.5处理HaCaT细胞24 h后细胞周期分布及相关蛋白表达变化(x±s)
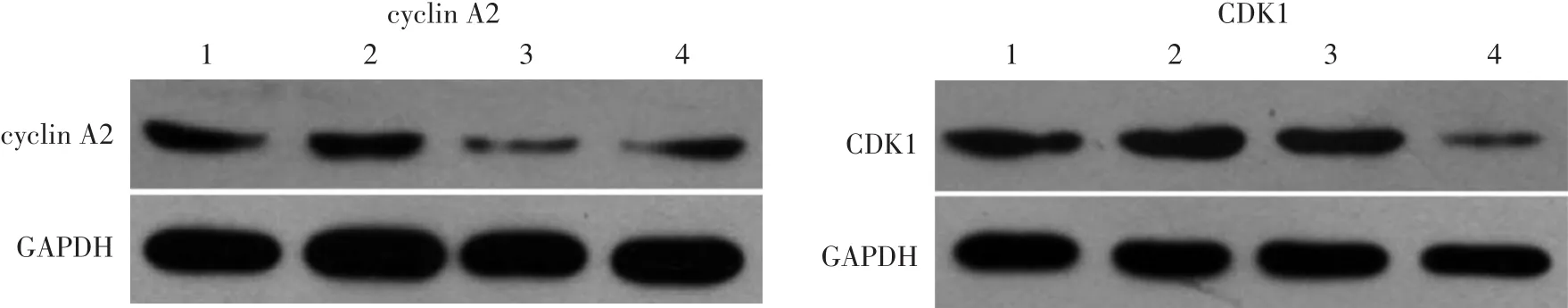
图2 不同浓度PM2.5对HaCaT细胞表达细胞周期蛋白(cyclin)A2及细胞周期蛋白依赖性激酶1(CDK1)蛋白的影响 1:对照组;2:100 mg/L PM2.5组;3:200 mg/L PM2.5组;4:400 mg/L PM2.5组。GAPDH:3-磷酸甘油醛脱氢酶
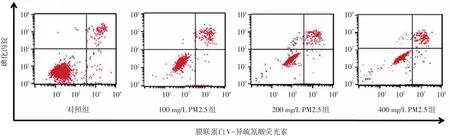
图3 流式细胞仪检测不同浓度PM2.5处理HaCaT细胞24 h后细胞凋亡率
讨 论
PM2.5化学组分复杂,主要包括无机成分、有机成分、元素碳、微量金属元素、微生物[7]。既往PM2.5在体外的毒理学研究多集中在呼吸道上皮细胞、肺泡巨噬细胞、血管内皮细胞、外周血淋巴细胞等,但对皮肤细胞的研究不多[8]。本实验中我们发现,HaCaT细胞在PM2.5处理24 h后,随着PM2.5浓度升高(0~400 mg/L),细胞数目逐渐减少,漂浮细胞逐渐增多;细胞存活率逐渐下降,细胞增殖明显受限。这与Li等[9]的研究结果基本一致,说明PM2.5可对HaCaT细胞造成明显的毒性损伤。
已知细胞增殖与细胞周期密切相关,而细胞周期调控是一个精妙复杂的过程,受cyclin和CDK两大家族基因的控制。我们用100~400 mg/L PM2.5处理HaCaT细胞24 h后,发现S期细胞比例逐渐升高,G2/M期细胞比例逐渐降低,提示PM2.5导致细胞周期发生紊乱,诱导HaCaT细胞阻滞于DNA合成期,即S期。进一步检测S期进展相关蛋白cyclin A2、CDK1的表达水平,发现cyclin A2、CDK1的表达水平均有一定程度下降,这种变化趋势与S期HaCaT细胞比例升高趋势相一致。进一步研究PM2.5对HaCaT细胞凋亡的影响,发现随着PM2.5浓度从100 mg/L升高至400 mg/L时,细胞平均凋亡率由9.98%升高至16.74%,说明PM2.5可一定程度促进HaCaT细胞凋亡。丁晓洁[10]在研究PM2.5对人支气管上皮细胞增殖的影响时发现,PM2.5可通过诱导细胞S期阻滞及一定程度促进细胞凋亡来抑制支气管上皮细胞增殖。覃辉艳等[11]研究发现,广州市雾霾天气PM2.5可诱导人支气管上皮细胞(16⁃HBE)凋亡,抑制细胞增殖,导致细胞氧化损伤。角质形成细胞与支气管上皮细胞同属上皮来源,研究结果的相似性提示PM2.5可能通过诱导S期阻滞导致HaCaT细胞增殖受限,且S期阻滞可能与cyclin A2、CDK1蛋白的表达下调有关。由于PM2.5的具体成分因采样时期、地点不同而有所差别,其对机体造成的损伤程度及相关机制也可能不同。本实验采集的是北京市雾霾天气PM2.5,其诱导HaCaT细胞产生明显的细胞毒性,包括引起细胞形态改变、抑制细胞增殖、诱导细胞S期阻滞,一定程度促进细胞凋亡,相关毒性机制尚待进一步研究。
[1]甄雅贤,刘玮.环境空气污染与皮肤健康[J].中华皮肤科杂志,2015,48(1):67⁃70.doi:10.3760/cma.j.issn.0412⁃4030.2015.01.026.
[2]柯冰,胡康洪.环境污染和皮肤疾病[J].医学综述,2007,13(18):1377⁃1379.doi:10.3969/j.issn.1006⁃2084.2007.18.008.
[3]Peng F,Xue CH,Hwang SK,et al.Exposure to fine particulate matter associated with senile lentigo in Chinese women:a cross⁃sectional study[J].J Eur Acad Dermatol Venereol,2017,31(2):355⁃360.doi:10.1111/jdv.13834.
[4]Krutmann J,Liu W,Li L,et al.Pollution and skin:from epidemiological and mechanistic studies to clinical implications[J].J Dermatol Sci,2014,76(3):163⁃168.doi:10.1016/j.jdermsci.2014.08.008.
[5]李永荷,王旭英,王巧伟,等.北京市某医院皮炎患者门诊量与空气污染的相关性研究[J].中华皮肤科杂志,2015,48(12):835⁃839.doi:10.3760/cma.j.issn.0412⁃4030.2015.12.002.
[6]王欣心,金银龙.多环芳烃遗传毒性研究进展[J].环境与健康杂志,2010,27(2):174⁃177.
[7]Englert N.Fine particles and human health⁃a review of epidemiological studies[J].Toxicol Lett,2004,149(1⁃3):235⁃242.doi:10.1016/j.toxlet.2003.12.035.
[8]Feng SL,Gao D,Liao F,et al.The health effects of ambient PM2.5 and potential mechanisms[J].Ecotoxicol Environ Saf,2016,128:67⁃74.doi:10.1016/j.ecoenv.2016.01.030.
[9]Li Q,Kang ZH,Jiang S,et al.Effects of ambient fine particles PM2.5 on human HaCaT cells[J].Int J Environ Res Public Health,2017,14(1):72.doi:10.3390/ijerph14010072.
[10]丁晓洁.PM2.5对人支气管上皮细胞毒性作用的初步研究[D].南京:南京医科大学,2014.
[11]覃辉艳,彭晓武,李琴,等.大气细颗粒物对人支气管上皮细胞氧化损伤作用的研究[J].环境与健康杂志,2012,29(11):1017⁃1019.
