棉花GhVHA-A基因的原核表达及其重组大肠杆菌的抗逆性分析
2018-04-08倪志勇陈全家曲延英
刘 娜,倪志勇,芮 存,李 娟,陈全家,曲延英
(新疆农业大学 农学院,农业生物技术重点实验室,乌鲁木齐 830052)
由于植物固着生活的特性决定了其在整个生长发育过程中不可避免地会同时或相继遭受到各种各样生物或非生物的逆境胁迫[1-2]。干旱、高盐以及低温等极端条件又称为水分胁迫或渗透胁迫,是植物生长过程中所面临的主要的非生物逆境胁迫因子,严重制约着植物生长。在农业生产中,这些逆境因子会降低作物的产量,影响农产品的品质,造成巨大的经济损失[3]。棉花是中国乃至全世界最重要的经济作物之一,棉花生产对中国农业乃至国民经济的发展皆有重要影响。干旱、高盐等问题严重制约着棉花的进一步发展,是影响棉花的产量和质量的主要制约因素之一。因此,借助分子生物学和基因工程技术对棉花抗逆机理进行深入研究,进一步发掘和克隆对棉花抗旱有紧密关系的相关基因,对于抗逆棉花新品种的培育具有重大意义。
质子泵是能够推动质子跨膜运动的一种能量系统,广泛存在于生物细胞中[4]。在膜质子泵ATPase家族中植物液泡膜上的H+-ATPase是当前研究十分活跃的一个分支,由于它的结构复杂,功能多样以及在生命活动中的功能和可应用性,引起了人们的广泛关注[5]。目前研究结果表明,植物液泡膜H+-ATPase对植物细胞内离子平衡过程中起到关键的调节作用,其主要作用是酸化液泡,利用水解ATP,为离子和代谢物的运输提供能量[6]。除此之外液泡膜H+-ATPase还能够通过控制液泡细胞的膨压达到维持细胞体积的目的;积累液泡中的离子和代谢产物,将有毒的次级代谢产物区隔来保护细胞[7]。同时液泡膜H+-ATPase作为非常重要的持家酶,在生物体内的信号转导中也发挥着至关重要的作用。虽然液泡膜H+-ATPase在影响植物生长与发育以及植物对盐碱、干旱、低温等非生物胁迫的响应中起到极为重要的作用,但是对于它是如何响应各种逆境信号,以及它对植物生长发育调节上的诸多环节仍不清楚,需要进一步深入开展对液泡膜H+-ATPase功能的研究,同时更加全面地了解植物抗逆反应的生理生化机制,为开发新的棉花抗逆品种提供理论依据。
本研究前期以棉花品种‘KK1543’为材料,通过RT-PCR方法获得了1个棉花液泡膜H+-ATPase A亚基基因,命名为GhVHA-A[8]。为了进一步验证该基因的功能,本研究在此基础上将棉花GhVHA-A基因构建到原核表达载体pET28a上,利用IPTG诱导其在大肠杆菌BL21(DE3)中高效表达,同时对重组大肠杆菌BL21(pET28a-GhVHA-A)进行了抗逆性分析,来探讨其在逆境胁迫下可能发挥的作用,以期为该基因在棉花抗逆育种中的应用提供理论依据。
1 材料和方法
1.1 试验材料及处理
本试验所用棉花材料为‘KK1543’,由新疆农业大学农学院作物遗传育种实验室提供。选用饱满且胚完整的棉花种子种入发芽盒中,待子叶完全展开,挑选生长一致的植株移入装有1/2 Hoagland营养液的塑料盆。水培试验在光照培养室进行(光/暗周期为12 h/12 h,昼夜温度为26~28 ℃/20~22 ℃),每2~3 d按时更换营养液保证幼苗健康生长。待棉花幼苗长至两叶一心时,选取生长状况良好的幼苗进行不同的胁迫处理。
材料采用干旱(15% PEG6000)和高盐(250 mmol/L NaCl)胁迫处理。每个处理分别设置对照(正常浇水)和处理组,分别处理2、4、6、12和24 h后,取叶片立即用液氮速冻,于-80 ℃下贮藏,每处理重复3次。
原核表达载体pET28a及其大肠杆菌DH5α、BL21(DE3)均由本研究室保存,棉花GhVHA-A基因由本研究室克隆保存。
1.2 实验方法
1.2.1半定量RT-PCR分析根据植物总RNA提取试剂盒(天根公司)的方法进行总RNA提取。按照Thermo反转录试剂盒(上海赛默飞公司)说明书操作步骤,获得棉花叶片总RNA为模板,合成cDNA第一条链。以合成的cDNA为模板,用Taq聚合酶(北京全式金公司)进行28次循环扩增。半定量引物为GhVHA-A-qF(5′-CAAGTCGCCATGAATCCG-3′)和GhVHA-A-qR(5′-CAAGTCGCCATGAATCCG-3′);内标基因为GhUBQ7,引物为GhUBQ7-F(5′-GACCTACACCAAGCCCAAGAAG-3′)和GhUBQ7-R(5′-TGAGCCCACACTTACCACAATAGT-3′)。
1.2.2GhVHA-A基因原核表达载体的构建根据原核表达载体pET28a的多克隆位点,设计带有酶切位点引物VHA-28-F(5′-TTAGGATCCATGCCGGCAGTTTACGGATCCAGATT-3′)和VHA-28-R(5′-TAAGTCGACCCTAGTTTCATCCTCCAATGCACG-3′),并以pMD19-T-GhVHA-A质粒为模板,按上述体系和程序进行PCR扩增,经1%琼脂糖凝胶电泳检测扩增产物。利用SalI和BamHI(上海赛默飞试剂公司)双酶切PCR纯化产物与空质粒pET28a,酶切产物纯化后,用T4DNA连接酶22 ℃定向连接20 min,将连接产物转化大肠杆菌DH5α,通过菌液PCR初步筛选阳性重组子,阳性克隆送上海美季测序公司测序。
1.2.3GhVHA-A基因的原核表达使用热激法将重组质粒pET28a-GhVHA-A转化大肠杆菌BL21 感受态细胞(北京全式金),涂布于含有硫酸卡那霉素(50 mg/L)的LB固体培养基上,37 ℃过夜培养后挑取单菌落, 经含有硫酸卡那霉素的液体培养基震荡培养12 h后,通过菌液PCR筛选阳性克隆。
将重组菌株接种于2 mL含50 mg/L硫酸卡那霉素的LB液体培养基中,37 ℃、200 r/min过夜培养。然后按1∶50比例转接到10 mL新鲜LB液体培养基中(含50 mg/L硫酸卡那霉素),225 r/min培养3 h(OD600≈0.6),加入IPTG 至终质量浓度分别为0、0.2、0.5、1.0、1.5 和2.0 mmol/L,37 ℃诱导4 h后收集菌液。以 0.5 mmol/L IPTG 诱导4 h的pET28a空载体作为对照。8 000 r/min离心10 min,弃上清,菌体样品加入30 μL 2×上样缓冲液和 50 μL ddH2O,混匀,在100 ℃的沸水中煮沸10 min,冰上冷却后,取 10 μL 进行 SDS-PAGE(5%浓缩胶,12%分离胶)电泳检测。电泳后经考马斯亮蓝染色、拍照,分析蛋白表达结果,确定最适IPTG 诱导浓度。
按上述方法,以终质量浓度为1 mmol/L IPTG进行重组菌株表达蛋白的诱导表达,以相同条件的pET28a转化菌为对照。37 ℃培养 0、2、4和 6 h后分别收集菌液,进行SDS-PAGE(5%浓缩胶,12%分离胶)电泳检测,分析确定蛋白表达最适培养时间。
1.2.4重组大肠杆菌BL21(pET28a-GhVHA-A)的抗逆性分析(1)定性分析。 大肠杆菌培养和IPTG诱导条件如前所述。分别将含有pET28a-GhVHA-A载体和空载体pET28a的大肠杆菌进行液体培养,当IPTG诱导的大肠杆菌菌液OD600为1.0左右时,用含有50 mg/L硫酸卡那霉素 和0.5 mmol/L IPTG的LB液体培养基将菌液稀释10、100和1 000倍,取原菌液以及稀释后的菌液进行胁迫处理。胁迫试验中,固体培养基中添加质量浓度为0.5 mmol/L IPTG,以及0.5 mol/L NaCl和20% PEG6000作为胁迫处理, 同时以只添加0.5 mmol/L IPTG的平板培养基为非胁迫对照,将1 μL菌液滴加到上述平板培养基,37 ℃培养2 d后观察对照和处理的大肠杆菌生长存活情况。
(2)定量分析。 大肠杆菌培养、IPTG诱导及胁迫处理条件与定性分析相同。用含有50 mg/L硫酸卡那霉素和0.5 mmol/L IPTG的LB液体培养基连续稀释BL21/pET28a和BL21/pET28a-GhVHA-A菌液,并取50 μL均匀涂布于含50 mg/L硫酸卡那霉素和0.5 mmol/L IPTG的非胁迫和胁迫处理的LB固体平板上,在37℃孵育平板2 d后,记录每个平板上的菌落数,按如下公式分析菌落形成率。
菌落形成率(%)=胁迫处理平板上菌落数/非胁迫处理平板上菌落数×100
(3)重组大肠杆菌BL21(pET28a-GhVHA-A)的抗逆性实验。分别取经 IPTG诱导后的重组菌和非重组菌液1 mL,按1∶100比例稀释,加入到终质量浓度为0.5 mol/L NaCl和20% PEG6000的LB液体培养基中,37 ℃、220 r /min 继续振荡培养,每隔 30 min测定OD600值,绘制生长曲线,每个处理3个重复,无胁迫处理的菌液作为对照。根据OD600测定结果分析抗逆性。
2 结果与分析
2.1 GhVHA-A在逆境胁迫下的表达特性
利用半定量RT-PCR,以组成型表达的GhUBQ7基因为内参基因,对GhVHA-A基因在15% PEG6000(图1,A)和250 mmol/L NaCl(图1,B)处理条件下的表达水平进行了检测。结果显示,在上述逆境胁迫处理过程中,GhVHA-A基因表达水平有明显的变化,在15% PEG6000处理下,GhVHA-A转录本在2 h之内迅速积累,达到最大表达量,随后降低;在250 mmol/L NaCl胁迫下,GhVHA-A的表达逐渐增加,在处理 12 h 时达到最大值。
2.2 GhVHA-A基因原核表达载体的构建与表达分析
对重组质粒pET28a-GhVHA-A进行菌液PCR检测,电泳结果(图2)显示,在2 000 bp左右有1条预期目的条带,同时,该重组载体插入DNA片段的测序结果与棉花GhVHA-A基因序列完全相同,表明棉花GhVHA-A基因的原核表达载体构建成功。
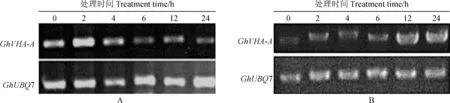
A. 15% PEG6000; B. 250 mmol/L NaCl图1 非生物胁迫下GhVHA-A基因的半定量RT-PCR表达分析Fig.1 Semi-quantitative RT-PCR analysis of GhVHA-A expression under abiotic stress
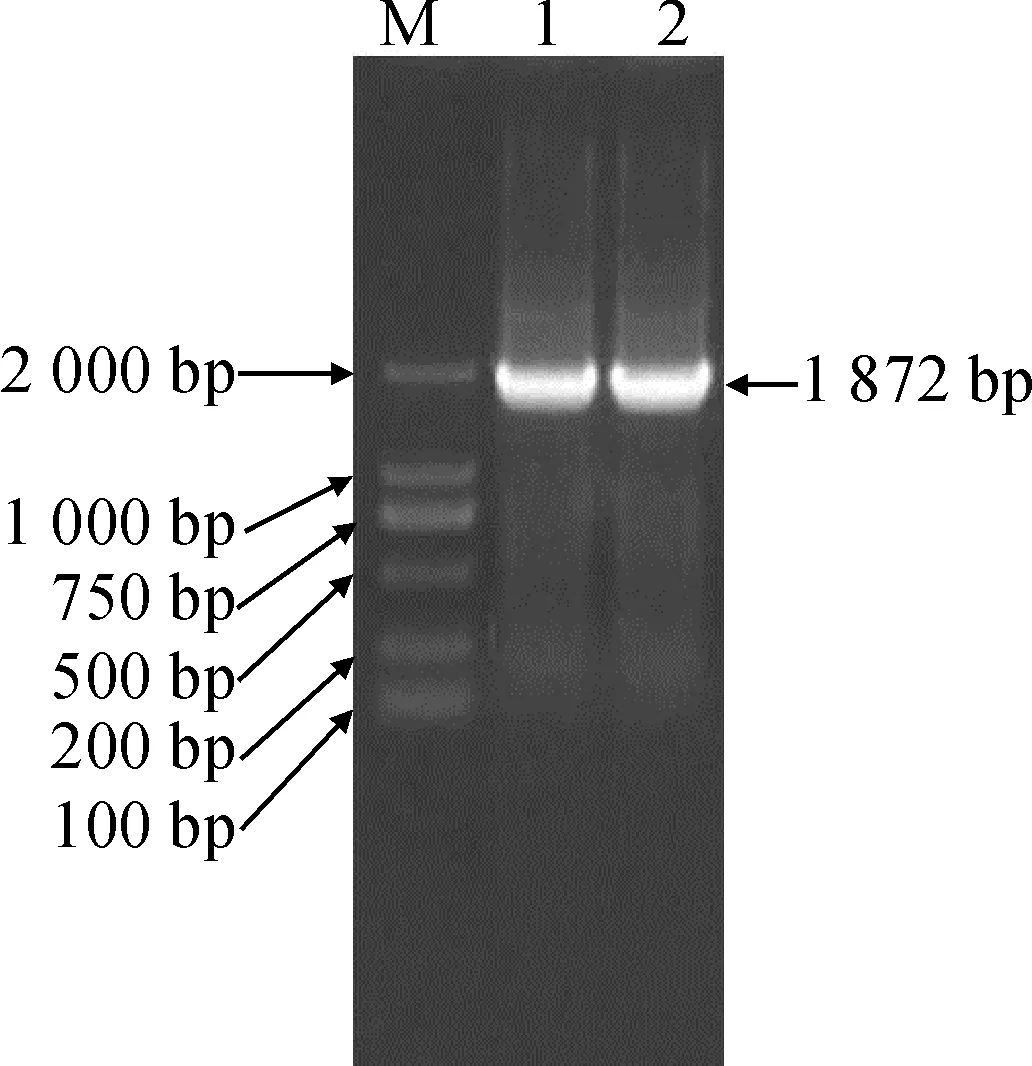
M.DL2000;1~2. GhVHA-A图2 pET28a-GhVHA-A菌液PCRFig.2 pET28a-GhVHA-A vector bacterial liquid PCR
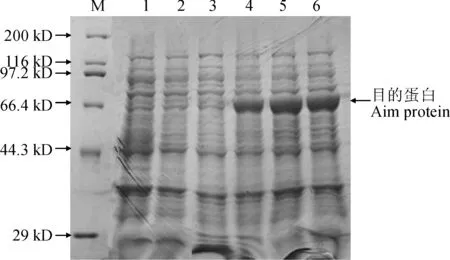
M.蛋白质标准分子量;1. 未诱导pET28a;2. pET28a经0.5 mmol/L IPTG诱导4 h;3. 未诱导pET28a-GhVHA-A;4~6. pET28a-GhVHA-A经0.5 mmol/L IPTG分别诱导2、4和6 h图3 IPTG诱导时间对GhVHA-A蛋白表达的影响M.Protein marker; 1. pET28a without IPTG induction; 2. pET28a induced by 0.5 mmol/L IPTG for 4 h; 3. pET28a-GhVHA-A without IPTG induction; 4-6. pET28a-GhVHA-A induced by 0.5 mmol/L IPTG treatment for 2,4 and 6 h, respectivelyFig.3 Effect of induction time with IPTG on expression of GhVHA-A protein

M.蛋白质标准分子量;1. 未诱导pET-28a;2. pET28a经0.5 mmol/L IPTG诱导4 h; 3. 未诱导pET28a-GhVHA-A; 4~8. pET28a-GhVHA-A经IPTG诱导4 h,IPTG诱导终浓度分别为 0.2、0.5、1.0、1.5 和 2.0 mmol/L图4 IPTG 终浓度对 GhVHA-A蛋白表达的影响M. Protein marker; 1. pET28a without IPTG induction; 2. pET28a induced by 0.5 mmol/L IPTG for 4 h; 3. pET28a-GhVHA-A without IPTG induction; 4-8. pET28a-GhVHA-A induced by 0.2, 0.5, 1.0, 1.5 and 2.0 mmol/L IPTG for 4 h, respectivelyFig.4 Effect of final concentration of IPTG on expression of GhVHA-A protein
pET28a-GhVHA-A转化感受态细胞BL21(DE3)后,在37 ℃下,用IPTG(0.5 mmol/L)诱导GhVHA-A编码蛋白0、2、4和6 h,SDS-PAGE结果如图3所示。结果显示,处理2、4和6 h均能诱导出融合蛋白,且表达得到的目的蛋白与预测GhVHA-A蛋白分子量相一致。其中诱导时间为4 h时重组蛋白表达量就达到最大值。经0.5 mmol/L IPTG诱导4 h的pET28a空载体则没有重组蛋白的表达(图3)。
在终质量浓度为0.2、0.5、1.0、1.5 和2.0 mmol/L IPTG与不加IPTG的条件下,37 ℃分别对含重组质粒pET28a-GhVHA-A的大肠杆菌进行4 h诱导表达,对pET28a空载体在0.5 mmol/L IPTG诱导表达4 h,其表达产物的SDS-PAGE电泳检测结果(图4)显示,在5个不同质量浓度的IPTG诱导下,均能诱导出目的蛋白,且所表达蛋白大小与预期蛋白分子量相一致,而pET28a空载体则没有融合蛋白表达,表明0.2 mmol/L IPTG诱导获得最佳的蛋白诱导效果。
2.3 重组大肠杆菌BL21 (pET28a-GhVHA-A)的抗逆性分析
为检测不同逆境胁迫条件下过表达GhVHA-A对重组大肠杆菌的作用, 将BL21/pET28a和BL21/GhVHA-A菌体分别滴加到含0.5 mol/L NaCl和20% PEG6000的LB固体培养基上,观察菌落的形成情况(图5,A)。结果显示,在无添加胁迫因子的LB固体培养基中,BL21/GhVHA-A和对照BL21/pET28a之间在克隆形成数方面没有明显的差别;当LB培养基上添加了0.5 mol/L NaCl后,重组菌的数量明显高于对照BL21/pET28a,这一结果表明过表达GhVHA-A能显著增强大肠杆菌对盐的耐受性。同样在PEG6000胁迫下,经胁迫处理后BL21/pET28a菌落数量明显低于重组菌BL21/GhVHA-A的。该结果表明,过表达GhVHA-A能显著增强大肠杆菌对干旱胁迫的抗性。
对菌落形成率测定结果(图5,B)显示,稀释10倍的菌液在0.5mol/L NaCl高盐胁迫和20% PEG6000干旱胁迫下,重组菌BL21/GhVHA-A的菌落形成率分别为39.4%和43.8%,而对照的菌落形成率仅为17.4%和13.6%;胁迫条件下,重组菌的菌落形成率是对照的2~3倍,表明过表达GhVHA-A显著提高宿主菌对盐和干旱的抗性,与菌落定性分析结果一致。
对经IPTG诱导4 h后的重组菌BL21/pET28a-GhVHA-A和对照菌BL21/pET28a在NaCl(0.5 mol/L)和PEG6000 (20% )处理下菌株的生长情况进行了分析,以无胁迫处理的重组和对照菌液作为对照。结果表明,在正常培养基中,对照菌和重组菌的生长状况基本一致,2个菌株的生长均呈典型的“S”曲线,并很快进入对数生长期,这一现象说明GhVHA-A基因表达几乎不影响大肠杆菌BL21(DE3)的正常生长(图6,A)。将重组菌BL21/pET28a-GhVHA-A和对照菌BL21/pET28a转接到含NaCl (0.5 mol/L) 和PEG6000 (20%)培养基时,OD600值测定结果表明(图6,B、C),在胁迫处理下,随着时间的延长,重组菌BL21/pET28a-GhVHA-A均有不同程度的持续生长,OD600值呈上升趋势,静止生长期最大的OD600值接近2.5,而对照菌BL21/pET28生长较为缓慢,在静止生长期最大的OD600值仅接近1.5。从以上结果可以看出,重组菌对盐和干旱的抗性明显高于对照菌,即GhVHA-A基因的表达提高了重组菌的抗逆性。
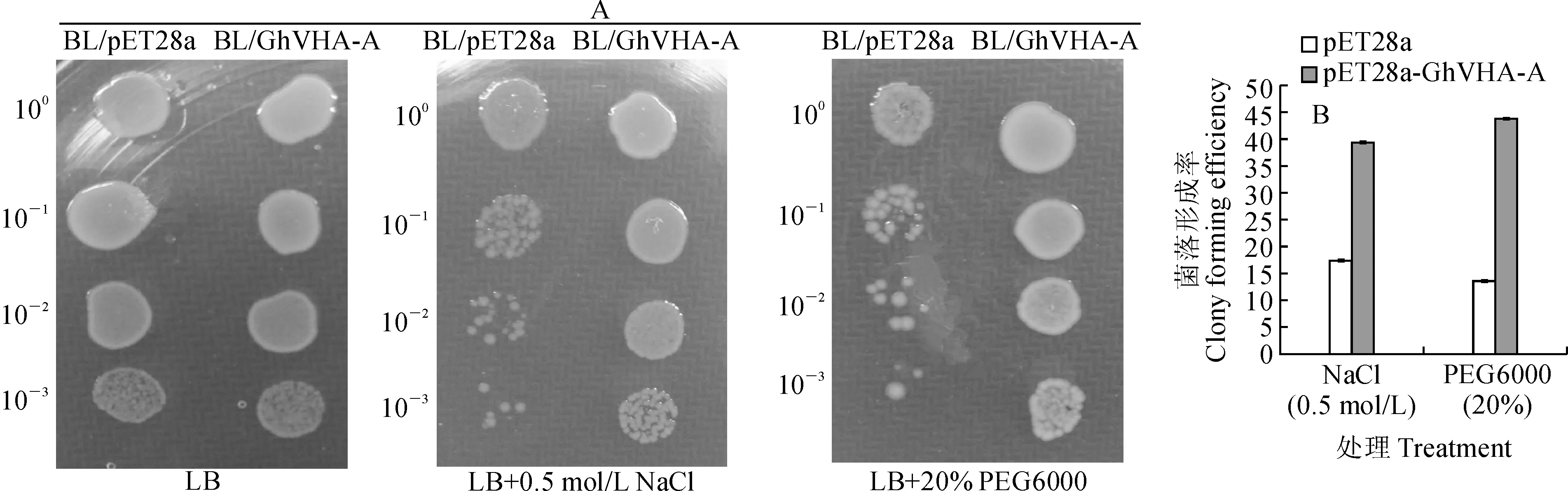
A.菌液滴板试验;B.菌落形成率测定图5 GhVHA-A蛋白过表达对大肠杆菌在逆境胁迫下的保护效果A. Spotting assays; B. Colony forming efficiency assaysFig.5 Effects of GhVHA-A over-expression on protection of E.coli against injury under abiotic stress
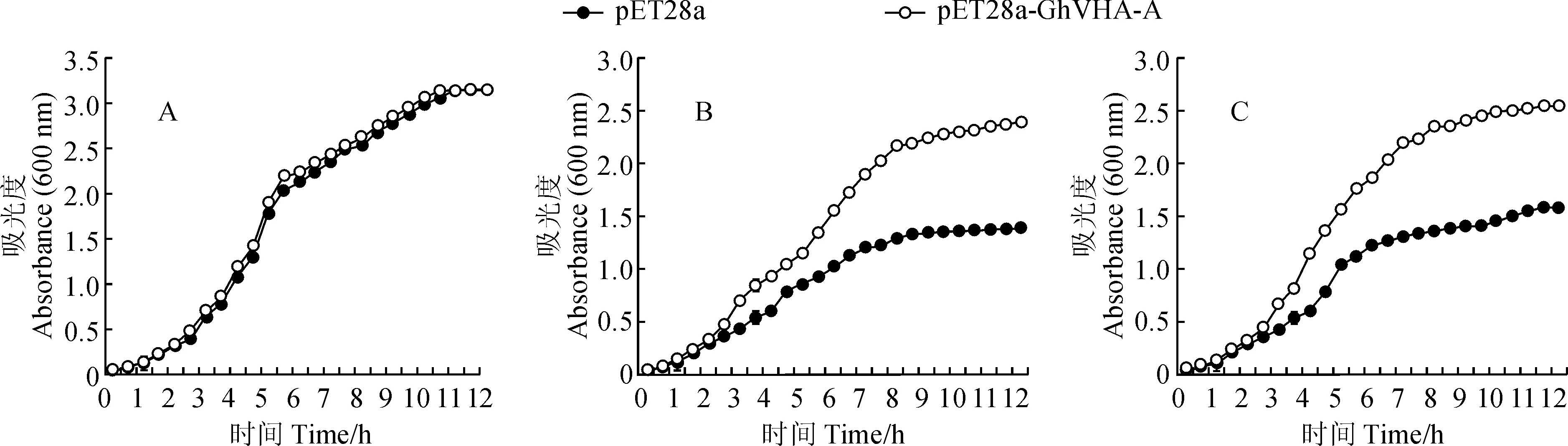
A. 无胁迫处理;B. 0.5 mol/L NaCl;C. 20%PEG6000图6 重组大肠杆菌和对照菌株在不同胁迫处理下的OD600测定结果A. Control; B. 0.5 mol/L NaCl stress; C. 20% PEG6000Fig.6 Detection of OD600 value of recombinant strain and control strain in different stresses
3 讨 论
液泡膜H+-ATPase在维持细胞质的pH、Ca2+浓度、水势平衡等方面发挥重要功能,在维持代谢物稳态以及逆境适应方面都处于中心地位[9-10],同时它还受到干旱、高盐、低温及脱落酸信号的调节。夏朝晖等[11]证明专性CAM植物燕子掌离体叶片的干旱胁迫处理48 h后、失水12.4%,可引起燕子掌V型H+-ATP酶的活性上升。李艳艳等[12]证明NaCl胁迫下盐地碱蓬液泡膜H+-ATPase活性及其H、c亚基在转录水平上协同上调,为Na+区隔化到液泡中提供了质子驱动力。本研究中棉花液泡膜H+-ATPase基因GhVHA-A在干旱和高盐处理下表达都有上调,由此推测GhVHA-A的表达和积累与棉花抗逆性密切相关。
大肠杆菌表达系统具有遗传背景和生化特性非常清楚、操作简便、成本低、周期短、表达蛋白可大量生产,且易于纯化等优点[13]。近几年,科学家们提出功能筛选法分离植物抗逆相关基因,即利用单细胞生物如大肠杆菌等与高等植物在一些抗逆胁迫应答反应上的相似性,以及一些抗逆基因的功能保守性和互补性,使高等植物基因在大肠杆菌异源体系中表达,结合渗透胁迫、高盐等筛选法,从而获得植物抗逆相关基因。目前研究表明,通过在大肠杆菌中的功能筛选已经分离获得了与植物一些逆境胁迫相关的基因。余玉雯等[14]利用大肠杆菌表达体系功能筛选法,获得了11个大豆耐盐相关克隆。其中将GmAIP-2与高效表达载体pET28a连接后转化大肠杆菌,其转化子在胁迫培养基中生长状况明显好于对照菌。Adriana等[15]的研究结果表明植物LEA蛋白的表达直接有助于增加细菌宿主细胞的胁迫耐受性。
大肠杆菌表达体系不仅是筛选高等植物抗逆基因的快速的、有效的体系,也是进行抗逆基因功能鉴定和抗逆机制研究的一个良好系统[13]。Neha等[16]研究首次描述了鱼腥藻螯合素合酶(PCS)基因转化大肠杆菌细胞,能够使大肠杆菌细胞在47 ℃、6%NaCl(w/v)和碳氟呋喃(0.025 mg/mL)下比对照细胞生长得更好。张弢[17]研究重组大肠杆菌BL21 (pET28a-BoPGIP1)对NaCl(0.4 mol/L)、NaHCO3(0.2 mol/L)和PEG6000(20%)的抗性明显高于对照菌株BL21(pET28a)。本研究将棉花GhVHA-A基因转化到原核细胞大肠杆菌BL21(DE3)中,在IPTG诱导条件下目的基因得到有效的表达,并且重组菌株较对照菌抗逆性获得了明显提高。这说明过表达GhVHA-A具有增强大肠杆菌抗旱、耐盐的能力,同时也证明了采用大肠杆菌原核表达系统对抗逆相关蛋白进行筛选和功能验证的可行性。而GhVHA-A基因同时也受脱水、高盐等非生物胁迫诱导表达,可以推测原核和真核生物在胁迫条件下可能具有相似的保护机制。
总之,本研究前期通过RT-PCR方法已成功克隆了棉花GhVHA-A基因的ORF序列,推测完整的开放阅读框编码的蛋白由623个氨基酸残基组成,预测的蛋白质理论分子量为68.41 kD。本研究为进一步了解GhVHA-A蛋白的功能,利用原核表达系统异源表达GhVHA-A蛋白到大肠杆菌中,能显著增强宿主菌对模拟干旱和高盐胁迫的耐受性。这一结果为下一步研究GhVHA-A基因遗传转化提高模式植物烟草的抗胁迫能力提供试验基础,为下一步研究该基因的功能提供了依据。
参考文献:
[1]简令成,王红.逆境植物细胞生物学[M].北京:科学出版社,2009:115-139.
[2]JASPERS P, KANGASJARVI J. Reactive oxygen species in abiotic stress signaling [J].PlantPhysiology, 2010,138(4):405-413.
[3]BOYER J S. Plant productivity and environment [J].Science,1982,218(4 571):443-448.
[4]王延枝,许献忠.空泡膜类型的V-ATPase的研究进展[J].生物化学与生物物理进展,1993,20(1):19-23.
[5]THIERRY M, ANNICK F, CLAUDINE T. The tonoplast H+-ATPase ofAcerpsedoplatanusis a vacuolar-type ATPase that operates with a phosphoenzyme intermediate[J].PlantPhysiol., 1995,109(1):285-292.
[6]RATAJAZAK R. Structure function and regulation of the plant vacuolar H+-translocating ATPase[J].BiochimicaetBiophysicaActa,2000,1465(1-2):17-36.
[7]ROYTRAKUL S,VERPOORTE R. Role of vacuolar transporter proteins in plant secondary metabolism:Catharanthus roseus cell culture[J].PhytochemRev., 2007,6(2):383-396.
[8]刘娜,倪志勇,曲延英,等.棉花液泡膜H+-ATPase A亚基的克隆及表达载体的构建[J].分子植物育种,2015,13(3):541-546.
LIU N, NI Z Y, QU Y Y,etal. Cloning of subunit A of V-H+-ATPase in cotton and constructing its plant expression vector[J].Mol.PlantBreeding, 2015,13(3):541-546.
[9]NISHI T, FORGAC M. The vacuolar (H+)-ATPase-nature’s most versatile proton pumps[J].Nat.RevMol.CellBiol., 2002,3(2):94-103.
[10]STROMPEN G, DETTMER J, STIERHOF Y D,etal.Arabidopsisvacuolar H+-ATPase subunit E isoform 1 is required for Golgi organization and vacuole function in embryogenesis[J].PlantJ., 2005,41(1):125-132.
[11]夏朝晖,李晓薇,余和芬,等.盐和干旱胁迫对燕子掌(CrassulaagentenThunb.)叶片液泡膜H+-ATPase活性的影响[J].植物生理学报,2000,26(5):433-436.
XIA Z H, LI X W, YU H F,etal. Effects of salt and drought stress on H+-ATPase in the tonoplast of leaf cell ofCrassulaagentenThunb.[J].PlantPhysiologyJournal, 2000,26(5):433-436.
[12]李艳艳,李平华,王宝山.盐胁迫下盐地碱蓬叶片液泡膜H+-ATPase H亚基的克隆与表达分析[J].西北植物学报,2006,26(1):63-67.
LI Y Y, LI P H, WANG B S.Cloning and expression of subunit H of V-H+-ATPase in vacuole membrane in the leaves of the halophyteSuaedasalsaunder salt stress[J].ActaBotanicaBoreali-OccidentaliaSinica, 2006,26(1):63-67.
[13]GOWRISHANKAR J. Identification of osmoresponsive genes inEscherichiacoli: evidence for participation of potassium and proline transport systems in osmoregulation[J].JournalofBacteriology,1985,164(1):434
[14]余玉雯,孙海丹,麻晓亮,等.大豆耐盐相关基因的分离及其功能鉴定[J].深圳大学学报,2004,21(4):324-330.
YU Y W, SUN H D, MA X L,etal.Isolation and characterization of genes related to salt-tolerance in soybean[J].JournalofShenzhenUniversityScienceandEngineering, 2004,21(4):324-330.
[15]GARAY A A, COLMENERO F J M, GARCIARRUBIO A,etal. High hydrophilic proteins in prokaryotes and eukaryotes are common during conditions of water deficit[J].J.Biol.Chem., 2000,275(8):5 668-5 674.
[16]NEHA C, YOGESH M, LAL C R.Cloning expression and analysis of phytochelatin synthase (pcs) gene fromAnabaenasp. PCC 7120 offering multiple stress tolerance inEscherichiacoli[J].BiochemicalandBiophysicalResearchCommunications,2008,376(1):225-230.
[17]张弢.青花菜BoPGIP1基因的原核表达及其重组大肠杆菌的抗逆性分析[J].华北农学报,2015,30(1):24-28.
ZHANG T. Prokaryotic expression ofBoPGIP1 gene fromBroccoliand stress tolerance ofE.coliBL21 expressingBoPGIP1 gene[J].ActaAgriculturaeBoreali-Sinica, 2015,30(1):24-28.
