EphrinA1-caspase-3对乳腺癌细胞的体外靶向性抑制作用❋
2018-04-08李艳娇张本斯
黄 煜 李艳娇 张本斯 李 庄 张 覃 赵 斌△
(大理大学, 1 基础医学院解剖学教研室, 2 附属医院胸外科, 大理 671000)
在发展中国家,由于预期寿命增加,城市化扩大和采用西方生活方式,乳腺癌发病率正在上升。乳腺癌的发生、发展与体内信号通路的异常及癌基因的表达产物密切相关,这也使得分子靶向治疗成为乳腺癌治疗的研究热点。细胞凋亡阻断是包括乳腺癌在内的恶性肿瘤的最大特征,细胞凋亡功能的抑制将导致肿瘤的发生及免疫功能的异常[1]。探讨乳腺癌细胞凋亡信号通路异常分子机制,诱导其重新进入凋亡周期可能是治愈乳腺癌的最根本途径[2]。EphA2受体为受体酪氨酸激酶家族成员之一,主要配体为EphrinA1。EphA2高表达于多种恶性肿瘤和细胞系,与许多肿瘤的组织学分级、淋巴结转移及预后相关,已成为肿瘤治疗的研究新靶点[3]。凋亡效应分子caspase-3位于凋亡通路枢纽,caspase-3活化能引起细胞凋亡[4]。如果能确认重组Ad-EphrinA1-caspase-3对体外乳腺癌细胞的靶向性抑制作用将会为乳腺癌的分子靶向治疗提供新的治疗途径。
1 材料和方法
1.1 材料与试剂
基因和组织(来自大理大学附属医院病理科),重组Ad-EphrinA1-caspase-3、T淋巴细胞、乳腺癌组织和乳腺组织;D-Hanks液、胶原酶、胰酶、PBS、多聚甲醇、Triton X-100、胎牛血清、Rabbit anti-EphA2(Invirogen, Catalog No. 34-7400)、Rabbit anti-EphrinA1(Invirogen,Catalog No.343300)、FITC标记的羊抗兔Ig(G+M)抗体(Thermo Fisher,Catalog No.A16097),MTT溶液、DMSO、抗EphrinA1的血清、Annexin V-FITC、PI和Binding Buffer。
1.2 乳腺癌细胞的分离
用D-Hanks液清洗所取得的乳腺癌组织和乳腺组织,去除表面血污,并用手术镊去除黏附的结缔组织等非培养所需组织,清洗后用手术刀将组织切成若干小块,移入5 ml离心管中,加入适量缓冲液后将组织反复剪切成糊状,约1 mm大小。静置片刻后,用吸管吸去上层液体,加入适当的缓冲液再清洗1次后过200目筛网并收集滤液,将未过筛网的组织块用0.25%的胶原酶在37℃摇床振荡消化1 h,消化完成后将消化液过筛网并收集细胞液。将前2次收集的液体合并放入50 ml离心管中,以1 000 r/min离心5 min,去除上清,用培养液将细胞数调整为(2~5)×105个/ml,分装于培养瓶中,置CO2培养箱内,5% CO2,37℃静置培养。采用反复贴壁法逐渐去除分离细胞中的成纤维细胞,最终得到纯化后的乳腺细胞和乳腺癌细胞。
1.3 乳腺癌细胞的鉴定
取分离培养的人乳腺细胞和乳腺癌细胞用胰酶消化计数后接种于48孔板内,过夜培养后用间接免疫荧光法(IFA)检测细胞中EphA2受体及EphrinA1的表达,主要操作如下:4.0%多聚甲醇固定10 min,用0.1% Triton X-100透化10 min,用含10%胎牛血清的PBS 37℃封闭1 h,加入1∶1 000稀释的Rabbitanti-EphA2(Invirogen, Catalog No. 34-7400)或Rabbit anti-EphrinA1(Invirogen, Catalog No. 34-3300)一抗,37℃作用1 h,FITC标记的羊抗兔Ig(G+M)抗体(Thermo Fisher, Catalog No. A16097)37℃作用1 h,荧光显微镜观察拍照。
1.4 EphrinA1-caspase-3对乳腺癌细胞增殖的影响
使用MTT法检测重组Ad-EphrinA1-caspase-3感染T淋巴细胞培养上清对EphA2阳性乳腺癌细胞的体外增殖的影响,主要操作如下:(1)用分离的正常乳腺细胞和乳腺癌细胞铺96孔板,每个孔中接种5×103个细胞,过夜培养后吸去旧培养基和未贴壁细胞;(2)分别加入梯度稀释的正常T淋巴细胞培养上清或重组Ad-EphrinA1-caspase-3感染T淋巴细胞上清(100、50、25 μl和0 μl)并补齐到100 μl/孔,放入37℃培养箱进行培养;(3)分别在24、48和72 h后取培养板进行MTT检测;(4)每孔中加入10 μl MTT溶液(5 mg/ml),继续在细胞培养箱培养4~6 h;(5)小心吸去孔内培养液并在每孔加入150 μl的DMSO,置摇床上低速振荡10 min,使结晶物充分溶解;(6)加DMSO后10 min内,用酶标仪检测各孔波长570 nm的吸光值,并计算细胞生长抑制率(%)=(1-药物组OD值/对照组OD值)×100%。
1.5 EphrinA1-caspase-3对乳腺癌细胞凋亡的影响
使用流式细胞仪检测重组Ad-EphrinA1-caspase-3感染T淋巴细胞上清对乳腺癌细胞凋亡的影响,主要操作如下:(1)乳腺癌细胞铺6孔板,每个孔中接种5×105个细胞,过夜培养后吸去旧培养基和未贴壁细胞;(2)分别加入梯度稀释的重组EphrinA1-caspase-3感染T淋巴细胞上清,以未感染T淋巴细胞上清作对照,37℃培养72 h;(3)收集培养上清,细胞用胰酶消化后与上清一起离心收集细胞;(4)将细胞重悬于200 μl Binding Buffer;(5)加入10 μl Annexin V-FITC和 10 μl PI,轻轻混匀,避光室温反应15 min或4℃反应30 min;(6)加入300 μl Binding Buffer,在1 h内用流式细胞仪检测。
1.6 EphrinA1-caspase-3对靶细胞杀伤效应的特异性
为了进一步检测感染上清中EphrinA1-caspase-3对靶细胞杀伤效应的特异性,使用抗体中和实验观察EphrinA1能否拮抗重组EphrinA1-caspase-3 T淋巴细胞对EphA2阳性乳腺癌细胞的杀伤作用,抗体中和实验主要操作如下:(1)抗EphrinA1的血清56℃灭活30 min;(2)于96孔板每个孔中预先加入50 μl无血清培养基,取灭活后的血清从第1列开始连续进行2倍浓度梯度稀释;(3)加入50 μl EphrinA1-caspase-3感染上清,混匀后于37℃培养箱孵育60 min;(4)向感染上清与血清混合液中加入50 μl乳腺癌细胞或正常乳腺细胞(密度1×104cells/孔);(5)细胞培养板于37℃、5% CO2培养箱中培养72 h后用MTT法检测细胞存活情况。
1.7 统计学处理
采用SPSS 20.0统计软件进行分析,两组间比较采用t检验,分析抗体稀释度与细胞增殖相关性采用直线相关分析。
2 结果
2.1 乳腺癌细胞的分离培养
通过反复贴壁法分离细胞中的的成纤维细胞,得到纯化后的乳腺细胞和乳腺癌细胞。乳腺癌细胞生长快,呈梭形、多边形等多种形态,聚集成巢状,贴壁生长(图1)。
2.2 乳腺癌细胞的鉴定
EphrinA1和EphA2阳性着色部位在细胞膜和细胞质,结果表明正常乳腺细胞中几乎没有EphA2受体及EphrinA1的表达,而乳腺癌细胞中可见高水平的EphA2受体及EphrinA1表达(图2)。
图1 正常乳腺细胞(A)和乳腺癌细胞(B)培养,×100Fig 1 Normal breast cells(A) and breast cancer cells (B) culture,×100
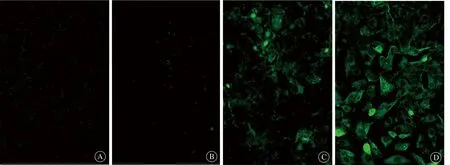
图2 间接免疫荧光检测乳腺癌细胞EphrinA1染色,×100Fig 2 Indirect immunofluorescence identification of breast cancer cells,EphrinA1,×100A, C: Normal and breast cancer cells; B, D: EphA2 staining for normal and breast cancer cells
2.3 EphrinA1-caspase-3对乳腺癌细胞增殖的影响
结果显示(图3),Ad-EphrinA1-caspase-3液感染对正常乳腺细胞的生长的影响性不大,对乳腺癌细胞表现出强烈的生长抑制作用(P<0.05),Ad-EphrinA1-caspase-3液对乳腺癌细胞生长的抑制率为48.9%。
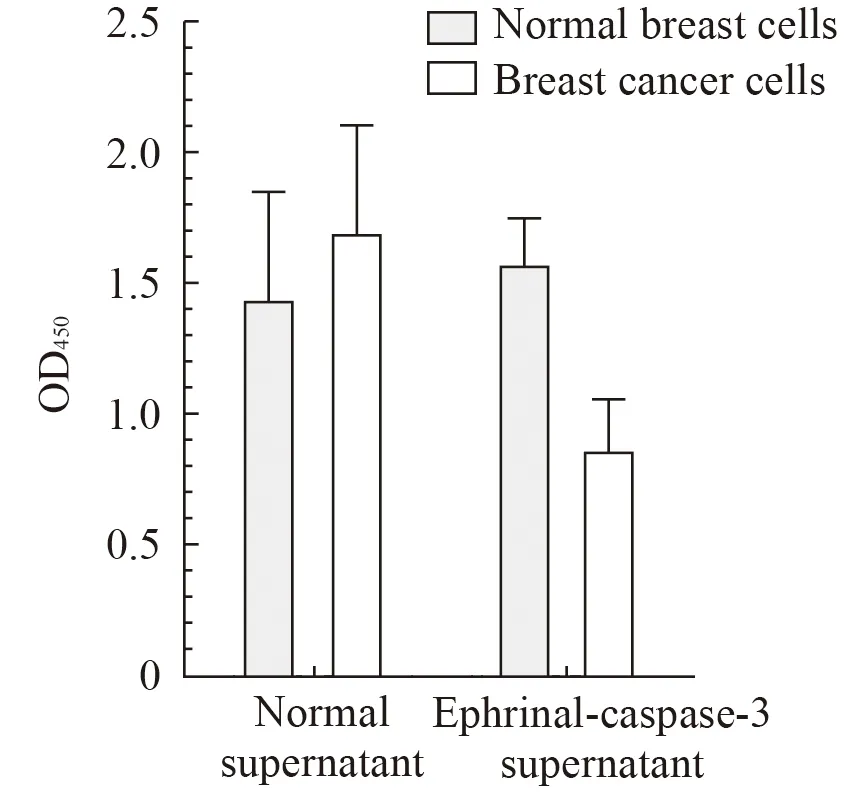
图3 EphrinA1-caspase-3对乳腺癌细胞增殖的影响Fig 3 Effect of EphrinA1-caspase-3 on cell proliferation of brest cancer cells
2.4 EphrinA1-caspase-3对乳腺癌细胞凋亡的影响
上清稀释度为0、1、2、4、8对应的凋亡率为36%、24%、18%、8%、 7%,显著高于对照组4%(P<0.05),表明EphrinA1-caspase-3能够促进EphA2阳性乳腺癌细胞的凋亡,且呈浓度依赖性。
2.5 抗体中和实验
结果显示(图4),随着抗体稀释度的增加细胞的增殖也随着增加(r=0.994,P=0.001),证明中和抗体能有效的减弱重组EphrinA1-caspase-3对EphA2阳性乳腺癌细胞的杀伤作用,同时也证明EphrinA1-caspase-3能特异性的抑制乳腺癌细胞的生长。

图4 中和抗体实验Fig 4 Neutralizing antibody test
3 讨论
细胞凋亡在生物体内是普遍存在的现象,具有重要的生物学意义[5]。细胞凋亡异常在多种恶性肿瘤的发生、发展中占有十分重要的地位。在肿瘤治疗方面,放疗、化疗、内分泌治疗均可导致肿瘤细胞凋亡,并且可能是肿瘤细胞死亡的主要形式[6]。Caspase-3是细胞凋亡蛋白酶家族caspase的重要一员,是位于级联反应下游的调控效应分子,被认为是凋亡的执行者[7-8]。而本实验Ad-EphrinA1-caspase-3感染上清对乳腺癌细胞增殖表现出强烈的抑制作用,生长抑制率达到 48.9%,表明EphrinA1-caspase-3Ad-EphrinA1-caspase-3感染上清能抑制乳腺癌细胞的增殖。黄凌燕等[9]研究显示caspase-3蛋白含量的降低与乳腺癌细胞凋亡减少有关,和本实验结果一致,且EphrinA1-caspase-3促进乳腺癌细胞的凋亡呈浓度依赖性。
Eph基因家族是最大的RTKs家族成员, EphA2是该家族中被发现具有酪氨酸激酶活性的第1个基因。EphA2定位于人染色体 1p36.1, 编码1个含有976个氨基酸残基的多肽, 为膜结合Ⅰ型糖蛋白。EphA2广泛高表达于许多人类肿瘤, 前列腺癌[10]、乳癌[ 11]、恶性黑色素瘤[ 12]、非小细胞肺癌[ 13]、结肠癌[ 14]及卵巢癌[ 15]等多种实体瘤中均存在 EphA2受体高表达。EphA2受体在恶性肿瘤中高表达的可能机制为蛋白质稳定性增加、基因表达失调[16]。赵玉斌等[17]研究显示EphA2过表达于乳腺癌组织中,且表达强度随乳腺癌恶性度的增高而增强,本研究在乳腺癌细胞的鉴定中也得出正常乳腺细胞中几乎没有EphA2受体及EphrinA1的表达,而乳腺癌细胞中可见高水平的EphA2受体及EphrinA1表达,且EphA2、EphrinA1主要表达于肿瘤细胞和血管内皮细胞的胞质和胞膜, 呈棕黄色或棕褐色[18]。它们在乳腺癌的阳性率与病理类型、肿瘤大小、淋巴结转移、临床分期和组织学分级相关[19]。EphA2有望成为诊断乳腺癌1个新的标志物和分子治疗的靶点。
EphrinA1是EphA2受体的主要配体之一。EphrinA1和EphA2在许多恶性肿瘤组织和肿瘤相关血管内皮细胞共同表达,这种重叠表达模式允许EphrinA1和EphA2的充分接触[20]。在抗体中和实验中,中和抗体能有效减弱重组EphrinA1-caspase-3对EphA2阳性乳腺癌细胞的杀伤作用,结合以上实验结果说明EphrinA1-caspase-3能特异性抑制乳腺癌细胞的生长。
