血清与全反式维甲酸对神经干细胞分化及突起生长的作用差异❋
2018-04-08赵海霞任丽伊李云竹李淑蓉苏炳银
赵海霞 任丽伊 左 璇 李云竹 李淑蓉 苏炳银△
(成都医学院, 1 发育与再生四川省重点实验室,>2 人体解剖与组织胚胎学教研室, 3 病理学与病理生理学教研室, 成都 610500)
神经干细胞(neural stem cells, NSCs)是一群具有自我增殖和分化潜能的细胞,可修复和替代神经退行性疾病中受损的神经细胞,重建细胞环路和功能,随着神经干细胞研究的迅速发展,为神经退行性疾病的治疗提供了新的途径[1-2]。 NSCs[1]经各级神经前体细胞,可分化为成熟的神经细胞和神经胶质细胞[3]。因此,调控NSCs定向分化是目前应用于治疗的关键。目前,用于NSCs分化模型建立的主要诱导方式是血清和全反式维甲酸(all-trans-retinoic acid, RA)诱导,本研究拟利用血清和RA分别诱导从胚胎小鼠分离并培养的NSCs,比较两者对NSCs的分化以及神经元突起生长的作用差异,为NSCs分化机制研究的模型选择提供基础实验依据。
1 材料和方法
1.1 实验动物
SPF级C57雌性和雄性小鼠(2~3个月年龄)购于成都达硕实验动物有限公司。
1.2 主要试剂
小鼠单克隆抗体nestin(ab6142)和小鼠单克隆抗体Map2(ab11267)、兔多克隆抗体GFAP(ab7260)购自Abcam公司;594标记的山羊抗小鼠IgG荧光二抗和488标记的羊抗兔IgG荧光二抗488购自Invitrogene公司;DMEM/F12(1∶1)基本培养基、胎牛血清、青霉素-链霉素双抗溶液、Accutase酶、B27、GlutaMax、Heparin购自Gibco公司;碱性成纤维生长因子(basic fibroblast growth factor, bFGF)和表皮生长因子(epithelial growth factor, EGF)购自PeproTech公司; RA、多聚赖氨酸(poly-D-lysine, PDL)购自Sigma公司;DAPI封片剂购自中杉金桥生物技术公司。
1.3 NSCs分离和培养
将2~3月龄发情期的雌性小鼠与雄性小鼠交配过夜,次日早晨检栓阳性的小鼠为妊娠期0.5 d。收集胚龄E12.5 d的胎鼠,分离脑皮质组织,并用Accutase酶在37℃处理10 min,同时用枪轻轻吹打,使组织解离成单细胞,然后通过40 μm细胞筛滤过。细胞悬液以 1 000 r/min离心5 min,去上清。加入NSCs培养基重悬细胞沉淀,以2105 cells/ml的密度接种到培养板中,置于37℃、5% CO2培养箱中进行培养。每3 d半量换液[3],6~7 d后收集增殖形成的神经球,消化成单细胞,进行传代培养。NSCs培养基成分:DMEM/F12、1%青霉素-链霉素双抗溶液、1% GlutaMax、2 μg/ml Heparin、2% B27、20 ng/ml bFGF、20 ng/ml EGF。
1.4 NSCs诱导分化
收集传代培养2~3代的神经球,消化成单细胞,以2×105cells/ml的密度接种到已用PDL包被的24孔培养板中,并加入诱导分化培养基,置于37℃、5% CO2培养箱中进行培养3 d或者7 d。每3 d换液1次。诱导分化培养基:DMEM/F12、1%青霉素-链霉素双抗溶液、1% GlutaMax、2 μg/ml Heparin、2% B27、2%血清或者1 μmol/L RA。
1.5 免疫荧光染色
将24孔培养板中的分化培养基吸出,加入预冷的PBS轻轻清洗1次,然后用4%多聚甲醛于室温固定30 min。PBS洗涤3次,封闭液(含10%羊血清和0.3% Triton X-100)室温封闭1 h,一抗(1∶200)4℃孵育过夜。二抗(1∶400)室温孵育1 h。加入DAPI封片剂,荧光显微镜观察并拍照。
对于神经球的免疫荧光染色,需提前将培养6~7 d的神经球接种到PDL包被的培养板中,贴壁2~3 h。方法同前,用4%多聚甲醛固定,进行抗体孵育、荧光显微镜观察并拍照。
1.6 图像定量分析
使用Adobe Photoshop图像处理软件计数免疫荧光染色阳性的细胞数目和DAPI染色的总细胞数目,分析免疫荧光染色阳性的细胞数目占DAPI染色的总细胞数目的百分比。其中在每个时间点,每个诱导组含5个生物学重复,每个重复在荧光显微镜下拍摄3个区域用于计数。使用Image-Pro Plus(IPP)图像处理分析软件测量Map2阳性的神经元突起的数目,以及突起的长度。其中在每个时间点,每个诱导组含5个生物学重复,每个重复分别统计60个Map2阳性的神经元的突起数目,并测量60个突起的长度。
1, 7 统计学处理

2 结果
2.1 NSCs培养及鉴定
E12.5 d的胎鼠脑皮质组织被解离成单细胞后,在NSCs培养基中培养。2 d后,原代培养的NSCs增殖,可见4~6个细胞聚集在一起(图1A,见封底);4 d后,NSCs增殖形成约50 μm直径的神经球(图1B,见封底);6 d后,NSCs增殖形成约100 μm直径的神经球(图1C,见封底)。原代培养的神经球收集后,重新消化成单细胞传代培养,6~7 d后NSCs再次增殖形成神经球。将传代3次后形成的神经球,用免疫荧光检测NSCs的标记分子nestin的表达。检测显示神经球中的细胞为nestin阳性的NSCs(图1D-F,见封底)。
2.2 血清和RA诱导对神经元分化的影响
神经球传代3次后,消化成单细胞,接种于PDL包被的24孔培养板中,分别用血清诱导培养基和RA诱导培养基诱导NSCs 3 d或7 d。诱导3 d后,NSCs可分化为神经元,并能被神经元标记分子Map2所标记(图2,见封底)。统计分析显示,诱导3 d后,RA诱导组中Map2阳性细胞占总细胞的比例显著高于血清诱导组(P<0.01)(图4A)。诱导7 d后,免疫荧光检测显示仍有Map2阳性的神经元(图3),RA诱导组中的Map2阳性的细胞占总细胞的比例仍显著高于血清诱导组(P<0.01)(图4A)。但是随着诱导时间的延长,Map2阳性的神经元所占比例在血清诱导组中显著降低(P<0.05),在RA诱导组中没有明显变化(图4A)。
2.3 血清和RA诱导对星形胶质细胞分化的影响
血清诱导培养基和RA诱导培养基不仅能诱导NSCs分化为神经元,也能分化为星形胶质细胞,并被星形胶质细胞的标记分子GFAP所标记(图2-3,见封底)。免疫荧光检测显示诱导3 d或7 d后,血清诱导组中GFAP阳性的星形胶质细胞占总细胞的比例都显著高于RA诱导组(P<0.01和P<0.01)(图4B)。与诱导3 d相比,血清诱导组和RA诱导组中的GFAP阳性的星形胶质细胞所占的比例在诱导7 d后,都进一步显著升高(P<0.01)(图4B)。
进一步观察星形胶质细胞的形态显示,血清诱导组和RA诱导组中的胶质细胞形态差异较大。诱导分化3 d,血清诱导组的星形胶质细胞胞体较大,突起较短,呈原浆型,而RA诱导组中胶质细胞胞体较小,呈卵圆型,突起较长,但突起数目较少,呈放射性胶质细胞样(radial glia-like)形态(图2,见封底);诱导分化7 d,血清诱导组的星形胶质细胞仍呈原浆型(protoplasmic-like),而RA诱导组中的胶质细胞胞体变大,突起明显增多,较细,并且突起末端较膨大(图3,见封底)。
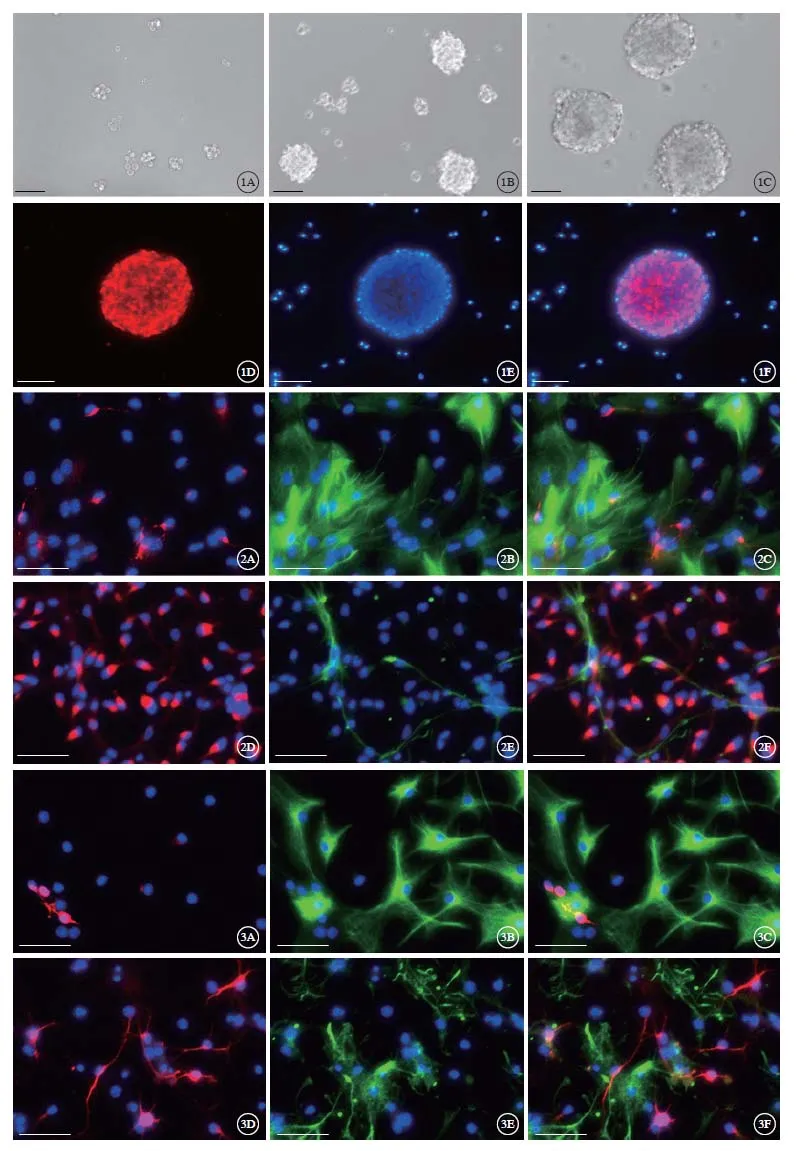
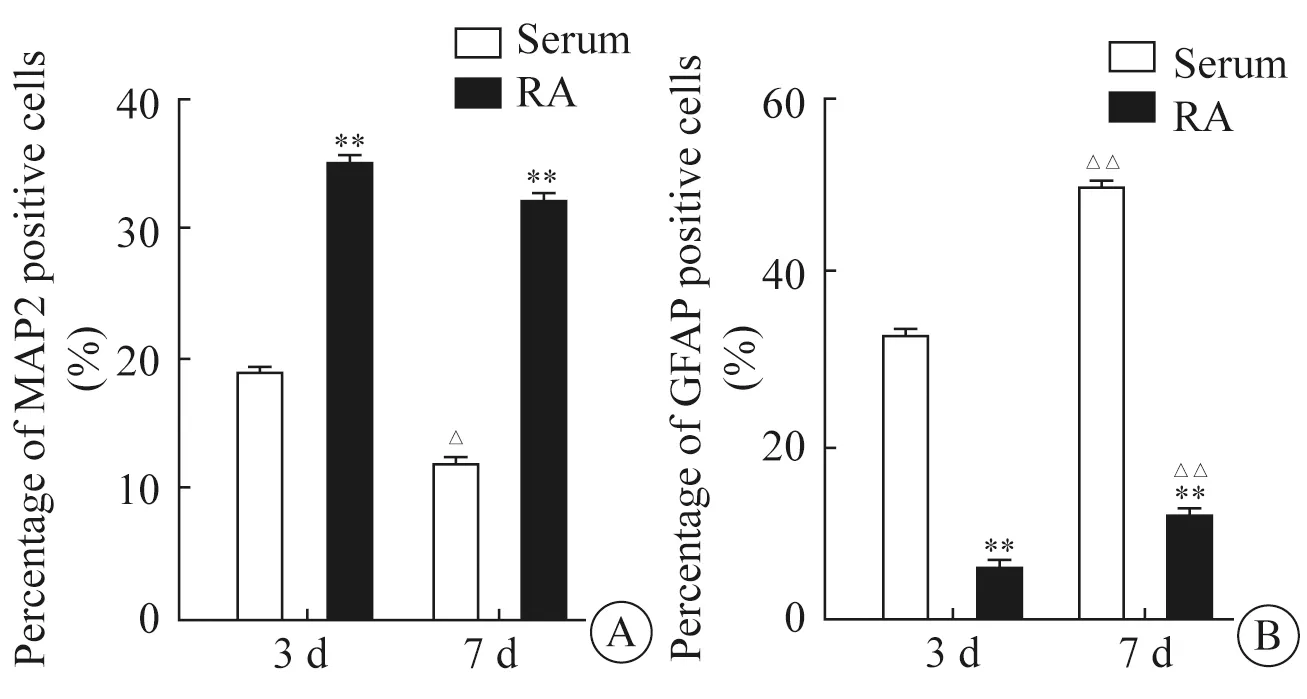
图4 血清和RA诱导对NSCs分化的影响Fig 4 The effects of serum and RA treatments on the differentiation of neural stem cells in vitro
2.4 血清和RA诱导对神经元突起生长的影响
为检测血清和RA诱导对神经元突起生长的影响,本研究首先统计分析了诱导分化3 d及7 d后神经元突起的长度。结果显示,诱导分化3 d后,RA诱导组中的神经元突起长度与血清诱导组中的没有差异,但是诱导7 d后,RA诱导组的突起长度明显长于血清诱导组(P<0.01)(图5A)。不仅如此,与诱导分化3 d相比,血清诱导组中神经元突起的长度在诱导7 d后没有明显变化,但是RA诱导组中的神经元突起长度在诱导 7 d 后显著增长(P<0.01)(图5A)。
进一步分析诱导分化神经元突起的数目显示,诱导分化3 d后,RA诱导组的神经元突起数目比血清诱导组少(P<0.01),但是诱导分化7 d后,RA诱导组的突起数目明显比血清诱导组多(P<0.01)(图5B)。另外,结果显示,随着诱导时间的延长,RA诱导组和血清诱导组中的突起数目都明显增加(P<0.05和P<0.01)(图5B)。
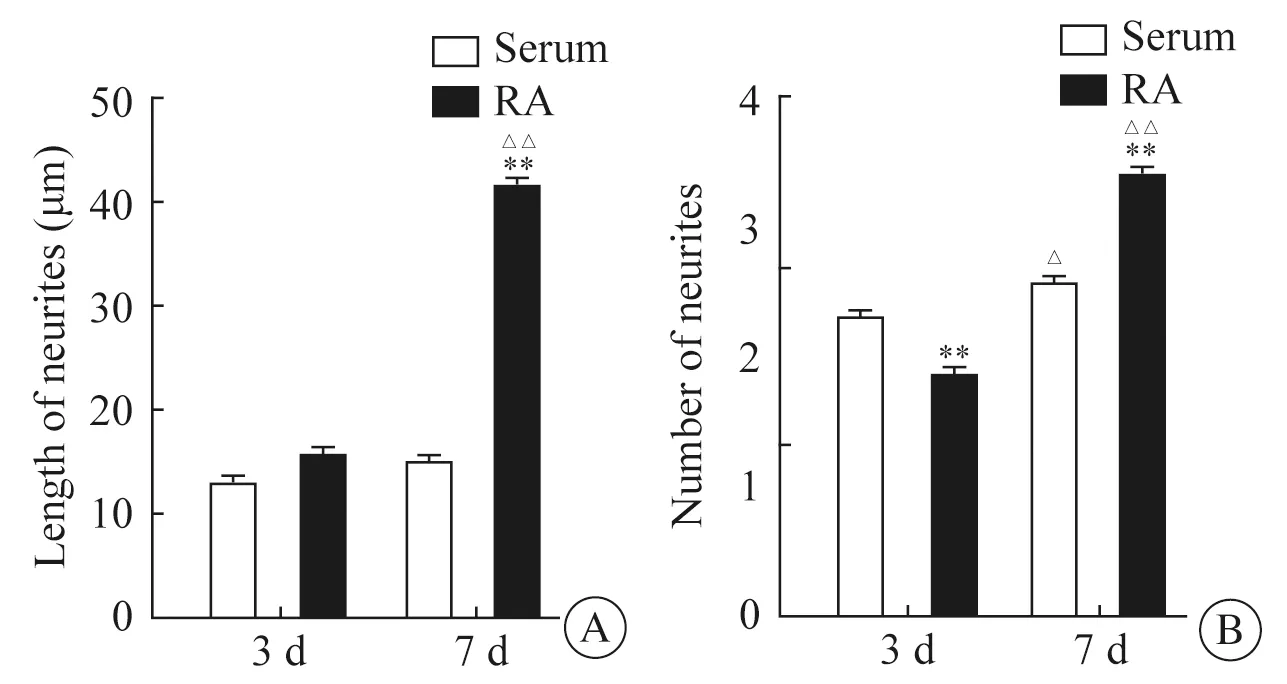
图5 血清和RA诱导对神经元突起生长的影响Fig 5 The effects of serum and RA treatments on the neurite outgrowth in vitro
3 讨论
NSCs由于其具有自我增殖和多向分化的能力,自Reynolds等[4]于1992年从成年小鼠纹状体分离后,便成为理论研究和临床应用的热点之一。NSCs的分化受到许多基因的有序调控,但目前这些基因的作用机制并未完全阐明。因此,许多研究利用RA诱导或血清诱导NSCs分化模型探讨NSCs的分化机制,为相关疾病的治疗提供理论基础。
血清含有多种营养成分,包括许多生长因子、激素等, 常被用作诱导因子诱导细胞分化。NSCs在血清培养基中,能先后分化为神经元、星形胶质细胞和少突胶质细胞[5]。已有研究表明血清浓度对NSCs分化为神经元或者胶质细胞有影响,低浓度血清有利于NSCs向神经元方向的分化[6-7]。RA作为维生素A的代谢中间产物,在脑发育及神经再生中具有重要作用,其可维持HRas蛋白的稳定性,从而促进NSCs向神经元方向的分化[8-9]。尽管如此,而高浓度的RA也会导致脑发育异常,胚胎畸形,主要认为是RA异常激活了胚胎发育中相关基因的表达及功能。在体外培养中,研究显示RA可通过调节RARs以及PPARβ/δ(过氧化物酶体增殖物激活受体β/δ)促进神经干细胞的分化,常作为诱导因子诱导NSCs、胚胎干细胞等分化为神经元,并且其在诱导分化模型中常用的浓度为1 μmol/L[10]。因此,本研究进一步比较了低浓度的血清(2%)和 1 μmol/L 浓度的RA对NSCs的分化以及对神经元突起生长的影响。
本研究表明RA比血清更易诱导NSCs分化为神经元。无论是短期诱导3 d,或者长期诱导7 d,RA诱导组中的神经元的比例明显比血清诱导组更高。不仅如此,在诱导NSCs分化过程中,RA诱导NSCs分化为神经元的持续周期更长。随着诱导时间从3 d延长至7 d,血清诱导组中的神经元比例显著降低,而RA诱导组中神经元比例变化不明显。在神经修复中,不仅需要提高损伤处的神经元的数目,也需要增强神经元的网络连接功能,因此,神经元的突起的生长是神经功能修复的关键之一[1]。Dmetrichuk等[11]的研究表明RA可诱导非脊椎动物静水椎实螺的神经元突起的生长。Chu等[12]的研究进一步证实并且RA能促进脊椎动物大鼠的NSCs衍生而来的神经元突起的生长。在比较血清和RA对诱导生成的神经元的突起生长的影响研究中显示,RA更利于促进神经元突起的生长。短期诱导形成的神经元突起的长度在两者之间没有差异,但是在长期诱导后,RA显著提高了突起的长度以及神经元突起的数目。另外,在短期诱导中显示,RA诱导的突起的数目比血清诱导的少,尽管如此,诱导时间延长后,RA诱导的突起数目明显增加,推测可能是RA比血清促进神经元成熟的时期稍晚。
已有报道证实RA不仅能诱导NSCs分化为神经元,也能诱导胶质细胞的产生[13]。本研究显示血清和RA诱导的胶质细胞的分化具有时间依赖性,随着时间的延长,两者诱导的胶质细胞的比例都不断增加。尽管如此,血清更易诱导NSCs分化为胶质细胞。相较于RA诱导组,血清诱导组中的胶质细胞的比例更高。 另外,本研究结果显示血清和RA诱导的胶质细胞形态不一致。其中,在诱导3 d后,RA诱导形成的胶质细胞具有放射性胶质细胞的形态特征,而血清中的胶质细胞形态呈原浆型胶质细胞形态。已有研究表明放射性胶质细胞具有分化神经元的潜能[14-15]。因此,推测RA在早期诱导形成的胶质细胞并未完全分化成成熟的星形胶质细胞,该细胞可进一步分化为部分神经元,利于维持在诱导后期的较高水平的神经元的比例。
