基于癌睾抗原CTNNA2长肽疫苗免疫活性检测❋
2018-04-08胡东昊王乔新刘凤云谢金枝李伟宏
胡东昊 王乔新 刘凤云 谢金枝 李伟宏
(1 焦作职工医学院, 焦作 454150; 2 郑州澍青医学高等专科学校, 郑州 450064)
近年来,随着各种恶性肿瘤的发病率及死亡率的增高[1],肿瘤的免疫治疗得到更广泛的关注,研究的热点也更倾向于开发新型肿瘤疫苗[2]。多肽疫苗作为一个很有潜力的肿瘤疫苗已经应用于各种肿瘤的免疫治疗中[3]。多肽疫苗在原有诱导细胞毒性T淋巴细胞(cytotoxic lymphocyte, CTL)能力的基础上也有新的进展,多表现在增强多肽疫苗抗肿瘤效应的策略方面。如提高CTL表位的免疫原性,与T辅助表位的联用,增加多肽的长度,克服HLA分子限制性等[4]。一些临床实验表明,与最小CTL表位单肽疫苗相比,用长肽进行疫苗接种能够改善特异性CTL应答[5]。CTNNA2属于癌睾抗原(cancer testis, CT)抗原,是与经典钙黏蛋白相关的细胞骨架组分连环蛋白家族的成员。其功能与细胞黏附有关,同时它与肿瘤的发生、发展、恶化程度相关[6]。CTNNA2在正常组织中仅仅表达于睾丸和脑组织,而在多发性骨髓瘤细胞、黑色素瘤细胞和卵巢癌细胞中都有显著的表达[7]。本研究选择CTNNA2进行预测并设计长肽进行免疫学活性实验,旨在为肿瘤多肽疫苗候选效果更好的长肽。
1 材料和方法
1.1 材料
MCF-7由实验室常规保存,采用37℃、体积分数5% CO2饱和湿度培养条件下,用含体积分数10%胎牛血清的RPMI 1640培养基常规培养。T2A2细胞:转染HLA-A*0201分子的TAP缺陷T2细胞系,用含体积分数10%胎牛血清的IMDM培养基在37℃、体积分数5% CO2细胞培养箱中培养。外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)由HLA-A2+健康供者捐赠。HLA-A2+外周血健康供者来自寻找的健康供者。
1.2 设计长肽疫苗及HLA-A2限制性CTL表位肽的合成
首先对癌睾抗原CTNNA2进行HLA-A2限制性CTL表位肽的预测,使用生物信息学预测软件NetCTL 1.2 Server(http://www.cbs.dtu.dk/services/NetCTL/)[8]、SYFPEITHI(http://www.syfpeithi.de/bin/MHC Server.dll/Epitope Prediction.htm)[9]和BIMAS(http://www-bimas.cit.nih.gov/molbio/hla_bind/)[10]软件对CTNNA2氨基酸序列的预测打分,CTL表位限制性MHC类型HLA-A*02。预测抗原肽长度(nonamers 9aa)。目的抗原 CTNNA2 的氨基酸序列参照NCBI(NP_001269526.1)所提供的序列。根据集中的HLA-A2限制性CTL表位设计CTNNA2抗原来源的长肽,共获得3条长肽,分别为CTNNA2 P129-156、P778-800、P857-880。候选肽由上海生工生物工程有限公司合成,经反相高效液相色谱法分析纯化后,其纯度大于95%,经电喷雾质谱法鉴定相对分子质量符合理论值。
1.3 PBMCs分离
准备50 ml离心管,预先加肝素钠,预防血凝。抽取外周血20 ml或40 ml,加入等体积的PBS混匀;将淋巴细胞分离液4 ml 加入到15 ml 离心管中,缓慢注入PBS与血液的混合液8 ml;常规聚蔗糖-泛影葡胺分层液梯度离心,2 000 r/min离心20 min后,用弯管将上层血清抽掉,再轻轻抽取白膜层;按PBS:白膜层细胞>5∶1的比例,洗涤白膜层,2 000 r/min离心15 min,收集白膜层细胞;用含10%胎牛血清的IMDM培养基重悬,计数。
1.4 树突状细胞的体外诱导
按上述方法分离得到PBMCs,10%胎牛血清IMDM培养基重悬,计数2×106/ml,每孔2 ml 分至6孔板中,37℃、5% CO2培养箱中培养6 h;将未黏附的细胞洗脱,抽取液体及未贴壁的细胞,1 000 r/min离心10 min,收集细胞,在6孔板里加入温热的IMDM培养基2 ml,加入IMDM培养基2 ml,并补加粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)(100 ng/ml)、白细胞介素4(IL-4)(50 ng/ml);于37℃、5% CO2培养箱中继续培养;2 d半量换液1次,并补加GM-CSF(100 ng/ml)、IL-4(50 ng/ml);培养至第5天加入脂多糖(LPS)(100 ng/ml),诱导树突状细胞(DC)成熟;48 h后收集细胞[11]。
1.5 DC荷肽实验
收集成熟的DC,无血清IMDM培养基充分洗涤,重悬计数1×106/ml;加入长肽20 μg/mL,培养4h;收集细胞,用无血清IMDM培养基洗涤1次;重悬计数,加入50~100 μg的丝裂霉素C,加入20 μg/ml的长肽,培养1 h;10%已灭活的胎牛血清的IMDM培养基重悬,计数2×105/ml;取PBMCs,重悬计数2×106/ml,荷肽的DC作为刺激细胞,两者各取0.5 ml加入24孔板;隔日添加rIL-2(50 U/ml),每3 d半量换液,并补加rIL-2;1周后收集细胞,以10∶1的比例与新鲜制备的荷肽DC共培养,进行第2轮刺激;第3次刺激后的第3天收集细胞,用于后续活性实验[12]。
1.6 IFN-γ分泌水平的检测
取出酶联免疫斑点实验(enzyme-linked immunospot assay,ELISPOT,购自达科为生物技术有限公司)板条,加200 μl无血清的IMDM培养基进行封闭,静置10 min;将前期诱导的CTL作为效应细胞,调整细胞浓度为2×106/ml,每孔加50 μl,荷肽的DC作为刺激细胞,补加40 μl的无血清IMDM培养基,设立对照孔和实验孔;37℃、5% CO2孵育18 h;倾尽孔中培养基,每孔加入200 μl无菌的去离子水,4℃裂解细胞10 min;倾尽孔内液体,加入200 μl 1×washing buffer 洗涤6次,每次停留60 s;加入 100 μl生物素标记的抗体,37℃孵育1 h;倾尽孔内液体,加入200 μl 1×washing buffer进行洗涤,方法同上,在吸水纸上拍干;加入100 μl酶联亲和素,37℃孵育1 h;每孔加入200 μl 1×washing buffer进行洗涤,方法同上;加入100 μl现配的AEC显色液,25℃避光静置30 min;结束后置于通风处,室温静置干燥;结果用 ELISPOT 图像分析仪计数 96 孔板中每孔的斑点数。
1.7 CFSE荧光染色检测细胞毒性实验
通过离心收集靶细胞,并将细胞重悬于含有1% FCS的PBS中,并将细胞浓度调节至1×106/ml。致敏靶细胞:每1 ml细胞悬浮液加入0.5 μl 15 mmol/L羧基荧光素琥珀酰亚胺酯(carboxy fluorescein succinimidyl ester, CFSE)购自美国Sigma公司),室温,光照孵育4 min。对照靶细胞:每1 ml细胞悬液中加入0.5 μl 100 μmol/L CFSE,室温,光照孵育4 min。将细胞用5% FCS-PBS洗涤1次,离心并除去上清液,将细胞重悬于无血清IMDM培养基中。将效应细胞(前期诱导的CTL作为效应细胞)在无血清IMDM培养基中洗涤1次,并以 1.25×106~5×106细胞/ml的浓度重悬于无血清IMDM培养基中。将效应细胞(分别为12.5∶1、25∶1、50∶1)与致敏的靶细胞在离心管中混合,靶细胞数为 2×104,最终体积并在37℃温育4 h孵育后,用含有1% FCS及0.1%叠氮化钠的PBS(FACS)处理相同的E:T致敏的靶细胞组和对照靶细胞组,并用FACS洗涤。离心,重悬在4%多聚甲醛的PBS溶液中,流式细胞仪在机器检测。杀伤率=(对照样品中致敏靶细胞的数量-测试样品中致敏靶细胞的数量)/对照样品中致敏靶细胞的数量×100%。
1.8 LDH实验检测细胞毒性实验
调整效应细胞浓度 2×106/ml;调整靶细胞MCF-7细胞浓度为1×105/ml,每孔加50 μl,即为5 000个/孔;按设置的效靶比加入效应细胞及各种对照组,每孔终体积为100 μl;37℃、CO2孵育箱中孵育4 h,孵育结束前45 min,在靶细胞最大释放组和体积校正组中各加入10 μl裂解液;离心孔板,1 000 r/min离心10 min,转移上清50 μl至96孔板中;每孔加入50 μl乳酸脱氢酶底物混合液,室温避光孵育30 min;每孔加入50 μl终止液;在酶标仪上设置490 nm波长测定吸收值。杀伤率计算:靶细胞杀伤率(%)=[(实验组吸光值-效应细胞自发释放组吸光值-靶细胞自发释放组吸光值)/(靶细胞最大释放组吸光值-靶细胞自发释放组吸光值)]×100%[13]。
1.9 细胞因子染色法检测T细胞释放IFN-γ水平
诱导的CTL作为效应细胞,荷肽的DC作为刺激细胞;阴性对照孔每孔加入1×106/ml的效应细胞,终体积为1 ml;阳性对照孔每孔加入1×106/ml的效应细胞和100 μl PHA再补加900 μl无血清的IMDM培养基培养。加入阻断剂BFA 5 μg/ml到培养体系中,充分混匀。于培养箱中37℃、5% CO2孵育4 h;孵育结束后,1 500 r/min,离心5 min,收集细胞,用含2% FBS溶液的PBS将细胞重悬。避光加入细胞表面抗体,4℃避光孵育20 min,1 500 r/min,离心5 min。用细胞染色溶液洗涤2次,收集细胞,每孔加入100 μl破膜剂,4℃孵育20 min。收集细胞,加入抗IFN-γ抗体,4℃避光孵育30 min;每管加入500 μl细胞染色溶液,重悬,转移到Falcon圆底试管中上机检测。
1.10 统计学处理

2 结果
2.1 CTNNA2在肿瘤组织中的表达情况
使用The Human Protein Atlas数据库查询CTNNA2在肿瘤病人组织中的表达情况,从数据库中结果得知CTNNA2在肝癌、卵巢癌、结直肠癌中均有表达。如图1所示。

图1 肿瘤组织中CTNNA2的表达Fig 1 Expression of CTNNA2 in tumor tissue
2.2 CTNNA2 HLA-A2限制性CTL表位的预测以及长肽的设计
预测CTNNA2蛋白开放阅读框中潜在的HLA-A2超型限制性CTL表位,依据 NetCTL1.2、SYFPEITHI和BIMAS软件的结果,选取在各个预测软件中分值排名靠前的表位肽。设计长肽的长度尽量选择包含已经预测的较好的9个氨基酸的肽段。所设计的长肽长度大概25个氨基酸左右。具体打分情况以及设计长肽结果见表1。
2.3 ELISPOT实验检测IFN-γ分泌水平
志愿者的PBMCs经过GM-CSF和IL-4的诱导及LPS的刺激,成为成熟的DC。DC荷载长肽刺激PBMCs 3轮后,ELISPOT实验检测诱导能分泌IFN-γ的T细胞数量。与PBS组相比,P129-156、P778-800、P857-880这3条长肽在志愿者中均诱导出了可以分泌IFN-γ的T淋巴细胞(图2)。
2.4 LDH实验检测细胞毒性实验
体外ELISPOT实验显示,3条长肽在志愿者中均能诱导分泌IFN-γ的T淋巴细胞,为了进一步验证这3条长肽特异性的CTL对靶细胞是否有杀伤,选择MCF-7作为靶细胞(CTNNA2+,HLA-0201+)进行LDH实验。结果显示(图3),当效靶比是50∶1时,P778-800、P857-880在志愿者中所诱导的CTL对靶细胞MCF-7的杀伤率分别为28.5%、35.2%。P129-156在志愿者中所诱导的CTL对靶细胞MCF-7的杀伤率较低,数据中并没有显示,图3中只显示了效果较好的2条长肽P778-800、P857-880。
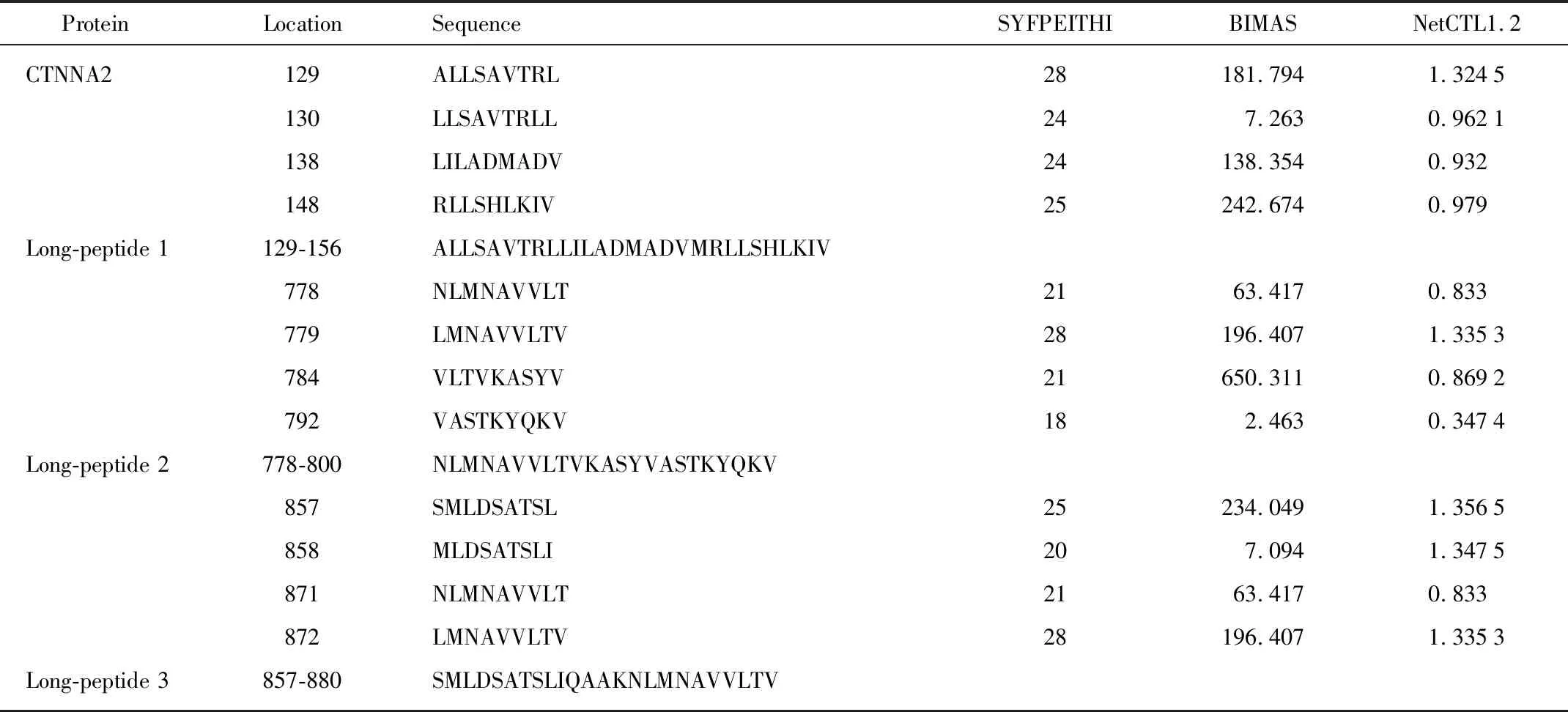
表1 CTNNA2抗原HLA-A2限制性CTL表位预测结果Tab 1 Prediction scores of the peptide derived from CTNNA2

图2 ELISPOT 检测长肽在HLA-A2健康志愿者中诱导的CTLs的IFN-γFig 2 In long peptide-pulsed DC assay, IFN-γ release assayed by ELISPOT using long peptide-pulsed DC to induce CTLs from HLA-A2 healthy donor

图3 长肽诱导的CTL在不同效靶比时对靶细胞的杀伤情况Fig 3 Specific lysis of MCF-7 by the CTLs induced by synthetic long peptide
2.5 CFSE荧光染色检测细胞毒性实验
候选肽所诱导产生的CTL随着效靶比的提高杀伤效果相应提到。根据LDH实验检测细胞毒性实验结果,将效果较好的P778-800、P857-880进一步的使用CFSE荧光染色检测细胞毒性实验;P778-800、P857-880 2条候选肽诱导得到的CTL在不同效靶比(12.5∶1、25∶1、50∶1)时对靶细胞的杀伤情况见图4。P778-800、P857-880 2条候选肽诱导得到的CTL在效靶比为50∶1时对靶细胞的杀伤率分别是26.5%±1.86%和33.6%±1.26%,而阴性对照组PBS和无关肽组HBC在效靶比为50∶1时对靶细胞的杀伤率分别为 2.62%±1.58%、2.24%±2.02%。

图4 CFSE法特异性CTL的体外细胞毒实验结果Fig 4 Specific lysis of target cells by the CTLs generated from the PBMCs of healthy donor
2.6 细胞因子染色法检测长肽体外免疫刺激后IFN-γ分泌水平
从HLA-A2+健康供者得到的PBMCs,DC荷载长肽刺激PBMCs 3轮后,且体外培养18 d后,获得特异性的CTL,细胞因子染色法检测长肽体外免疫刺激后IFN-γ分泌水平。结果显示(图5),P778-800、P857-880长肽疫苗能分泌较多的IFN-γ。
3 讨论
恶性肿瘤发病率呈现逐年增高的趋势。在现代城市中,恶性肿瘤死亡率和发病率已超过心脑血管疾病高居首位[14]。随着发展的生物分子机制方面的深入探索,生物治疗已然成为治疗恶性肿瘤的发展模式,肿瘤疫苗作为肿瘤生物治疗的重要组成部分,为肿瘤的治疗和预防开辟了新途径。近年来肿瘤疫苗逐渐成为国内外研究的热点领域之一,并且得到了十分迅速的发展[15]。肿瘤多肽疫苗可以很好的被树突状细胞处理并提呈给T淋巴细胞,从而引发肽特异性的CTL反应[16]。在蛋白疫苗的基础上,通过对肿瘤抗原编码基因的序列分析,分析其被CD8+T淋巴细胞识别的抗原表位,构建多肽疫苗,能够加强人类淋巴细胞抗原和T细胞受体(T cell receptor, TCR)的结合,而且还可以通过氨基酸替换、改变肽的构象以及修饰氨基酸残基等方法提高肽的免疫原性[17]。

图5 细胞因子染色法检测长肽特异性CTL分泌IFN-γ的能力Fig 5 IFN-γ release ability assayed by intracellular cytokine staining assay >*P<0.05 vs PBS group
很多方法用于设计多表位长肽。经典的方法将最小表位连接在一起,在表位间使用间隔区或连接子才能达到最佳处理效果,而其他研究则没有[18]。用于多表位长肽设计的另一种方法包括应用超过17个氨基酸的“天然”肽,长肽需要蛋白酶体加工并将表位呈递给CTL。长肽不仅包含CD4+和Th细胞表位而且包含CTL表位,它们不直接与非APC上表达的 HLA-Ⅰ类分子结合,且氨基酸序列较长,需要专业APCs如树突状细胞吞噬和处理长肽,然后分别在 HLA-Ⅰ类和Ⅱ类分子的背景下呈递CTL和Th细胞表位[19]。与短肽相比,长肽更能克服免疫耐受的问题。
本研究结果显示P778-800、P857-880有很好的分泌IFN-γ的能力及杀伤靶细胞的能力,表明 HLA-Ⅰ分子不仅限于短肽(8~10个残基),而且部分长肽可能具有更高的免疫原性[20],因此需要进一步研究了解它们在免疫应答中的作用程度。长肽的结构特征揭示了 HLA-Ⅰ裂隙的闭合构象不是长表位结合的障碍,可能通过形成二级结构(例如β-发夹或α-螺旋)来稳定凸起的表位;尽管即使没有稳定的二级结构,凸起的表位也不一定是灵活的[21]。因此,与传统 pMHC-Ⅰ表面相比,长肽有戏剧性的表现,人们之前可能认为这会导致TCR识别下降。相反,这些凸起的表位仍然具有免疫原性,尽管这些表位通常选择限制性TCR库,但具有长肽的 TCR-pMHC-Ⅰ复合物已经揭示出可能具有不同的TCR对接模式。进一步的研究将有必要确定一个短肽TCR对接策略是否优于其他长肽的TCR对接策略。