罗格列酮对重症急性胰腺炎大鼠肾组织中一氧化氮及NF-κB/p65表达的影响
2018-04-08胡雨云杨成彬杜鹏辉
胡雨云 杨成彬 杜鹏辉
(厦门大学附属第一医院急诊部,福建 厦门 361003)
重症急性胰腺炎发生后能够导致肾组织损伤,机体中过量的一氧化氮(NO)对肾组织造成毒性,导致血管对缩血管相关物质敏感性降低,引起肾组织缺氧,产生大量的炎症因子,加重肾组织损伤〔1〕。罗格列酮是一种过氧化物酶体增殖物活化受体激活剂,而过氧化物酶体增殖物活化受体在创口愈合、细胞生长及炎症反应中均发挥重要作用〔2〕。罗格列酮在肠炎、感染性休克、缺血损伤等疾病发生过程中发挥抗感染作用,能够通过作用于核因子(NF)-κB/p65影响炎症因子的释放〔3〕。研究表明,罗格列酮能够减轻急性胰腺炎大鼠肝损伤及胰腺损伤〔4〕。本研究通过构建重症急性胰腺炎大鼠模型,探讨罗格列酮对重症急性胰腺炎大鼠肾组织的作用。
1 材料与方法
1.1材料SPF雄性Wistar大鼠33只,体重180~220 g,购自厦门大学动物中心。NO含量检测试剂盒购自碧云天生物技术研究所;诱导型一氧化氮合酶(iNOS)酶联免疫吸附(ELISA)法检测试剂盒购自北京绿源博德生物科技有限公司;二喹啉甲酸(BCA)蛋白浓度检测试剂盒购自北京索莱宝生物科技有限公司;罗格列酮购自美国Sigma;肿瘤坏死因子(TNF)-α多克隆抗体、细胞间黏附分子(ICAM)-1多克隆抗体、NF-κB/p65多克隆抗体均购自德国GeneTex公司。
1.2重症急性胰腺炎大鼠模型构建模型构建参照参考文献〔5〕,所有实验动物在建模前1 d均禁食过夜,不限制饮水。所有实验动物按照10 ml/kg进行腹腔注射麻醉(4%水合氯醛)。将实验动物固定至手术台上,消毒后在上腹正中切开长2 cm的切口。将十二指肠提取后,找到胰胆管。将肝总管夹闭后,用头皮针从十二指肠逆行进入肠腔,随后进入胰管的0.8 cm处,在头皮针的另外一端用注射器将5%的牛磺胆酸钠注入,剂量1 ml/kg,速率0.1 ml/min,退针后,保持动脉夹夹闭状态。观察胰腺有水肿、充血后,将动脉夹松开,将十二指肠放入腹腔内后缝合。手术结束后,按照2 ml/100 g大鼠体重注射生理盐水。大鼠苏醒后,继续禁食,不限制饮水。
1.3分组实验分为对照组、模型组和罗格列酮组各11只,对照组只翻动十二指肠,罗格列酮组和模型组按照1.2中进行造模。罗格列酮组在造模前0.5 h腹腔注射1%罗格列酮,剂量1 ml/kg。对照组、模型组用等量10%的二甲基亚砜溶液代替。模型组死亡1只,对照组和罗格列酮组随机淘汰1只,每组剩余10只。各组大鼠在造模后12 h经4%水合氯醛麻醉后,取肾组织,用于检测NO含量、iNOS活性、NF-κB/p65表达水平及TNF-α和ICAM-1表达。
1.4NO含量和iNOS活性检测取大鼠肾组织100 mg,加入冰预冷的磷酸盐缓冲液(PBS)后,组织匀浆,配制成25%的组织匀浆液,4 000 r/min,4℃离心20 min后,吸取上清液,分为两部分,一部分根据(硝酸还原酶法)NO含量检测试剂盒检测NO含量,另外一部分用ELISA iNOS活性检测试剂盒检测iNOS活性。
1.5NF-κB/p65表达检测各组大鼠麻醉后,处死大鼠,取大鼠肾组织,制作石蜡切片,用浓度梯度酒精脱水后,经柠檬酸抗原修复(切片在pH=6.0的柠檬酸缓冲液中煮沸2 min),用0.3%过氧化氢溶液特异性地阻断内源性过氧化氢酶的活性,室温下孵育10 min。与100倍稀释的NF-κB/p65抗体在4℃孵育过夜后,与1 000倍稀释的二抗在37℃孵育反应1 h。显色后,苏木素染色2 min。被染成黄色的判定为阳性。随机选取5个视野,计算阳性细胞数目所占比例。
1.6Western印迹检测TNF-α和ICAM-1的表达水平取大鼠肾组织,剪碎后,加入裂解液,在冰上裂解后,4℃,12 000 r/min离心10 min,取蛋白上清液,按照BCA蛋白浓度检测试剂盒检测蛋白浓度。将蛋白样品与2倍上样缓冲液按照1∶1的比例混合,100℃煮沸5 min使蛋白变性。蛋白电泳:每孔加入50 μl样品,80 V电泳30 min后,调整电压为120 V至电泳结束。转膜:4℃转膜1.5 h,转膜电压为90 V。5%牛血清白蛋白封闭后,分别与一抗(500倍稀释,4℃过夜)、二抗(1 000倍稀释,室温反应60 min)反应后,滴加显色液,以GAPDH为内参,分析蛋白表达情况。
1.7统计学处理采用SPSS22.0软件进行t检验。
2 结 果
2.13组肾组织中NO、iNOS水平比较模型组肾组织中NO含量及iNOS活性升高,而罗格列酮作用后能够部分降低NO含量及iNOS活性(均P<0.05)。见表1。
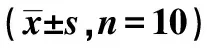
表1 3组NO含量及iNOS活性比较
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05,下表同
2.23组肾组织中NF-κB/p65水平比较对照组、模型组和罗格列酮组NF-κB/p65阳性细胞率依次为(0.86±0.06)%、(3.75±0.11)%、(3.13±0.25)%。模型组肾组织中NF-κB/p65水平升高,罗格列酮作用后能够部分降低NF-κB/p65水平(均P<0.05)。
2.33组TNF-α和ICAM-1水平比较模型组肾组织中 TNF-α和ICAM-1水平升高,而罗格列酮作用后能够部分降低TNF-α和ICAM-1水平差异均有统计学意义(均P<0.05)。见图1,表2。
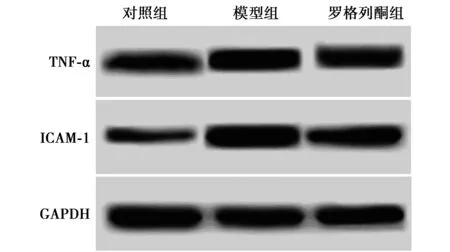
图1 Western印迹检测TNF-α和ICAM-1表达水平
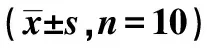
表2 TNF-α和ICAM-1表达水平
3 讨 论
过氧化物酶体增殖物活化受体γ是一种核转录因子,在生命机体的脂肪组织、肝脏、结肠、脾脏、平滑肌细胞、淋巴细胞等组织和细胞中均广泛表达,能够调控脂质和糖代谢过程,并且对细胞的生长、凋亡和分化具有调控作用,在炎症反应等过程中也发挥重要作用〔6〕。罗格列酮能够特异性激活过氧化物酶体增殖物活化受体γ,促使其与靶基因结合〔7〕。顾澄宇等〔8〕研究表明,重症急性胰腺炎大鼠模型经腹腔注射罗格列酮后,RT-PCR检测发现,过氧化物酶体增殖物活化受体γ的mRNA水平在3~12 h内呈现高表达,并且能够降低胰腺组织中NO水平,减轻胰腺组织的病理损伤。
NO是由iNOS催化合成的能够调节血小板凝集、细胞内信号转导及免疫反应的细胞因子,其中iNOS在炎症反应中作用最为广泛〔9〕。Li等〔10〕研究表明,重症急性胰腺炎大鼠模型胰腺组织中有大量的iNOS存在,而抑制iNOS后,大鼠重症急性胰腺炎减轻。Xiong等〔11〕检测重症急性胰腺炎大鼠模型肝脏和胰腺组织中NO水平发现,NO能够介导氧化损伤的发生。以上结果均表明,过量的NO能够加重胰腺炎损伤。本研究结果提示,罗格列酮能够降低NO水平减轻重症急性胰腺炎损伤。
NF-κB是一种蛋白质因子,能够调控细胞内多种基因的转录过程,能够与黏附因子、细胞因子等基因的启动子特异性结合而促进基因的表达〔12〕。有研究表明,NF-κB能够促进细胞内TNF-α、白细胞介素(IL)-8等多种炎症因子的表达,其激活后可以作为炎症反应过程中多种细胞因子的中心部分,NF-κB/p65是NF-κB激活后的主要存在方式〔13〕。Niyaz等〔14〕研究表明,重症急性胰腺炎大鼠的胰腺组织中NF-κB活化水平升高,而罗格列酮能够缓解炎症,降低胰腺、肝脏等的损伤,下调胰腺组织中ICAM-1的表达水平。da Silva Buss等〔15〕研究表明,罗格列酮能够降低急性胸膜炎大鼠模型的炎症反应,减少iNOS、ICAM-1的表达。本研究结果提示,罗格列酮能够通过降低NF-κB/p65水平,抑制TNF-α和ICAM-1表达而减轻重症急性胰腺炎肾组织损伤。这可能是罗格列酮减轻重症急性胰腺炎肾损伤的作用机制之一。
1Wang G,Wen J,Xu L,etal.Effect of enteral nutrition and ecoimmunonutrition on bacterial translocation and cytokine production in patients with severe acute pancreatitis〔J〕.J Surg Res,2013;183(2):592-7.
2Ballesteros I,Cuartero MI,Pradillo JM,etal.Rosiglitazone-induced CD36 up-regulation resolves inflammation by PPARγ and 5-LO-dependent pathways〔J〕.J Leuk Biol,2014;95(4):587-98.
3Chen W,Lin YJ,Zhou XY,etal.Rosiglitazone protects rat liver against acute liver injury associated with the NF-κB signaling pathway〔J〕.Canadian J Physiol Pharmacol,2015;94(1):28-34.
4Malecki EA,Castellanos KJ,Cabay RJ,etal.Therapeutic administration of orlistat,rosiglitazone or the chemokine receptor antagonist RS102895 fails to improve the severity of acute pancreatitis in obese mice〔J〕.Pancreas,2014;43(6):903.
5Tang Q,Su S,Fang M.Zinc supplement modulates oxidative stress and antioxidant values in rats with severe acute pancreatitis〔J〕.Biolog Trace Element Res,2014;159(1-3):320-4.
6Davies NA,Watkeys L,Butcher L,etal.The contributions of oxidative stress,oxidised lipoproteins and AMPK towards exercise-associated PPARγ signalling within human monocytic cells〔J〕.Free Rad Res,2015;49(1):45-56.
7Stechschulte LA,Ge C,Hinds TD,etal.Protein phosphatase PP5 controls bone mass and the negative effects of rosiglitazone on bone through reciprocal regulation of PPARγ and RUNX2〔J〕.J Biolog Chem,2016;291(47):24475-86.
8顾澄宇,蔡兵,吴鸣宇,等.罗格列酮对大鼠重症急性胰腺炎的干预作用〔J〕.世界华人消化杂志,2009;17(26):2667-72.
9Dervenis C.Assessments of severity and management of acute pancreatitis based on the Santorini Consensus Conference report〔J〕.J Pancreas,2016;1(4):178-82.
10Li ZL,Zhang D,Liu JW,etal.Effects of rhodiola on the expression of iNOS mRNA in severe acute pancreatitis associated Re-nal injury rats〔J〕.Chin J Int Traditi Western Med,2015;35(6):730-4.
11Xiong J,Wang K,Yuan C,etal.Luteolin protects mice from severe acute pancreatitis by exerting HO-1-mediated anti-inflammatory and antioxidant effects〔J〕.Intern J Mol Med,2017;39(1):113-25.
12Wang WY,Chen Y,Su X,etal.Resistin-like molecule-α causes lung injury in rats with acute pancreatitis by activating the PI-3K/Akt-NF-κB pathway and promoting inflammatory cytokine release〔J〕.Curr Mol Med,2016;16(7):677-87.
13Liu J,Wang Y,Ouyang X.Beyond toll-like receptors:porphyromonas gingivalis induces IL-6,IL-8,and VCAM-1 expression through NOD-mediated NF-κB and ERK signaling pathways in periodontal fibroblasts〔J〕.Inflammation,2014;37(2):522-33.
14Niyaz B,Zhao KL,Liu LM,etal.Rosiglitazone attenuates the severity of hyperlipidemic severe acute pancreatitis in rats〔J〕.Exper Therap Med,2013;6(4):989-94.
15da Silva Buss Z,Medeiros YS,Fröde TS.PPAR-gamma agonist rosiglitazone attenuates the inflammation caused by carrageenan in the mouse model of pleurisy〔J〕.Inflammation,2012;35(1):280-8.
