N-乙酰半胱氨酸对人脐静脉内皮细胞eNOS的保护作用
2018-04-08王凌霄王阿磊姜君财陆德琴
王凌霄 王阿磊 丁 菁 张 倩 黄 华 姜君财 陆德琴
(贵州医科大学病理生理学教研室,贵州 贵阳 550025)
内皮功能障碍(ED)是心血管疾病发生发展的共同始动因素,氧化应激损伤是导致ED的主要原因之一〔1〕。生理情况下血管内皮细胞分泌的一氧化氮(NO)在维持血管稳态中起着重要的作用,NO在一氧化氮合酶(NOS)的催化下产生,主要来源于内皮型NOS(eNOS)。ED的重要表现之一是eNOS/NO功能受损,其机制可能与eNOS活性下降及NO生物利用度降低有关。蛋白磷酸酶(PP)2A是目前已知还原型辅酶Ⅱ(NADPH)氧化酶(Nox)源性活性氧(ROS)的主要靶蛋白之一,也是使eNOS Ser1177/1179去磷酸化的主要磷酸酶〔2〕。研究发现N-乙酰半胱氨酸(NAC)作为一种ROS清除剂可以减轻氧化应激,对血管形态及功能起到保护作用〔3〕。血管紧张素(Ang)Ⅱ可通过多种途径产生大量的ROS,从而造成ED〔4〕。本研究对人脐静脉内皮细胞(HUVECs)给予AngⅡ刺激,同时使用NAC对HUVECs进行预处理,初步探讨NAC预处理对内皮细胞eNOS活性的保护作用及机制。
1 材料和方法
1.1实验试剂及仪器HUVECs由贵州医科大学曾柱教授惠赠;胎牛血清(FBS)、无酚红高糖DMEM培养基(Gibco);高糖DMEM培养基、青-链霉素、0.25%胰蛋白酶(HyClone);NAC、AngⅡ(Sigma);聚氟偏乙烯(PVDF)蛋白杂交膜(Millipore);电化学发光法(ECL)增强化学发光试剂盒(Bio-Rad);二喹啉甲酸(BCA)蛋白定量试剂盒(Thermo);鼠抗人eNOS抗体(BD);兔抗鼠eNOS Ser1177抗体(Millipore);兔抗鼠PP2A-c Y307抗体(Abcam);兔抗鼠PP2A-Cα抗体、羊抗兔I2PP2A抗体、兔抗鼠β-tubulin抗体、辣根过氧化酶标记的羊抗兔Ⅱ抗、羊抗鼠Ⅱ抗、兔抗羊Ⅱ抗(Santa Cruz);兔抗人Ⅷ因子相关抗原抗体、兔抗人CD34抗体(北京博奥森生物公司);链霉亲合素-生物素复合物(SABC)法检测试剂盒(北京中杉金桥公司);BX41显微镜、倒置荧光显微镜(OLYMPUS);ROS检测试剂盒(碧云天);NOS分型测定及NO测定试剂盒(南京建成生物工程研究所)。
1.2HUVECs细胞培养HUVECs接种于无菌25 cm2培养瓶中,于37℃、5 %CO2的培养箱中用含10% FBS高糖DMEM培养基培养,每48 h更换一次培养液,当细胞生长达到80%左右时,用0.25%胰蛋白酶消化细胞,进行传代。实验取4~10代的细胞。
1.3细胞鉴定细胞爬片后,于六孔板中培养。待密度至50%左右时,用无FBS培养基静止12 h,磷酸盐缓冲液(PBS)洗涤3次后,采用4%多聚甲醛固定,用兔抗人Ⅷ因子相关抗原抗体和兔抗人CD34抗体作为Ⅰ抗,1∶100稀释后,SABC法进行免疫细胞化学染色。PBS培养作为阴性对照。镜下胞质内出现棕黄色颗粒者为阳性细胞。200倍显微镜下随机取5个视野计数阳性细胞,阳性细胞率(%)=阳性细胞数/细胞总数×100%。
1.4分组
1.4.1单纯AngⅡ处理实验HUVECs随机分为正常对照组和AngⅡ组(AngⅡ浓度分别为1×10-9、1×10-8、1×10-7、1×10-6、1×10-5mol/L,处理12 h)。通过Western印迹检测eNOS Ser1177磷酸化水平,AngⅡ最终使用浓度取1×10-7mol/L和1×10-6mol/L,处理时间12 h进行实验。
1.4.2NAC预处理实验根据参考文献〔5〕,采用终浓度为1×10-3mol/L的NAC预处理1 h,随机分为正常对照组、AngⅡ(1×10-7mol/L和1×10-6mol/L,处理12 h)组、单纯NAC组、NAC(预处理)+AngⅡ(1×10-7mol/L、1×10-6mol/L)组。
1.5细胞内ROS的测定于六孔板中培养HUVECs,随机分为正常对照组和AngⅡ组,作用12 h后去除细胞培养液,加入1.5 ml终浓度为10 μmol/L的荧光探针二氯荧光磺双乙酸盐(DCFH-DA,使用无FBS培养基稀释),于37℃、5%CO2的培养箱内孵育20 min,用无FBS培养基洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。使用488 nm激发波长、525 nm发射波长于倒置荧光显微镜观察荧光并拍照,采用Image J软件分析DCF的荧光强度。
1.6Western印迹检测蛋白水平分别收集各组细胞,加入蛋白裂解液,冰上刮取细胞后裂解30 min,4℃、12 000 r/min离心取上清,BCA法测定蛋白浓度,其余蛋白变性后十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,上样,转膜,5%脱脂牛奶常温封闭1 h,Tris盐酸缓冲液(TBST)洗膜后孵育Ⅰ抗4℃过夜。次日TBST洗膜后,加入Ⅱ抗,常温孵育1 h,TBST洗膜,ECL显影曝光。用Bio-Rad凝胶成像系统软件分析蛋白条带相对积分吸光度值。
1.7化学比色法检测HUVECs中细胞组成型一氧化氮合酶(cNOS)活性细胞处理完毕后使用0.25%胰蛋白酶消化,采用含10% FBS的高糖DMEM培养基终止消化,重悬,1 000 r/min离心5 min,得细胞沉淀。加入适量PBS洗涤细胞,1 000 r/min离心6 min,弃上清,重复洗涤2次。在细胞沉淀中加入300 μl的PBS,混匀,超声粉碎细胞,取上清进行蛋白浓度测定和cNOS检测。所有检测均复6孔。
1.8化学比色法检测HUVECs培养基中NO含量细胞处理完毕后分别对应收集各组培养基,按试剂盒说明书添加试剂一和二,混匀后于酶标仪550 nm波长处测各组A值。所有检测均复6孔。
1.9统计学方法应用SPSS17.0软件,计量资料样本均数比较前先进行方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA),多组间两两比较采用SNK-q法。
2 结 果
2.1细胞鉴定结果免疫组织化学染色结果显示,在培养的HUVECs中,Ⅷ因子相关抗原和CD34表达阳性,阴性对照组未见胞质黄染,计算阳性细胞率为100%。见图1。
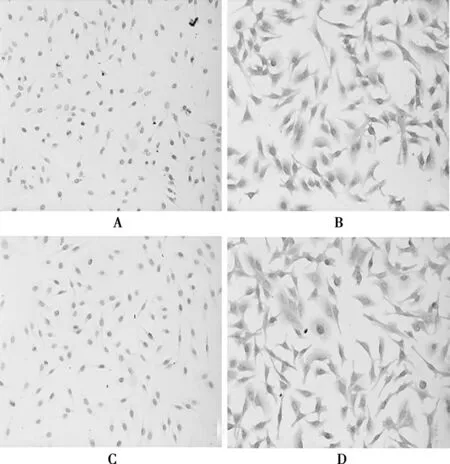
A:Ⅷ因子相关抗原阴性对照;B:HUVECs中Ⅷ因子相关抗原阳性表达;C:CD34阴性对照;D:HUVECs中CD34阳性表达图1 Ⅷ因子相关抗原和CD34在HUVECs中的表达(SABC,×200)
2.2AngⅡ刺激HUVECs后下调eNOS Ser1177磷酸化水平各剂量AngⅡ刺激HUVECs 12 h后,与正常对照组比较及各组间eNOS蛋白表达比较差异均无统计学意义(P>0.05),各剂量AngⅡ组eNOS Ser1177磷酸化水平均明显低于正常对照组(P<0.05),AngⅡ各组间eNOS Ser1177磷酸化水平差异无统计学意义(P>0.05)。见图2。
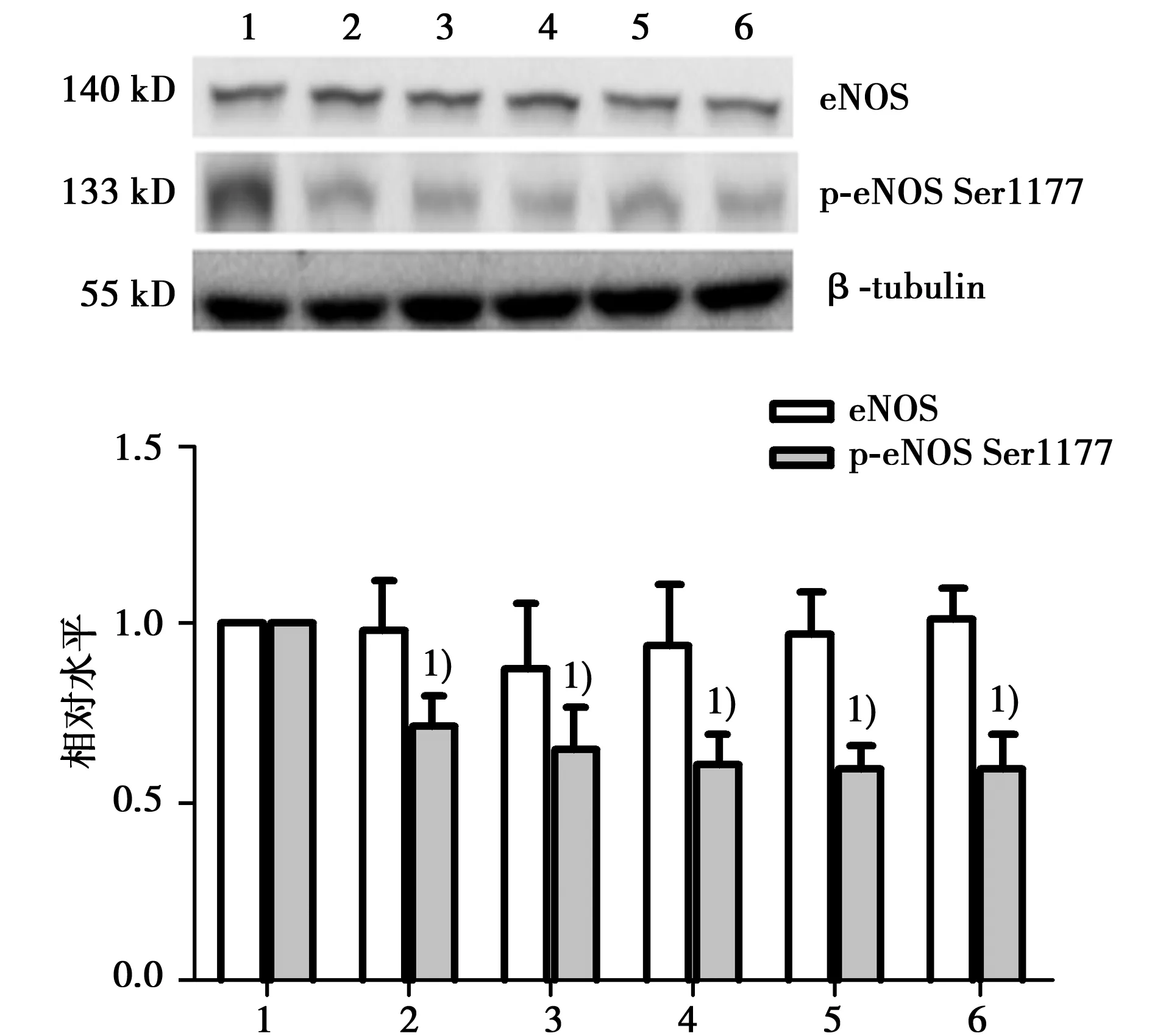
1:正常对照组;2:AngⅡ10-9mol/L组;3:AngⅡ10-8mol/L组;4:AngⅡ10-7mol/L组;5:AngⅡ10-6mol/L组;6:AngⅡ10-5mol/L组;与正常对照组相比:1)P<0.05图2 AngⅡ刺激HUVECs 12 h后各组eNOS蛋白表达及eNOS Ser1177磷酸化水平的变化
2.3AngⅡ刺激HUVECs后增加ROS的产生AngⅡ(1×10-7mol/L、1×10-6mol/L)刺激HUVECs 12 h后,DCF荧光强度与正常对照组比较明显增加(P<0.05)。见图3。
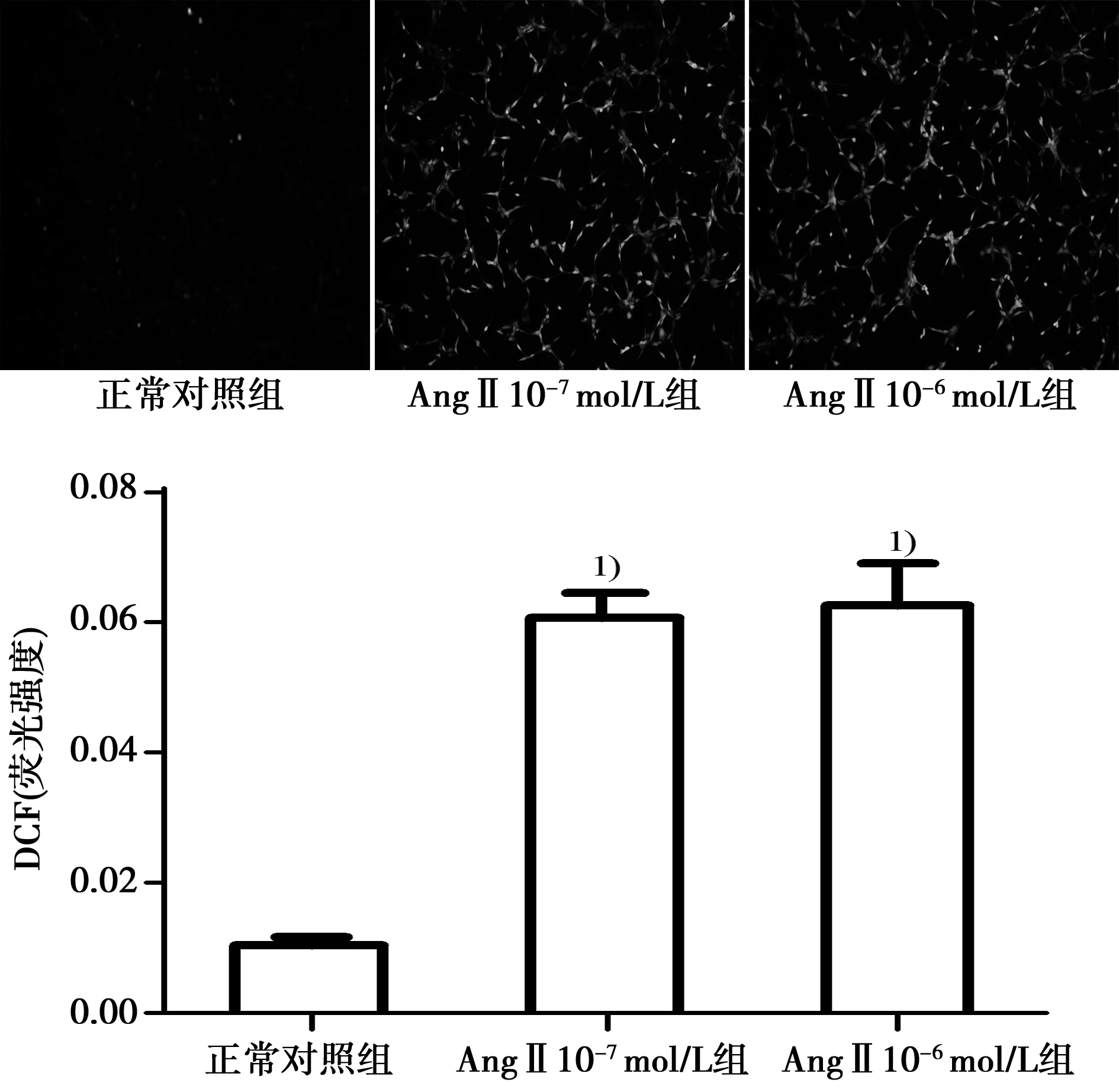
与正常对照组比较:1)P<0.05图3 AngⅡ刺激HUVECs 12 h后细胞中DCF的荧光强度(×200)
2.4NAC预处理增加eNOS Ser1177磷酸化水平各组间eNOS蛋白表达比较差异无统计学意义(P>0.05),AngⅡ10-7mol/L组、AngⅡ10-6mol/L组与正常对照组比较eNOS Ser1177磷酸化水平明显降低(P<0.05);与同浓度AngⅡ组比较,NAC预处理后eNOS蛋白表达差异仍无统计学意义(P>0.05),eNOS Ser1177磷酸化水平明显增加(P<0.05)。AngⅡ各浓度组间、NAC预处理+AngⅡ各浓度组间比较,上述指标变化差异均无统计学意义(P>0.05)。见图4。
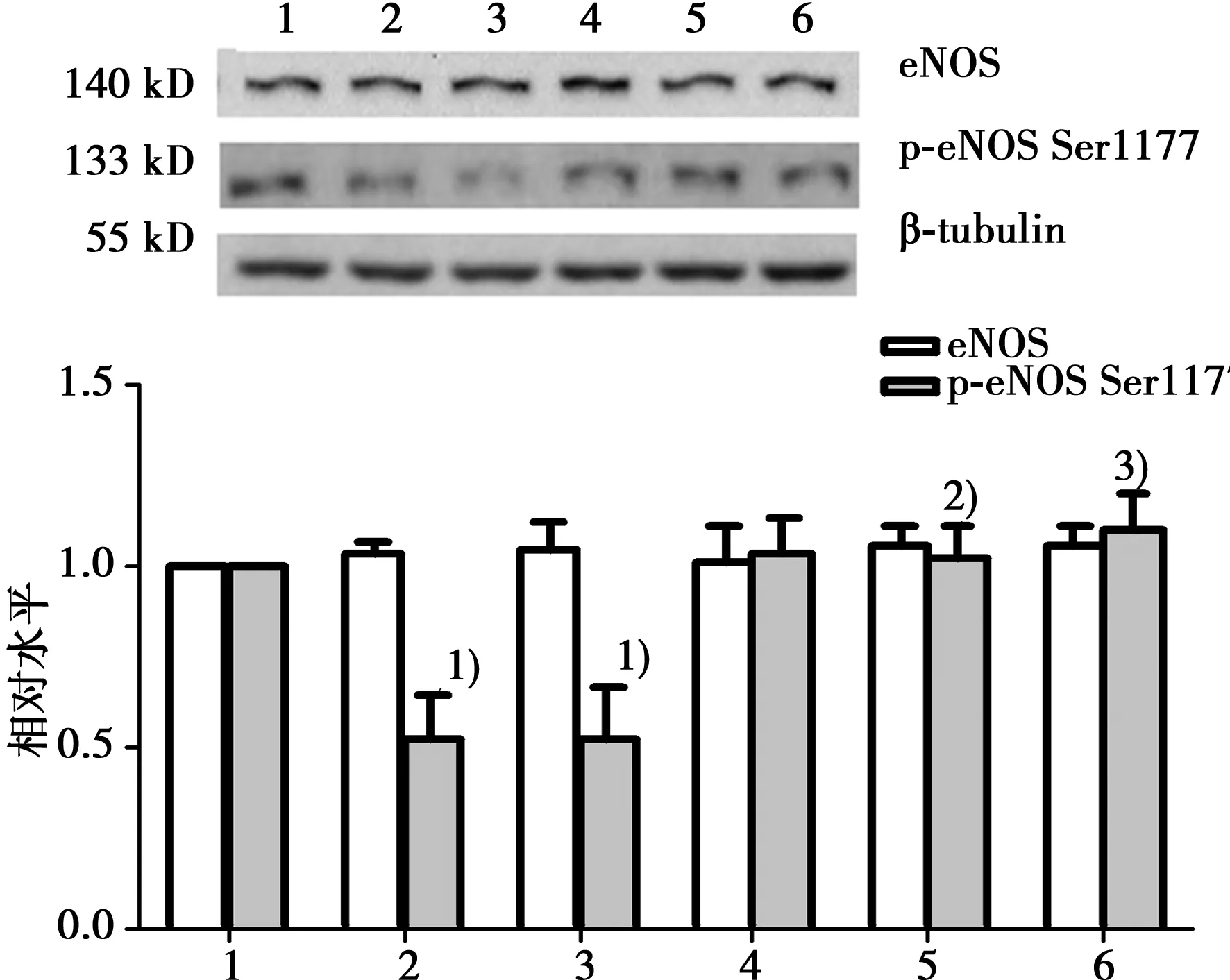
1:正常对照组;2:AngⅡ10-7mol/L组;3:AngⅡ10-6mol/L组;4:NAC组;5:NAC+AngⅡ10-7mol/L组;6:NAC+AngⅡ10-6mol/L;与正常对照组比较,1)P<0.05;与AngⅡ10-7mol/L组组比较,2)P<0.05;与AngⅡ10-6mol/L组比较,3)P<0.05;下图、下表同图4 NAC预处理对AngⅡ刺激HUVECs后各组eNOS蛋白表达及eNOS Ser1177磷酸化水平的影响
2.5NAC预处理增加PP2A-c Y307磷酸化水平和I2PP2A蛋白表达水平AngⅡ刺激后PP2A-Cα蛋白表达差异无统计学意义(P>0.05),PP2A-c Y307磷酸化水平、I2PP2A蛋白表达水平明显降低(P<0.05);与同浓度AngⅡ组比较,NAC预处理后PP2A-Cα蛋白表达差异仍无统计学意义(P>0.05),PP2A-c Y307磷酸化水平、I2PP2A蛋白表达水平明显增加(P<0.05)。各浓度AngⅡ组间、NAC+AngⅡ各浓度组间比较上述指标变化均无统计学意义(P>0.05)。见图5。
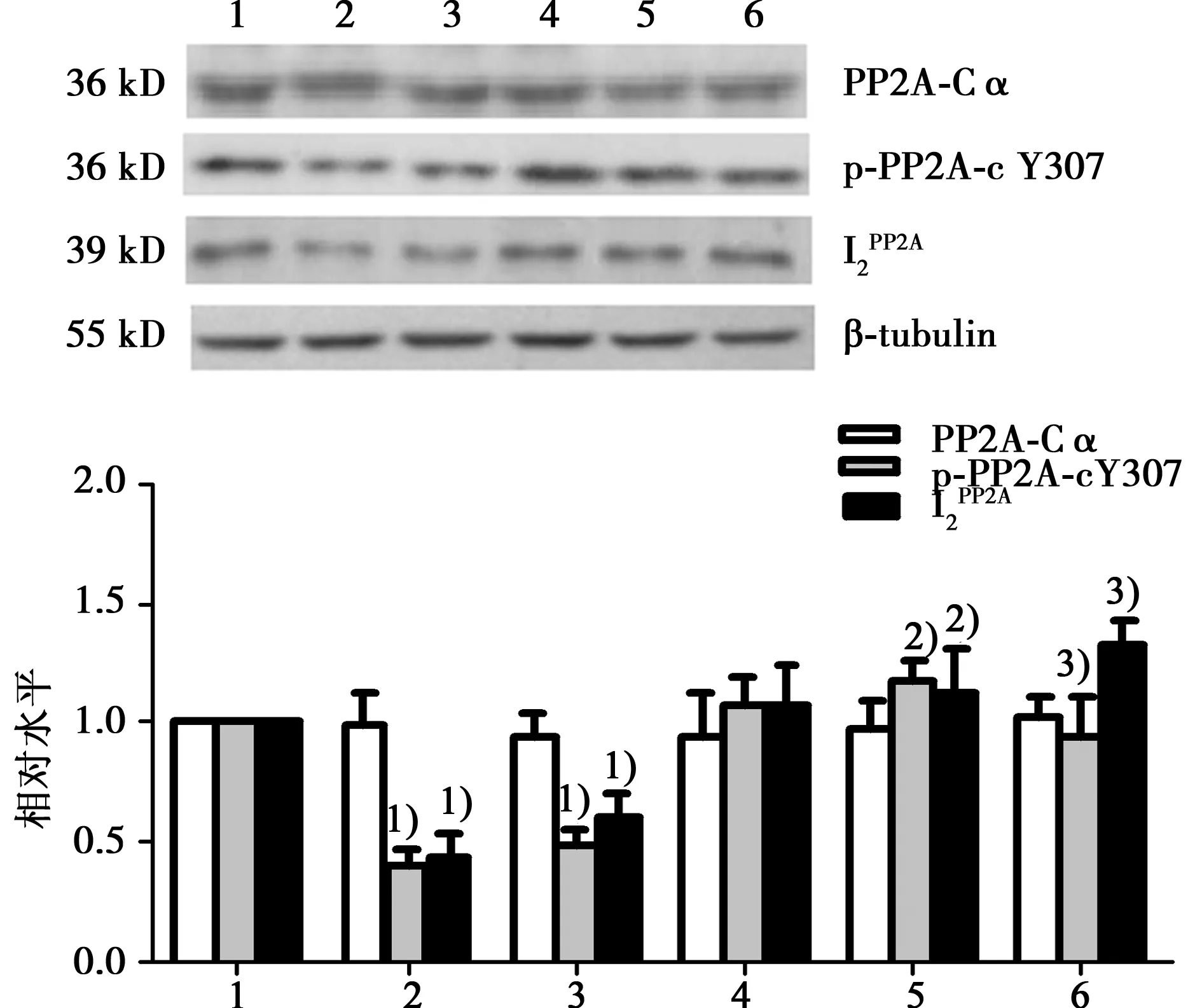
图5 NAC预处理对AngⅡ刺激HUVECs后各组PP2A-Cα、I2PP2A蛋白表达和PP2A-c Y307磷酸化水平的影响
2.6NAC预处理增加细胞cNOS活性及培养基中NO的含量AngⅡ刺激后,cNOS活性、培养基中NO含量均明显降低(P<0.05);与同浓度AngⅡ组比较,NAC预处理后cNOS活性、培养基中NO含量均明显增加(P<0.05)。AngⅡ各浓度组间、NAC+AngⅡ各浓度组间比较,cNOS活性、NO含量差异均无统计学意义(P>0.05)。见表1。
表1 各组cNOS活性和培养基中NO含量的变化
3 讨 论
氧化应激发生时,ROS产生增多,可导致内皮细胞损伤。因此,减少氧化应激,改善内皮细胞功能,已经成为防治心血管疾病的研究热点。
eNOS活性调控的机制之一是其多个丝/苏氨酸位点的磷酸化,其中eNOS Ser1177/1179磷酸化上调可使eNOS活性增强,NO产生增多〔6〕。cNOS包括神经元型NOS(nNOS)和eNOS,因此cNOS活性本应是两者活性之和。但研究发现,血管内皮细胞主要以eNOS表达为主〔7〕,且本课题组前期使用免疫组化的方法证实nNOS在血管内皮细胞中表达很低〔8〕,故本研究中测定的cNOS活性可以代表eNOS活性。
AngⅡ刺激后可产生大量ROS,通过抑制蛋白激酶B(Akt)/eNOS信号途径,从而下调eNOS 1177磷酸化水平,造成血管内皮功能障碍〔9〕。本研究结果提示AngⅡ刺激可产生大量的ROS,eNOS Ser1177磷酸化水平下调,从而发生内皮功能紊乱。研究表明Akt可以上调eNOS Ser1177/1179磷酸化水平〔10〕;且有报道PP2A是Nox源性ROS的靶蛋白之一,而PP2A可使Akt、eNOS Ser1177〔2〕发生去磷酸化。PP2A是一种丝/苏氨酸蛋白磷酸酶,可使蛋白质脱磷酸,在PI3K/Akt/eNOS信号通路中起负性调控作用〔11〕。PP2Ac高度保守C端尾巴可发生翻译后磷酸化和甲基化修饰,磷酸化可发生在Tyr307上,抑制PP2A酶活性〔12〕。PP2A包括I1PP2A和I2PP2A两种胞内具有特异性、非竞争性和热稳定性的抑制蛋白〔13〕。Li等〔14〕从牛肾抽提物中纯化出I2PP2A蛋白,能显著抑制PP2A的活性。因此本研究主要检测PP2A-c Y307磷酸化水平和I2PP2A蛋白表达水平,作为对PP2A活性的判断。结果显示,AngⅡ刺激产生了大量的ROS,可能通过下调PP2A-c Y307和I2PP2A水平激活PP2A,PP2A可间接通过Akt去磷酸化或直接作用从而下调eNOS Ser1177磷酸化水平,降低eNOS活性及培养基中NO含量,最终导致内皮细胞功能受损。
NAC是含巯基的谷胱甘肽(GSH)的前体,作为一种ROS清除剂,具有清除氧自由基的作用,可以改善内皮细胞功能障碍。研究发现,在HUVECs中使用NAC可清除ROS,通过激活Akt/eNOS信号通路,从而上调eNOS 1177磷酸化水平〔15〕。本研究结果显示,NAC预处理可能通过清除ROS,激活Akt/eNOS信号通路,从而发挥保护eNOS活性的作用。有研究报道,在人类前列腺细胞株DU145中使用NAC清除ROS后,可抑制PP2A活性,进而激活PI3K/Akt信号通路〔16〕。在研究成纤维细胞自噬过程中,使用NAC清除ROS后可通过抑制半胱氨酸残基的亚磺酰化作用,从而降低PP2A活性,且此过程中检测到PP2A-c Y307磷酸化水平增加〔17〕。本研究结果显示,NAC预处理可能通过减少ROS生成,上调PP2A-c Y307和I2PP2A使PP2A活性降低,从而上调eNOS Ser1177磷酸化水平,增加eNOS活性,进而发挥保护内皮细胞的作用。
综上,AngⅡ可能通过降低PP2A-c Y307和I2PP2A使PP2A活性增加,最终导致eNOS活性降低;NAC预处理可通过增加PP2A-c Y307和I2PP2A,从而降低PP2A活性,发挥保护内皮细胞eNOS活性的作用。
1Hou X,Tong Q,Wang W,etal.Dihydromyricetin protects endothelial cells from hydrogen peroxide-induced oxidative stress damage by regulating mitochondrial pathways〔J〕.Life Sci,2015;130(1):38-46.
2Ladurner A,Schmitt CA,Schachner D,etal.Ascorbate stimulates endothelial nitric oxide synthase enzyme activity by rapid modulation of its phosphorylation status〔J〕.Free Radic Biol Med,2012;52(10):2082-90.
3黄德珍,曾玉兰.N-乙酰半胱氨酸对老年慢性阻塞性肺疾病患者免疫功能及细胞因子的影响〔J〕.实用医学杂志,2015;31(7):1186-8.
4Wei X,Zhu X,Hu N,etal.Baicalin attenuates angiotensin Ⅱ-induced endothelial dysfunction〔J〕.Biochem Biophys Res Commun,2015;465(1):101-7.
5Ran X,Zhao W,Li W,etal.Cryptotanshinone inhibits TNF-α-induced LOX-1 expression by suppressing reactive oxygen species (ROS) formation in endothelial cells〔J〕.Korean J Physiol,2016;20(4):347-55.
6Fleming I.Molecular mechanisms underlying the activation of eNOS〔J〕.Pflug Arch,2010;459(6):793-806.
7Alderton WK,Cooper CE,Knowles RG.Nitric oxide synthases:structure,function and inhibition〔J〕.Biochem J,2001;357(3):593-615.
8张倩,丁菁,杨飞,等.依普利酮对高盐诱导的高血压大鼠主动脉内皮型一氧化氮合酶表达及活性的影响〔J〕.中国病理生理杂志,2015;31(9):1606-10.
9Xiao X,Zhang C,Ma X,etal.Angiotensin-(1-7) counteracts angiotensin Ⅱ-induced dysfunction in cerebral endothelial cells via modulating Nox2/ROS and PI3K/NO pathways〔J〕.Exp Cell Res,2015;336(1):58-65.
10Abeyrathna P,Su Y.The critical role of Akt in cardiovascular function〔J〕.Vasc Pharmacol,2015;74(1):38-48.
11Bharath LP,Ruan T,Li Y,etal.Ceramide-initiated protein phosphatase 2A activation contributes to arterial dysfunction in vivo〔J〕.Diabetes,2015;64(11):3914-26.
12Longin S,Zwaenepoel K,Louis J V,etal.Selection of protein phosphatase 2A regulatory subunits is mediated by the C terminus of the catalytic Subunit〔J〕.J Biol Chem,2007;282(37):26971-80.
13Seshacharyulu P,Pandey P,Datta K,etal.Phosphatase:PP2A structural importance,regulation and its aberrant expression in cancer〔J〕.Cancer Lett,2013;335(1):9-18.
14Li M,Guo H,Damuni Z.Purification and characterization of two potent heat-stable protein inhibitors of protein phosphatase 2A from bovine kidney〔J〕.Biochemistry,1995;34(6):1988-96.
15Edirisinghe I,Arunachalam G,Wong C,etal.Cigarette smoke-induced oxidative/nitrosative stress impairs VEGF- and fluid shear stress-mediated signaling in endothelial cells〔J〕.Antioxid Redox Signal,2013;18(12):1535.
16Patel R,Gao M,Ahmad I,etal.Sprouty2,PTEN,and PP2A interact to regulate prostate cancer progression〔J〕.J Clin Invest,2013;123(3):1157-75.
17Wang Y,Wang B,Wu J,etal.Cancer-associated fibroblasts promote irradiated cancer cell recovery through autophagy〔J〕.Ebiomedicine,2017;17(1):45-56.
