ABT-737通过线粒体凋亡途径增加HepG2细胞对顺铂的敏感性
2018-04-08刘师兵赵国艳
刘师兵 于 洋 谢 奇 赵国艳 徐 冶
(吉林医药学院科研实验室,吉林 吉林 132013)
顺铂(CDDP)与DNA形成关联能够破坏DNA结构并导致肿瘤细胞内源性凋亡〔1〕。研究表明,CDDP能够直接靶向作用于线粒体,线粒体凋亡途径是CDDP诱导肿瘤细胞凋亡的主要作用机制之一〔2〕。线粒体活性氧(ROS)产生过多等功能异常情况的出现,与肿瘤的进展密切相关,研究认为,线粒体的分裂和融合与凋亡的关系极大〔3〕。虽然CDDP能够诱导肿瘤细胞的凋亡,但是肿瘤细胞可以通过多种机制抵抗CDDP的杀伤作用〔4〕。Bcl-2抑制剂(ABT-737)属于小分子抑制剂,能够降低某些化疗药物的促凋亡阈值。本实验旨在探讨ABT-737通过线粒体凋亡途径增加对HepG2细胞CDDP的敏感性。
1 材料和方法
1.1细胞、药物、试剂和仪器HepG2细胞由吉林大学病理学教研室惠赠;CDDP(美国Sigma-Aldrich公司);ABT-737(美国Selleck Chemicals);1640培养基(美国Life Technologies公司);胎牛血清(美国Life Technologies公司);胰蛋白酶(美国Thermo公司);四甲基偶氮唑盐(MTT,美国Sigma-Aldrich公司);免疫荧光染料Hoechst33342(美国Sigma-Aldrich公司);线粒体膜电位检测试剂盒(JC-1)、2′7′-二氯荧光黄双乙酸盐(DCFH-DA),(中国碧云天公司);CO2恒温培养箱(日本SANYO公司);离心机(德国Bioguge公司);酶标仪(美国Bio-rad公司);激光扫描共聚焦显微镜(日本Olympus);MUSETM细胞分析仪(美国EMD Millipore公司)。
1.2方法
1.2.1细胞培养与分组使用含有10%胎牛血清的RPMI1640培养基,放入恒温37℃、CO2浓度为5%的培养箱中常规培养HepG2细胞,0.25%胰蛋白酶消化传代,每2 d传代1次。根据实验目的,将细胞分为空白对照组、CDDP组、ABT-737组和联合用药组(CDDP+ABT-737组)。
1.2.2细胞活性检测(MTT比色法)取对数生长期的HepG2细胞接种于96孔板中,接种浓度约为1×104个细胞/孔,细胞用含有10%胎牛血清的RPMI1640培养基混匀,每孔终体积为100 μl,常规培养24 h。用1640培养基处理药品,各孔加入0、1、2、4、8、16 μmol/L的CDDP,继续培养24 h,每孔加入20 μl 5 mg/ml MTT,37℃、5% CO2恒温培养箱中孵育4 h后弃去培养液,每孔加入150 μl二甲基亚砜(DMSO),震荡10 min,酶标仪设置波长为570 nm,测吸光度值。另取相同方法接种HepG2细胞的96孔板,各孔加入0.5、1.0、2.0、4.0、8.0、16.0、32.0 μmol/L的ABT-737,继续培养24 h后加MTT(方法同CDDP MTT法)测得ABT-737的最大安全剂量。
1.2.3流式细胞术检测细胞凋亡取对数生长的HepG2细胞接种于6孔板中,接种浓度约为2×105个细胞/孔,常规培养24 h,根据不同药物处理组给药(给药浓度与分组同1.2.1),继续培养24 h后,胰蛋白酶消化并收集细胞,800 r/min离心5 min后弃去上清,加入1640培养液混悬细胞,使细胞浓度约为1×106个细胞/ml,将细胞原液与MUSETMAnnexin-V 凋亡细胞检测试剂1∶1混匀,避光孵育20 min后用MUSETM细胞分析仪检测。
1.2.4免疫荧光实验
1.2.4.1Hoechst染色观察细胞核形态变化取对数生长的HepG2细胞接种于24孔板中,接种浓度约为4×104个细胞/孔,常规培养24 h,根据不同药物处理组给药(给药浓度与分组同1.2.1),继续培养24 h后,弃去培养基,0.01 mol/L磷酸盐缓冲液(PBS)冲洗3次后,用4%多聚甲醛固定25 min,弃去固定液,用0.1%Trition X-100 冲洗,加入Hoechst33342染色液染色5 min,弃去染色液,PBS冲洗3次,甘油封片,ABT-737组加入8 μmol/L ABT-737,CDDP组加入4 μg/ml的CDDP,联合用药组加入8 μmol/L ABT-737和4 μg/ml的CDDP,加药后培养24 h,使用Hoechst33342对细胞核的细胞核进行染色。应用激光扫描共聚焦显微镜进行观察、拍照并记录结果。
1.2.4.2DCFH-DA染色观察细胞内RBE ROS水平取对数生长的HepG2细胞接种于24孔板中,接种浓度约为4×104个细胞/孔,常规培养24 h,根据不同药物处理组给药(给药浓度与分组同1.2.1),继续培养24 h。弃去孔板内液体,0.1 mol/L PBS 冲洗3次,加入DCFH-DA染液,37℃孵育30 min,0.1 mol/L PBS冲洗3次,甘油封片,应用激光扫描共聚焦显微镜进行观察、拍照并记录结果。
1.2.4.3JC-1染色观察线粒体膜电位变化取对数生长的HepG2细胞接种于24孔板中,接种浓度约为4×104个细胞/孔,37℃、5% CO2恒温培养箱中常规培养24 h,根据不同药物处理组给药,继续培养24 h后,弃去培养基,PBS洗涤5 min,加入1 ml JC-1染色工作液,充分混匀,细胞培养箱中37℃孵育20 min。按照每1 ml JC-1染色缓冲液加入4 ml蒸馏水的比例,配制适量的JC-1染色缓冲液,并放置于冰浴。37℃孵育结束后,吸除上清,用JC-1染色缓冲液洗涤2次。加入2 ml细胞培养液,应用激光共聚焦显微镜观察各组HepG2细胞线粒体膜电位变化。JC-1对HepG2细胞进行染色,正常线粒体呈红色荧光,膜电势下降时呈绿色荧光。
1.3统计学方法应用SPSS18.0软件进行t检验。
2 结 果
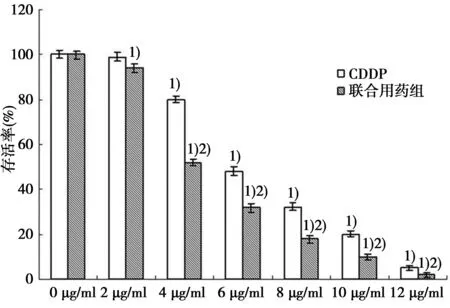
与0 μg/ml比较:1)P<0.05;与CDDP组比较:2)P<0.05图1 CDDP组与联合用药组HepG2细胞存活率比较(n=3)
2.1MTT法检测HepG2细胞生存率见图1。单加CDDP 24 h后,HepG2细胞的存活率随CDDP剂量的加大而减弱,IC50为6.19 μg/ml;同样的方法测得ABT-737的最高安全剂量为8 μmol/L。将此用药剂量应用于联合用药组,加入ABT-737后,CDDP的IC50降至4.29 μg/ml。
2.2Hoechst染色观察HepG2细胞凋亡CDDP组与联合用药组HepG2细胞的细胞核均出现明显的固缩和碎裂,CDDP组细胞核形态改变的程度和数量均明显少于联合用药组。对照组和ABT-737组细胞核无明显形态学改变。见图2。
2.3DCFH-DA染色检测HepG2细胞ROS水平对照组与ABT-737组绿色荧光强度无明显变化,CDDP组荧光强度略高,联合用药组绿色荧光强度最强,显示绿色荧光的细胞数量最多。见图3。
2.4JC-1染色观察线粒体膜电势见图4。对照组和ABT-737组红色荧光最强,绿色荧光较弱;CDDP组红色荧光较对照组弱,但绿色荧光明显高于对照组和ABT-737组;联合用药组红色荧光与CDDP组差别不大,绿色荧光最强。
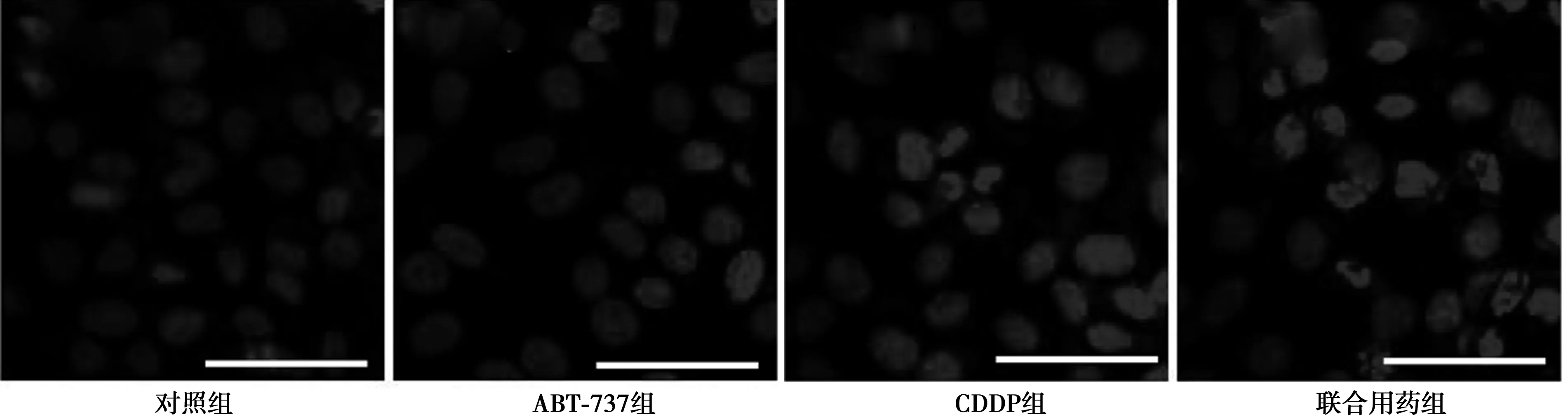
图2 Hoechst染色观察各组HepG2细胞细胞核的形态改变(Bar=80 μm,×800)

图3 DCFH-DA染色观察各组HepG2细胞的RBE ROS水平(Bar=80 μm,×400)
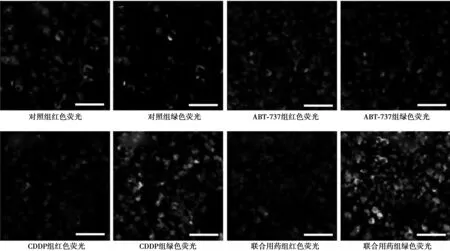
图4 JC-1染色观察各组HepG2细胞的线粒体膜电势改变(Bar=80 μm,×400)
2.5流式细胞术检测HepG2细胞凋亡对照组细胞凋亡率为7.12%,ABT-737组为7.53%,联合用药组为33.86%,CDDP组为19.24%。
3 讨 论
CDDP是临床常用于肝癌治疗的化疗药物之一,但肿瘤细胞的耐药性严重影响了CDDP的疗效。肿瘤细胞对化疗药物的耐药机制是多方面的,与DNA修复及合成异常、凋亡相关信号通路异常、自噬异常等因素密切相关〔5〕。通常认为,肿瘤细胞能够通过调控Bcl-2家族中的抗凋亡和促凋亡蛋白的平衡关系,从而应答化疗药物的干预,同时,在应激条件下,细胞可以通过自噬来维持细胞内稳态,该家族与线粒体关系密切,不但决定了线粒体外膜的凋亡阈值,而且参与调节线粒体外膜的通透性〔6〕。线粒体是大多数细胞的主要能量来源,同时也参与细胞信号转导,当线粒体受损时可启动内源性凋亡〔7〕。
ABT-737是BH3-only 蛋白BAD的模拟物,与Bcl-2、Bcl-2-XL、Bcl-W有高度亲和性,能够抑制三者的抗凋亡功能〔8〕。因此可以推测ABT-737能够增加HepG2细胞对CDDP的敏感性,CDDP进入细胞后可直接靶向作用于线粒体,并与线粒体外膜的某些蛋白直接结合,诱导线粒体凋亡。在应激情况下,线粒体常常通过融合和分裂过程产生更长或更短的线粒体,有研究认为线粒体分裂是重要的凋亡上游的生物学事件,受损的线粒体会导致ROS的堆积,进一步损伤核DNA或mtDNA〔9〕。
本实验结果显示,ABT-737联合CDDP引起的HepG2细胞凋亡与线粒体的关系极为密切。ABT-737能增加CDDP对HepG2细胞线粒体的损伤,主要表现在ROS蓄积和线粒体膜电位的变化,线粒体的损伤趋势与细胞凋亡的趋势相同,提示足够的线粒体损伤可能是CDDP杀伤HepG2细胞的重要条件,ABT-737通过线粒体凋亡途径增加了HepG2细胞对CDDP的敏感性。
1Galluzzi L,Senovilla L,Vitale I,etal.Molecular mechanisms of cisplatin resistance〔J〕.Oncogene,2012;31(15):1869-83.
2Kong B,Wang Q,Fung E,etal.p53 is required for cisplatin-induced processing of the mitochondrial fusion protein L-Opa1 that is mediated by the mitochondrial metallopeptidase Oma1 in gynecologic cancers〔J〕.J Biol Chem,2014;289(39):27134-45.
3Cassidy-Stone A,Chipuk JE,Ingerman E,etal.Chemical inhibition of the mitochondrial division dynamin reveals its role in Bax/Bak-dependent mitochondrial outer membrane permeabilization〔J〕.Dev Cell,2008;14(2):193-204.
4Srimunta U,Sawanyawisuth K,Kraiklang R,etal.High expression of ABCC1 indicates poor prognosis in intrahepatic cholangiocarcinoma〔J〕.Asian Pac J Cancer Prev,2012;13(2):125-30.
5Yoon H,Min JK,Lee DG,etal.L1 cell adhesion molecule and epidermal growth factor receptor activation confer cisplatin resistance in intrahepatic cholangiocarcinoma cells〔J〕.Cancer Lett,2012;316(1):70-6.
6Scheibye-Knudsen M,Fang EF,Croteau DL,etal.Protecting the mitochondrial powerhouse〔J〕.Trends Cell Biol,2015;25(3):158-70.
7Webster BR,Scott I,Traba J,etal.Regulation of autophagy and mitophagy by nutrient availability and acetylation〔J〕.Biochim Biophys Acta,2014;1841(4):525-34.
8Hollville E,Carroll RG,Cullen SP,etal.Bcl-2 family proteins participate in mitochondrial quality control by regulating Parkin/PINK1-dependent mitophagy〔J〕.Mol Cell,2014;55(3):451-66.
9Arena G,Gelmetti V,Torosantucci L,etal.PINK1 protects against cell death induced by mitochondrial depolarization,by phosphorylating Bcl-xL and impairing its pro-apoptotic cleavage〔J〕.Cell Death Differ,2013;20(7):920-30.
