传统推拿“束悗疗法”对糖尿病周围神经病变大鼠坐骨神经传导速度、超氧化物歧化酶、丙二醛表达的影响
2018-04-08刘明军陈飞腾陈林青李跃宗
尚 坤 刘明军 陈飞腾 李 波 王 蕾 陈林青 李跃宗 张 欣
(长春中医药大学,吉林 长春 130117)
“束悗疗法”的记载首见于《内经》,是一种中医传统推拿操作手法〔1〕。该手法选取四肢大血管或大神经干走行线路为施术部位,以手指或手掌按压局部并停留一定时间为主要操作手法,然后采用“缓按快放”或“快按缓放”的方式放开按压部位以推动局部气血运行,达到疏通经络、活血止痛的治疗目的。课题组曾在临床上以“束悗疗法”辅助治疗糖尿病性周围神经病变(DPN)取得满意疗效〔1〕。本研究以传统推拿“束悗疗法”为主要干预手段,通过观察DPN模型大鼠坐骨神经传导速度(SNCV)、坐骨神经中超氧化物歧化酶(SOD)、丙二醛(MDA)表达的改善情况开展相关机制研究。
1 材料与方法
1.1实验动物与分组选取雄性Wistar大鼠80只,鼠龄8 w,由长春中医药大学实验动物中心提供。分笼饲养,每笼10只,食用标准颗粒鼠粮。按完全随机设计法(随机数字表)将大鼠分为对照组、模型组、推拿组、药物组,每组20只。
1.2实验药品与试剂链脲佐菌素(美国Sigma公司,1 g/瓶);弥可保(甲钴胺注射液,卫材中国药业有限公司,500 μg/支);MDA、SOD试剂盒(南京建成生物工程研究所)。
1.3实验仪器推拿手法测定仪(TAP-Ⅱ型,上海益联医学发展有限公司);Medlab-u/4cs生物信号采集处理系统(南京美易科技有限公司);光学显微镜及图像分析系统(德国Leica公司);酶标仪(Bio-rad,美国)。
1.4方法
1.4.1动物模型的制备取实验大鼠60只,将链脲佐菌素临用前用pH值4.2~4.5的0.1 mol/L柠檬酸钠-柠檬酸缓冲液避光条件下配成1%浓度溶液,按剂量50 mg/kg于实验大鼠左下腹腔内单次注射,72 h后取尾血测血糖,凡血糖>16.7 mmol/L作为糖尿病大鼠。血糖未达标的造模大鼠,补打30 mg/kg 0.1%链脲佐菌素,72 h后测血糖,不足要求则弃去。如此在1 w后血糖仍>16.7 mmol/L,且从形态上有周围神经病变出现,SNCV明显降低时,即制成周围神经病变模型大鼠。另取实验大鼠20只,用0.1 mol/L柠檬酸钠-柠檬酸缓冲液(pH4.2、4℃)按同体积左下腹腔内单次注射,72 h后取尾血测血糖,作为对照组。实验中的模型组、药物组各死亡2只,推拿组死亡1只。
1.4.2干预方法①推拿组:将实验大鼠仰卧,固定其头部与上肢。施术者以左手牵拉大鼠一侧下肢,使下肢伸直呈水平位,以右手拇指指腹缓慢按压于大鼠腹股沟处,力量经推拿手法测试仪测定约为1 kg,持续30 s左右,然后突然抬手,停止按压,即“缓按快放”;间隔60 s左右,再次以右手拇指指腹快速按压于大鼠腹股沟处,力量经推拿手法测试仪测定约为1 kg,持续30 s左右,然后缓慢抬手,停止按压,即“快按缓放”。如此操作3次。以上治疗方法每日早晚操作2次,共治疗8 w。②药物组:将实验大鼠仰卧,捆绑固定,每日1次,每次10 min。根据人与动物体表面积计算法换算注射弥可保,大鼠用药量为50 μg/kg,隔日注射于下肢肌肉,左右腿交替注射,以利于吸收,共治疗8 w。③对照组和模型组:将实验大鼠仰卧,捆绑固定,每日1次,每次10 min,共8 w。
1.4.3检测指标及方法将实验大鼠治疗8 w后尾静脉取血以检测血糖。以电子秤称取每只大鼠体重后,腹腔注射10%水合氯醛(350 mg/kg)进行麻醉,将大鼠俯卧固定于固定架上,暴露出坐骨神经,用无菌玻璃剥离器轻轻剥离坐骨神经并游离下来,应用生物信号采集处理系统,测得SNCV,然后迅速将坐骨神经放入液氮中,放入-70℃冰箱中存放,以备匀浆。
1.5统计学方法采用SPSS17.0软件进行方差分析、秩和检验。
2 结 果
2.1各组SNCV比较与对照组SNCV〔(35.47±2.65)m/s〕比较、模型组SNCV明显降低〔(25.66±2.84)m/s〕(P<0.01),证明实验造模成功。与模型组比较,推拿组SNCV明显增加〔(33.82±2.29)m/s〕(P<0.01),药物组也明显增加〔(32.17±2.73)m/s〕(P<0.01),提示推拿“束悗疗法”和药物疗法能够有效改善DPN大鼠SNCV;推拿组与药物组比较差异无统计学意义(P>0.05)。
2.2各组坐骨神经SOD、MDA水平比较与对照组比较,坐骨神经SOD水平显著降低、MDA水平显著增高(P<0.01),证明实验造模成功。与模型组比较,推拿组坐骨神经SOD水平显著增加、MDA水平显著降低(P<0.01),与模型组比较,药物组坐骨神经SOD、MDA水平差异无统计学意义(P>0.05),见表1。
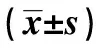
表1 各组坐骨神经SOD、MDA表达比较
与对照组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.01
3 讨 论
“束悗疗法”是一种中医传统推拿操作手法〔1〕,其最早记载见于《内经》。在《灵枢·杂病篇》中记载:“痿厥为四末束悗,乃疾解之,日二,不仁者,十日而知,无休。病已止。”主要的意思是在治疗痿厥症病人时,将患者四肢捆绑起来,待其产生憋闷胀痛感觉后,迅速解开,每天治疗2次,原本四肢没有知觉的患者在治疗10 d之后就会产生知觉,这种治疗方法不要停止,直到患者痊愈为止。可见,“束悗疗法”中的“束”,意为约束,束缚;“悗”,《辞海》解释为“烦闷”,《灵枢·五乱》中记载有“清浊相干,乱于胸中,是谓大悗”。由此引申束悗具有约束阻滞之意。《灵枢集注》中曾批注“夫按之束之,皆导引之法,犹尺蠖之欲伸而先屈也”。可见,在治疗气机不畅、麻痹不仁的病症时,可以在四肢脉位运用束悗按抑的手法,达到通郁开闭、导气通达的治疗目的。然而,现代推拿临床中,源于中医传统古籍的束悗疗法却鲜有应用,仅散见于个别理论性的文献探讨中〔2〕。
现代医学认为,DPN的病理表现一是营养神经的血管出现病变,表现为毛细血管的内皮细胞增生或基底膜增厚;二是神经本身出现病变,主要表现为神经纤维轴索的损伤或构成髓鞘或神经内膜的施万细胞的变性坏死〔3,4〕。中医则认为,DPN属于“痹证”、“痿证”之范畴,多由于气虚失运、血虚不荣、痰瘀阻滞或风湿痹阻等原因导致局部血流缓慢,瘀阻脉道,皮肉经脉失去气血濡养而痿废不用〔5,6〕。这与DPN所表现出来的临床症状是相吻合的。课题组在也曾在临床上以“束悗疗法”辅助治疗DPN并取得满意疗效〔1〕。
链脲佐菌素是一种广谱抗菌素,不但具有抗菌、抗肿瘤的功效,还由于其对胰岛β细胞高度选择性的毒性作用而具有致糖尿病的副作用〔7~9〕。同时,由于链脲佐菌素对组织毒性相对较小,动物存活率高,是国内外经常使用的制备糖尿病动物模型的成熟方法。神经电生理检查是早期诊断DPN的敏感指标,神经传导速度减慢是糖尿病出现神经病变的一个先兆,常常用于评价临床疗效与预后情况。
有研究表明,当机体出现高血糖后,高糖引起线粒体中的超氧阴离子增多,诱发周围细胞发生氧化应激,最终造成糖尿病的各种慢性并发症〔10〕。自由基是反映机体氧化应激的直接指标,但是自由基具有短瞬即逝的特性,实验中难以测定。但是一些蛋白质、脂质和DNA自由基损伤的终产物作为反映氧化应激的可靠指标和间接指标则能够检测到。MDA是脂质过氧化的最终产物,其在坐骨神经中表达的高低能够反映出脂质过氧化反应的程度,也反映出机体细胞受到自由基攻击的严重程度;SOD是机体细胞内部重要的自由基清除酶,其表达的高低直接反映了机体清除自由基的能力〔11,12〕。因此,神经组织内MDA、SOD表达的高低能够直接反映神经组织损伤及修复状态。
本研究发现,传统推拿“束悗疗法”能够有效改善DPN大鼠模型下肢SNVC,表明对周围神经功能恢复具有有效的促进作用;同时“束悗疗法”能够提高坐骨神经中SOD的表达,降低MDA的表达,表明具有抗氧化的作用从而发挥保护坐骨神经形态功能的疗效。
1刘鹏,张燕,李跃宗.“束悗疗法”治疗糖尿病性周围神经病变〔J〕.长春中医药大学学报,2013;29(5):880-1.
2旷时恩,旷晋.束悗疗法在伤病治疗的临床应用〔J〕.中华推拿疗法杂志,2004;2(4):15-6.
3沈薇,董继宏,汪听.糖尿病周围神经病的发病机制及治疗展望〔J〕.中国临床神经科学,2008;16(2):204-7.
4Laybutt DR,Kaneto H,Hasenkam PW,etal.Increased expression of antioxidant and antiapoptotic genes in islets that may contribute top-cell survival during chronic hyperglycemia〔J〕.Diabetes,2002;51(2):413-23.
5逄紫千,谢占峰,阎慧.针刺对糖尿病周围神经病变大鼠尾神经超微结构的影响〔J〕.长春中医药大学学报,2011;27(4):523-5.
6逄紫千,阎慧,解占峰.针刺对糖尿病周围神经病变大鼠坐骨神经组织病理学的影响〔J〕.长春中医药大学学报,2012;28(4):594-6.
7Raekietan N,Raekietan ML,Nadkarni MR.Studies on diabetogenic action of Stre-Ptozotoein(NSC-37917)〔J〕.Cancer Chemother Rep,1963;29:91-8.
8于德民,吴锐,尹雑,等.实验性链脲佐菌素糖尿病动物模型的研究〔J〕.中国糖尿病杂志,1995;3(2):105-9.
9黄继汉,黄晓阵,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算〔J〕.中国临床药理学与治疗学,2004;9(9):1069-72.
10Brownlee M.The pathobiology of diabetic complieations:a unifying methanism〔J〕.Diabeties,2005;54(6):1615-25.
11Ceriello A,Bortolotti N,Falleti E,etal.Total radicaltrapping antioxidant parameter in NIDDM,patients〔J〕.Diabetes Care,1997;20:194-7.
12Blaszczak R,Klljawski K,Kedziora-Kornatowska K,etal.The total antioxidant capacity and low-molecular antioxidant concentration in plasma of type-2 diabetes patients with different stage of metabolic compensation and concomitant diabetic nephropathy〔J〕.Pol Merkuriusz Lek,2005;18(103):29-32.
