过表达N-Myc下游调节基因3促进Hela宫颈癌细胞增殖和迁移
2018-04-08杨琳红陈立平齐亚灵王伟群
符 婕 白 雪 杨琳红 陈立平 魏 宏 李 晶 齐亚灵 王伟群
(佳木斯市中心医院妇产科,黑龙江 佳木斯 154002)
N-Myc下游调节基因(NDRG)家族是原癌基因N-myc下游调控基因,共包括4个成员,分别为NDRG1、NDRG2、NDRG3 和NDRG4。近年来的研究表明,NDRG成员在肿瘤的发生与演进中发挥重要的作用,并且发现同一成员可同时具有肿瘤促进和抑制双重作用,其原因可能是由各成员的组织特异性所决定的〔1〕。本实验研究NDRG3对Hela细胞增殖、迁移的作用及机制。
1 材料与方法
1.1实验细胞及主要材料Hela宫颈癌细胞株购自中科院上海细胞库;RPMI1640 培养基及胎牛血清(FBS)购自美国GIBCO公司;山羊抗NDRG3多克隆抗体购置加拿大SANTA CRUZ公司;细胞迁移(Transwell)小室、细胞培养皿、培养板购置美国CORNING公司;趋化因子CXC配体(L)5酶联免疫吸附(ELISA)及细胞计数试剂(CCK)-8试剂盒购自武汉博士德公司。
1.2细胞转染及鉴定将Hela细胞接种于6孔板中(6×105个/孔),细胞所用培养基为2 ml含10% FBS、无双抗的RPMI1640;将孔板置于37℃、5% CO2培养箱中培养至细胞密度达到80%后,更换上述培养基;依照Lipofectamine 2000转染试剂说明书进行转染;48 h后加入遗传霉素(G418)进行筛选(终浓度为4 ng/μl);行Western 印迹实验检测转染效率。
1.3CCK-8实验将亲代(Parental)、空质粒转染(Mock)、稳定转染(Overexpression)Hela细胞株分别接种于96孔板中(2×103个/孔),细胞所用培养基为100 μl含10% FBS及双抗的RPMI1640;将孔板置于37℃、5% CO2培养箱中培养;每隔24 h进行CCK-8实验。CCK-8实验具体操作:(1)向每孔中加入10 μl CCK-8试剂;(2)37℃培养箱中培养2 h;(3)酶标仪读取450 nm处吸光度值。
1.4Transwell实验将上述3株细胞分别接种于Transwell小室中(1×104个/室),所用培养基为100 μl无FBS的RPMI1640;将小室置于24孔板各孔,孔板中培养基为600 μl含10%FBS的RPMI1640;将孔板置于37℃培养箱中培养;12 h和24 h后用脱脂棉签擦拭小室内表面以去除没有迁移的细胞;结晶紫染色,冲洗后进行拍照、计数。
1.5ELISA实验将上述3株细胞分别接种于6孔板中(1.5×105个/孔),所用培养基为1 ml含10% RPMI1640;将细胞在37℃培养箱中培养48 h后收集培养基上清,按试剂盒操作步骤检测CXCL5浓度。
1.6统计分析采用SPSS19.0软件进行q检验。
2 结 果
2.1稳定转染细胞的鉴定Parental,Mock和Overexpression三组细胞的NDRG3相对表达量分别为0.682±0.179,0.783±0.137和1.312±0.159。Overexpression与Parental、Mock比较差异有统计学意义(P<0.01),由此说明已经构建了NDRG3稳定转染细胞株。
2.2过表达NDRG3促进Hela细胞的增殖细胞培养至72 h和96 h,Overexpression组吸光度值明显高于Parental和Mock组(P<0.05或<0.01),由此可见,过表达NDRG3可促进Hela细胞的增殖能力。见表1。
2.3过表达NDRG3促进Hela细胞的迁移细胞培养至24 h和36 h,Overexpression组迁移细胞数明显多于Parental和Mock组(P<0.05),由此可见,过表达NDRG3可促进Hela细胞的迁移能力。见表2。
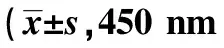
表1 过表达NDRG3促进Hela细胞的增殖吸光度,n=8)
与Parental和Mock比较:1)P<0.05,2)P<0.01;表2同
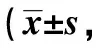
表2 过表达NDRG3促进Hela细胞的迁移细胞数,n=6)
2.4过表达NDRG3促进Hela细胞分泌CXCL5Parental和Mock组CXCL5分泌性蛋白量分别为(86.36±7.73)ng/ml和(87.12±7.39)ng/ml,两者显著低于Overexpression组〔(108.58±8.09)ng/ml,P<0.01〕。
3 讨 论
NDRG蛋白家族4个成员(NDRG1、NDRG2、NDRG3和NDRG4)的氨基酸同源性高达57%~65%,它们最显著特征是都具有一个NDR和一个α/β 水解酶折叠区域。在功能上,NDRG家族成员可参与细胞增殖、分化、发育和应激反应等多种过程,同时亦在肿瘤中发挥重要作用〔1〕。研究表明,NDRG1在多种肿瘤如前列腺癌、乳腺癌、结肠癌、神经胶质瘤和食管鳞状细胞癌具有转移抑制功能〔2〕。然而,特异性沉默肝癌细胞NDRG1的表达,可抑制细胞增殖、侵袭和裸鼠移植瘤的生长,由此可见,NDRG1在肝癌中具有肿瘤促进功能〔3〕。Deng等〔4〕报道转染NDRG2的肿瘤细胞会发生增殖、侵袭和转移能力下降的现象。与NDRG1一样,NDRG4也具有肿瘤促进和抑制的双重作用,一方面在结肠直肠癌中其可减少癌细胞的增殖和侵袭〔5〕;而另一方面其又可促进成胶质细胞瘤的增殖与存活〔6〕。
本实验研究表明,过表达NDRG3基因在显著促进Hela细胞的增殖和迁移的同时,还上调Hela的分泌性趋化因子CXCL5蛋白水平,该结果与我们先前在前列腺癌中的研究结果相一致〔7〕。同样,我们在之前的研究也显示CXCL5与NDRG3一样,均可促进前列腺癌细胞的增殖〔8〕,提示NDRG3/CXCL5轴在肿瘤中的重要作用。在肿瘤微环境中,肿瘤细胞、间质细胞、炎性细胞等多种细胞可分泌趋化因子经自分泌和旁分泌途径参与肿瘤的恶性转化和发展进程〔9〕。基于此,本研究推断,在宫颈癌中上调NDRG3表达可促进肿瘤细胞分泌CXCL5进入肿瘤微环境,作为微环境中的一种活性成分,CXCL5进而经与肿瘤细胞,间质细胞、炎性细胞上的CXCL5受体(CXCR2)作用而发挥促癌功能。
1Melotte V,Qu X,Ongenaert M,etal.The N-myc downstream regulated gene (NDRG) family:diverse functions,multiple applications〔J〕.FASEB J,2010;24(11):4153-66.
2Yang X,An L,Li X.NDRG3 and NDRG4,two novel tumor-related genes〔J〕.Biomed Pharmacother,2013;67(7):681-4.
3Yan X,Chua MS,Sun H,etal.N-Myc down-regulated gene 1 mediates proliferation,invasion,and apoptosis of hepatocellular carcinoma cells〔J〕.Cancer Lett,2008;262 (1):133-42.
4Deng Y,Yao L,Chau L,etal.N-Myc downstreamregulated gene 2 (NDRG2) inhibits glioblastoma cell proliferation〔J〕.Int J Cancer,2003;106(3):342-7.
5Melotte V,Lentjes MH,van den Bosch SM,etal.N-Myc downstream regulated gene 4 (NDRG4):a candidate tumor suppressor gene and potential biomarker for colorectal cancer〔J〕.J Natl Cancer Inst,2009;101(13):916-27.
6Schilling SH,Hjelmeland AB,Radiloff DR,etal.NDRG4 is required for cell cycle progression and survival in glioblastoma cells〔J〕.J Biol Chem,2009;284 (37):25160-9.
7Wang W,Li Y,Li Y,etal.NDRG3 is an androgen regulated and prostate enriched gene that promotes in vitro and in vivo prostate cancer cell growth〔J〕.Int J Cancer,2009;124(3):521-30.
8齐亚灵,王伟群,张建华,等.CXC 趋化因子配体 5 对前列腺癌细胞生长的作用〔J〕.中国老年学杂志,2014;34(11):3035-6.
9Cheng ZH,Shi YX,Yuan M,etal.Chemokines and their receptors in lung cancer progression and metastasis〔J〕.J Zhejiang Univ Sci B,2016;17(5):342-51.
