替米沙坦对4%高盐饮食诱导肾脏纤维化的保护作用
2018-04-08商黔惠王晓春
赵 宇 刘 燕 商黔惠 王晓春 刘 婵 刘 娟
(遵义医学院附属医院临床医学研究所 心血管病研究所 高血压研究室,贵州 遵义 563003)
原发性高血压是由多种遗传因素和环境因素共同作用的疾病,盐作为一种重要的环境因素,在高血压的发生发展中发挥重要作用〔1〕。研究表明,肾脏和盐敏感性有着密切关系,肾脏纤维化是高盐饮食引起肾脏损害的重要病理表现,而转化生长因子(TGF)-β1/Smads信号通路是肾脏纤维化发生过程中最重要的信号通路〔2〕。TGF-β信号系统参与多种慢性肾脏损伤的病理生理过程,主要包括促进细胞外基质集聚、诱导足细胞凋亡和肾小管上皮细胞转分化等〔3〕。替米沙坦能明显降低血压、改善高血压肾损害,但其机制尚不明确。本实验研究替米沙坦对高盐诱导肾脏损害的保护作用及抗纤维化的机制。
1 材料与方法
1.1实验动物与分组4周龄清洁级雄性Wistar大鼠36只,均购于第三军医大学大坪医院实验动物中心,许可证号:SCXK-(渝)2007-0005。大鼠适应性饲养1 w后随机分为3组:普食组 12只:予0.5%NaCl的颗粒饲料喂养;高盐组 12只:予4%NaCl的颗粒饲料喂养;高盐+替米沙坦组12只:予4%NaCl的颗粒饲料喂养+替米沙坦40 mg·kg-1·d-1灌胃。动物室温度22℃~25℃,湿度45%左右。昼夜交替12 h,大鼠自由饮水,每天更换一次垫料,保持垫料干燥。实验每4 w用Softron BP-98A大小鼠无创测压仪进行尾动脉收缩压的测定。
1.2主要试剂含NaCl 分别为0.5%和4%的颗粒饲料,购自广东省医学实验动物中心,许可证号:SCXK-(粤)2008-0002。替米沙坦原料(上海现代制药股份有限公司),小鼠抗β-actin单克隆抗体(武汉博士德生物技术有限公司),兔抗TGF-β1多克隆抗体、山羊抗Smad2/3多克隆抗体、小鼠抗Smad7 多克隆抗体(美国Santa Cruz公司)。
1.324 h尿液的收集实验第24周,将各组大鼠分别用代谢笼适应性饲养后,收集24 h尿液,用尿生化仪检测尿微量白蛋白(MAU)、尿肌酐(Cr)。
1.4标本收集24 w实验末,将各组大鼠称重,10%水合氯醛40 mg/kg麻醉,从颈动脉插管采血,加入血生化管中,将生化管放入半径15 cm离心机中4 000 r/min离心10 min,-80℃冰箱保存待测。取出两侧肾脏置冰盒上,投入冰冷的生理盐水中清洗,去除脂肪及被膜组织,置滤纸上吸干后放电子天平上称重。将右肾横切为两半,取上极分离皮质,将中间厚度约0.3 cm的组织块在4%多聚甲醛缓冲液中固定24 h,石蜡包埋,切片,用做苏木素-伊红(HE)染色和Masson染色,其余肾脏组织分离出肾皮质-80℃冰箱保存。
1.5HE染色检测肾脏形态学变化制备各组肾皮质蜡块切片,厚度约10 μm,常规脱蜡、水化,滴加苏木素染色4 min,返蓝冲洗后滴加伊红染色2 min,酒精脱水、烘干后中性树胶封片。用Leica光学显微镜在400倍下观察肾脏肾小球、肾小管等形态学改变。
1.6Masson染色检测肾脏纤维化程度制备各组肾皮质蜡块切片,厚度约10 μm,常规脱蜡、水化,现配苏木素染液3 min,返蓝冲洗后滴加1%丽春红酸性复红液30 min后,清洗后滴加1%磷钼酸数秒,清洗后滴加2%亮绿2~3 min,清洗烘干后中性树胶封片。采用Leica图像分析仪进行半定量分析:在同一条件下对每张标本选取6个不重复的肾小球视野(×400),将肾小球内呈现为绿色的纤维区域视作阳性目标,以阳性面积与肾小球总面积的比值作为肾小球纤维化指数。
1.7各蛋白表达的检测将各组大鼠肾皮质用蛋白提取试剂盒提取蛋白,使用二喹啉甲酸(BCA)蛋白测定试剂盒测定蛋白浓度。蛋白上样量为50 μg,经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳转到聚偏氟乙烯(PVDF)膜上,封闭1.5 h,然后加入一抗(1∶1 000 α-SMA 、TGF-β1、p-Smad2/3、Smad7)4℃孵育过夜,然后加入二抗(1∶2 000相应二抗)孵育1 h,洗膜后显影。使用凝胶成像系统采集图像,以目的蛋白条带与β-actin蛋白条带的光密度值比值表示其相对表达量。
1.8统计学方法应用SPSS13.0软件,正态分布资料组间比较采用单因素方差分析,方差齐使用LSD法,方差不齐使用Tamhane T2法。
2 结 果
2.1各组尾动脉收缩压的变化从第8周起,高盐组及高盐+替米沙坦组尾动脉收缩压显著高于普食组(P<0.05),与高盐组比较,高盐+替米沙坦组大鼠尾动脉收缩压显著降低(P<0.05)。见表1。

表1 各组尾动脉收缩压的变化
与普食组相比:1)P<0.05;与高盐组相比:2)P<0.05,下表同
2.2各组肾脏生化指标比较与普食组相比,高盐组及高盐+替米沙坦组双肾重量/体重、尿MAU均明显增加(均P<0.05),Ccr显著降低(P<0.05);替米沙坦组尿MAU较高盐组显著下降(P<0.05),但双肾重/体重及Ccr与高盐组比较差异无统计学意义(均P>0.05)。见表2。

表2 各组肾脏生化指标的变化
2.3各组肾皮质HE染色结果与普食组相比,高盐组肾小球硬化、肾小管肥大,而替米沙坦组能明显改善肾小球硬化。见图1。
2.4各组肾皮质Masson染色结果及肾小球纤维指数比较与普食组相比,高盐组肾小球胶原纤维明显增加,替米沙坦组与高盐组比较肾小球胶原纤维明显减少。进一步计算肾小球纤维化指数,高盐组肾小球纤维纤化指数较普食组明显增加〔(20.93±1.14) vs (13.55±1.13),P<0.05〕,替米沙坦组(13.83±1.19)较高盐组明显降低(P<0.05)。见图2。
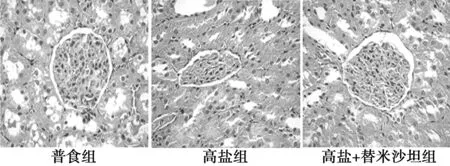
图1 各组肾皮质HE染色结果(×400)
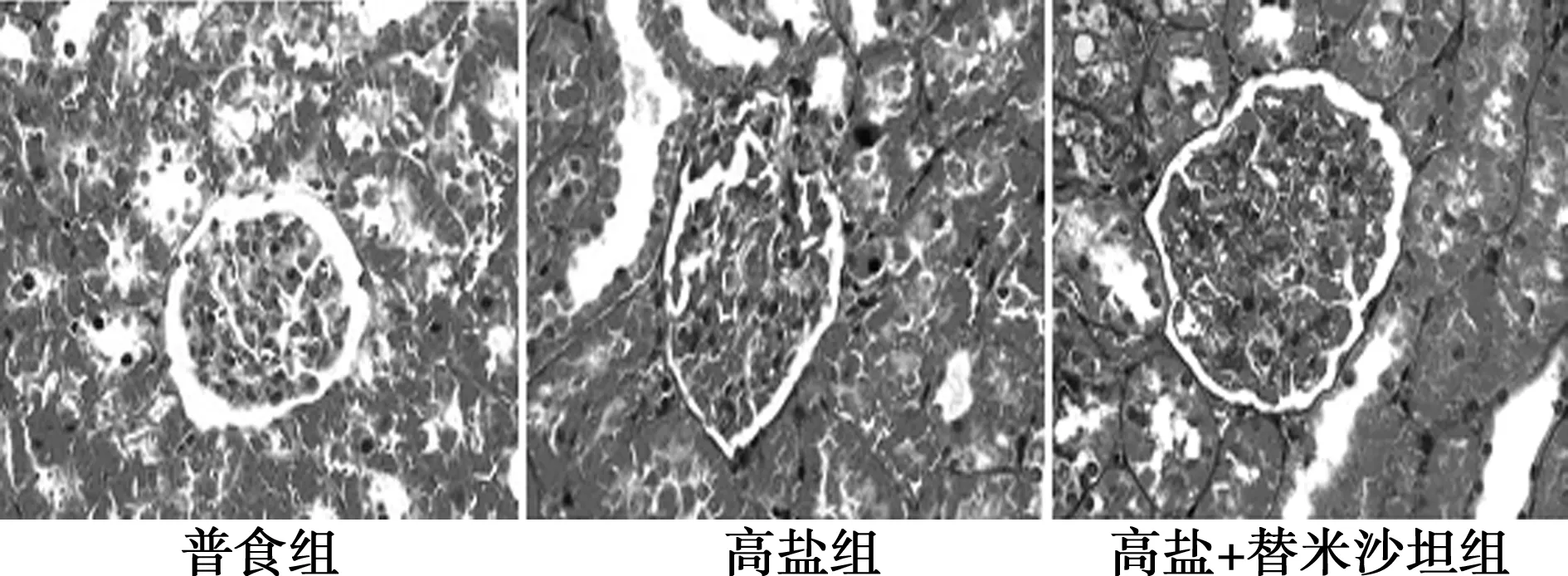
图2 各组肾皮质Masson染色结果(×400)
2.5各组肾皮质TGF-β1/Smads通路蛋白表达的变化与普食组相比,高盐组及高盐+替米沙坦组肾皮质α-SMA、TGF-β1、Smad2/3、Smad7蛋白表达均明显增加(均P<0.05),替米沙坦组较高盐组明显降低(均P<0.05)。见表3,图3。

表3 各组肾皮质TGF-β1/Smads通路蛋白表达的变化

图3 各组肾皮质TGF-β1/Smads通路蛋白表达的变化
3 讨 论
长期高盐饮食是高血压发生发展的重要环境因素之一,但高盐饮食对靶器官损害的机制目前仍不清楚。本实验从第8周开始高盐组大鼠血压逐渐升高,并持续至实验末。说明长期高盐饮食可导致Wistar大鼠血压升高,与文献结果一致〔4〕。本文观察到,高盐饮食的摄入对肾小球有损伤,这与已有的报道一致〔5〕。本研究发现,替米沙坦能明显降低高盐饮食引起的血压增高,降低尿微量白蛋白,提示替米沙坦能降低血压和减少蛋白排泄。因此,替米沙坦除了能降低血压外,对肾脏的保护作用值得进一步研究。
肾脏纤维化是慢性肾脏病变重要的病理表现。肾脏纤维化是一个多因素参与的复杂过程,主要包括TGF、细胞分泌因子、氧化应激、炎症刺激等。研究证实〔6〕,TGF-β1是促进肾脏纤维化的最关键因子。TGF-β1 与TGF-β1Ⅱ型受体结合后,激活TGF-β1Ⅰ型受体的丝氨酸-苏氨酸激酶,Smad2、Smad3蛋白被磷酸化,进一步与Smad4形成活性的转录复合物进入核内,调节相应靶基因转录〔6〕。高盐可引起自发性高血压大鼠与Wistar-Kyoto大鼠肾脏TGF-β1基因过量表达,从而导致肾小球、肾小管广泛纤维化。研究发现,肾小管上皮细胞、内皮细胞、足细胞及肾小球上皮细胞均可以发生表型转化,参与肾脏纤维化的形成〔6〕。在肾间质纤维化发生发展中,肾小管上皮细胞可转化为肌成纤维细胞,而α-SMA是肌成纤维细胞的特征蛋白,α-SMA阳性的肌成纤维细胞是主要的基质合成细胞〔7〕。进一步相关研究发现,给予Dahl盐敏感大鼠TGF-β1抗体治疗后,肾脏TGF-β1 mRNA 及蛋白的表达下调,可降低高盐饮食引起的血压升高及改善心脏、肾脏等靶器官功能障碍〔8〕,说明抑制TGF-β1可减轻高盐引起的肾小球和肾小管细胞损伤。Smad7是TGF-β1信号通路的负反馈调节因子,主要通过与TGF-β1Ⅰ型受体结合抑制TGF-β1信号转导〔9〕。研究表明,过量表达的Smad7可通过阻断活化的Smad2、3抑制α-SMA的表达,从而发挥了逆转上皮间充质转化、抑制肾脏纤维化形成的作用〔10〕。研究发现,替米沙坦可通过激活过氧化物酶体增殖物活化受体(PPAR)-γ抑制肝脏纤维化〔11〕。替米沙坦可通过抑制巨噬细胞的浸润,降低单侧输尿管结扎小鼠HIF-1α的表达,减轻单侧输尿管结扎小鼠肾脏纤维化〔12〕。课题组前期研究发现,替米沙坦通过抑制TGF-β1/Smads通路减轻长期高盐饮食诱导Wistar大鼠血压升高及心肌纤维化〔13〕,同时,替米沙坦可改善长期高盐饮食诱导Wistar大鼠肾脏功能损害和保护肾小球损害〔14〕,但其机制尚不明确。本实验发现,TGF-β1/smads通路在高盐诱导的肾脏纤维化进程中起着重要的作用,而Smad7代偿性增高不能阻断肾脏纤维化的发生。本研究提示替米沙坦能明显改善肾小球纤维化,可能通过抑制TGF-β1/smads通路有关。
综上所述,TGF-β1/smads通路参与高盐诱导的肾脏纤维化进程,替米沙坦可能通过抑制TGF-β1/smads通路改善肾脏纤维化,从而改善高盐诱导高血压所致的肾损害。
1Franco V,Oparil S.Salt sensitivity,a determinant of blood pressure,cardiovascular disease and survival〔J〕.J Am Coll Nutr,2006;25(3 Suppl):247S.
2Susica D,Frohlicha ED,Koborib H,etal.Salt-induce renal in SHRs is mediated by AT1 receptor activation〔J〕.J Hypertens,2011;29(4):716-23.
3Schiffer M,Bitzer M,Roberts IS,etal.Apotosis in podocytes induced by TGF-β and smad7〔J〕.Clin Invest,2001;108(6):807-16.
4于海荣,范洪亮,梅爱敏,等.不同浓度高盐饲料喂养致高血压模型的实验研究〔J〕.山东医药,2012;52(32):34-6.
5Habibi J,Hayden MR,Ferrario CM,etal.Sait loading promotes kidney injury via fibrosis in youny female Ren2 rats〔J〕.Cardiorenal Med,2014;4(1):43-52.
6谢盛彬,王伟铭,陈楠.UUO模型大鼠肾间质纤维化动态进展及α-SMA、TGF-β1和VDR表达变化〔J〕.上海交通大学学报(医学版),2010;30(7):752-7.
7Qi W,Chen X,Poronnik P,etal.The renal cortical fibroblast in renal tubulointerstitial fibrosis〔J〕.Int J Biochem Cell Biol,2006;38(1):1-5.
8Dahly AJ,Hoagland KM,Flasch AK,etal.Antihypertensive effects of chronic anti-TGF-beta antibody therapy in Dahl S rats〔J〕.Am Regul Integr Comp Physiol,2002;283(3):R757-67.
9王琳,邓跃毅,陈以平.Smad7对TGF-β/Smad信号转导通路的调节及其在肾纤维化中的作用〔J〕.第二军医大学学报,2004;25(2):207-9.
10Ka SM,Huang XR,Lan HY,etal.Smad7 gene therapy ameliorates an autoimmune crescentic glomerulonephritis in mice〔J〕.J Am Soc Nephrol,2007;18(6):1777-88.
11李国云,傅茂英,孟丽萍,等.替米沙坦对肝纤维化大鼠肝组织TGFβ1、PDGF和PPAR-γ表达的影响〔J〕.实用肝脏病杂志,2012;15(6):520-3.
12廖盼丽.替米沙坦通过影响HIF-1α的表达抑制肾脏纤维化的进展〔D〕.武汉:华中科技大学,2012.
13李同,商黔惠,刘婵,石耿辉.转化生长因子β_1/Smads表达在高盐饮食致Wistar大鼠心肌纤维化中的作用及替米沙坦干预〔J〕.中华高血压杂志,2013;(7):648-53.
14王晓春,商黔惠,等.高盐诱导Wistar大鼠肾损害的机制及替米沙坦的干预效果〔J〕.中国老年学杂志,2015;35(12):3213-5.
