非小细胞肺癌瘀血证侯研究及活血化瘀药物临床疗效观察
2018-04-02,,
,,
(1 临沂市人民医院老年病科,山东临沂276003;2 临沂市人民医院肿瘤内一科,山东临沂276003;3 山东大学齐鲁医院中医科,山东济南250012)
近年来恶性肿瘤的发病率逐年增高,而肺癌又居恶性肿瘤之首,是目前病死率最高的恶性肿瘤。肺癌主要分为小细胞肺癌和非小细胞肺癌两大类,其中非小细胞肺癌占居了85% 以上的比例。虽然越来越多的早期筛查手段被广泛应用于肺癌的诊断,但其治疗效果仍不理想。中医药作为肺癌治疗的重要手段之一,越来越为临床医师所重视。活血化瘀法是公认的治疗肺癌的中医辨证论治的方法之一,广泛应用于临床。为研究非小细胞肺癌瘀血证候诊断的实验室指标及活血化瘀药物在该证候患者中应用的临床疗效,设计了本实验,现将观察结果汇报如下。
1 资料与方法
1.1临床资料选择自2010年12月至2016年12月期间,全部符合观察组标准的非小细胞肺癌患者共计218例。其中男性89例,女性79例,年龄29~78岁,平均年龄69岁。
1.1.1入组标准病理确诊为非小细胞肺癌,无手术指征或患者放弃手术治疗改为内科治疗,同时符合下列所有标准者,纳入临床观察:①胸部CT提示至少有一处可测量病灶,但病灶不适合设野放疗者;浅病灶或有可扪及的转移淋巴结或皮肤转移结节作为可测量病灶;②参照中华人民共和国国家食品药品监督管理局组织编写的《中药新药临床研究指导原则》“气血瘀滞证”诊断标准,经两名中级或以上职称中医师辩证确诊属瘀血证候者;③未经放化疗,或既往服用含活血化瘀药物的中药组方但该类药物已停用2月以上者;④预期存活超过2月;⑤K氏评分60分以上,预计能耐受EP方案化疗;⑥同意接受临床观察研究赠药并签定知情同意书者。
1.1.2排除标准①有心肝肾及其他严重基础疾病,不能耐受化疗者;②因不能耐受不良反应而不能完成二周期化疗,或化疗剂量强度明显降低者;③有明显出血倾向、过敏体质或对多种药物过敏者;④服用“活血组方”出现出血倾向或需停药的不良反应,而未满一个观察周期者。
1.2研究方法
1.2.1分组将218例入组患者应用随机数字表法分为治疗组和对照组,每组109例。所有患者均抽取空腹血清,检测血清sE-cad、Fig、GMP-140,检测结果与标准值对比,有1~3项高于标准值者,治疗组纳入“活血组方治疗组”-A组,对照组纳入“高凝血指标对照组”-B组,三项检测结果均正常者,治疗组纳入“单纯化疗治疗组”-C组,对照组纳入“单纯对照组”-D组。其中A组57人,B组58人,C组52人,D组51人。
1.2.2治疗方案EP方案应用细则:依托泊苷 102 mg/m2,ID,d1-3;顺铂 75mg/ m2,ID,d1,每3周重复。活血组方服用细则:莪术、赤芍、姜黄、甘草各研细未,以2:2:2:1比例混合均匀,装0号空心胶囊备用。每次6g,温开水送服,2次/日,观察周期内连续服用。A组EP方案化疗同时联合应用活血组方口服;B组EP方案化疗;C组EP方案化疗;D组EP方案化疗同时联合应用活血组方口服。
1.2.3观察方法以EP方案化疗二周期为一个观察周期,即自第一周期EP方案应用开始至第三周期EP方案化疗前为一个观察周期。每个观察周期前、后均行胸部CT平扫、肿瘤标志物全套以及化疗前常规检查。
1.3观察指标及疗效评价以RECIST疗效评价标准为依据测量肺部肿瘤变化数值或以浅表病灶包括可扪及的淋巴结或皮肤结节作为疗效评价依据,记录各组总有效率。
1.3.1RECIST疗效评价标准①肿瘤病灶的测量:基线和随诊均应用薄层胸部CT测量肿瘤病灶或者应用超声波测量可扪及的淋巴结或皮肤结节等表浅病灶。②肿瘤缓解的评价:可测量的目标病灶至少1个,每个脏器最多5个,全部病灶最多10个,测量所有目标病灶的长度之和作为基线的全部肿瘤负荷。完全缓解(CR)是指所有目标病灶消失;部分缓解(PR)是指基线病灶长径总和缩小≥30%;部分进展(PD)是指基线病灶长径总和增加≥ 20%或出现新病灶;病情稳定(SD)是指基线病灶长径总和有缩小但未达PR或有增加但未达PD;总有效率(ORR)为CR与PR之和。
1.3.2瘀血证候实验室指标所有患者用药前、一个观察周期后分别抽取空腹血,检测血清sE-cad、Fig、GMP-140,记录检测数值。

2 结果
2.1临床疗效观察四组患者治疗后的总有效率无统计学差异(P>0.05)。见表1。
2.2“瘀血证候”实验室指标的变化比较sE-cad水平各组治疗前后无明显变化(P>0.05);A组应用活血化瘀药物后,FIB及GMP-140治疗后较治疗前有下降趋势,有显著的统计学差异(P<0.05);其他三组治疗前后FIB及GMP-140无统计学差异(P>0.05)。见表2。
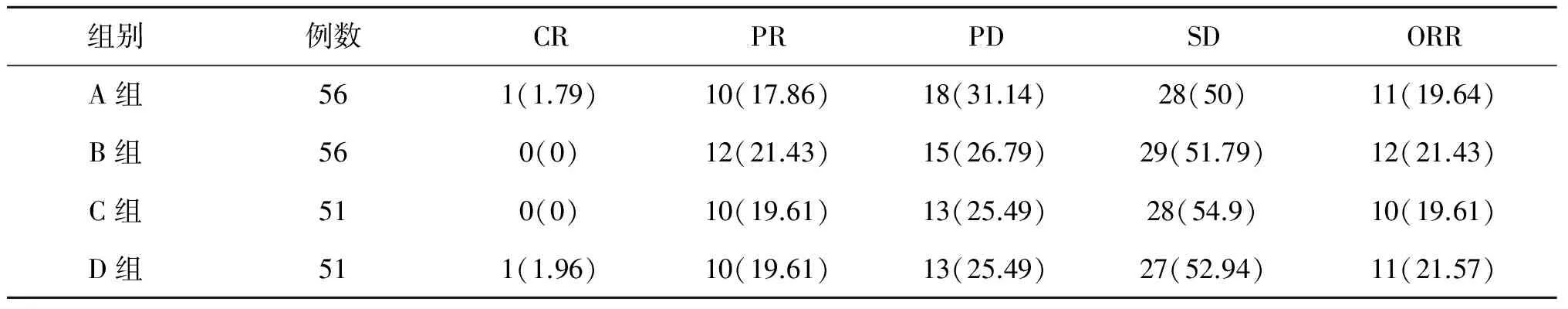
表1 四组患者的临床疗效[n(%)]

表2 “瘀血证候”实验室指标的变化
注:与治疗前比较,*P<0.05
2.3随访A组有1人上级医院治疗而失访;B组有1人因家庭原因未能完成第二周期的化疗,另有1人因严重呕吐等胃肠道反应改用其他化疗方案;C组1人因严重骨髓抑制改用其他化疗方案。
3 讨论
3.1“瘀血证候”实验室指标对活血化瘀药物的指导作用恶性肿瘤由于常常表现为体表、某一或某些脏器的肿块,依据中医学辩证论治思想临床多将其归结为“瘀血证”范畴,从而活血化瘀成为治疗该病的基本方法之一,但既往关于该法在恶性肿瘤治疗中临床疗效的研究却有截然不同的结论[1-5]。研究结论的不同,可能与活血化瘀药物本身的药理作用无直接关系,关键在于没有正确把握应用活血化瘀药物的时机,即在恶性肿瘤的发生、发展阶段对“瘀血证”阶段除传统的中医辩证外,尚无明确的实验室检查指标,导致单纯依靠辨证表现或中医学“瘀积于内”等思想应用活血化瘀药物,从而得出活血化瘀药物抑制或者促进肿瘤转移的相反结论,所以寻找几种实验室指标作为恶性肿瘤发展转移过程中“瘀血证候”的标志从而指导活血化瘀药物的应用有重要的临床意义。研究发现E-cad与肿瘤细胞的分化、侵袭和转移有密切关系[6-11]。E-cad是细胞间粘附因子的一种,介导同源细胞间的连接,作为重要的黏附分子,其主要抑制上皮组织来源的恶性肿瘤的发生发展[12]。E-cad水平代表了同源细胞间粘附能力的高低,这种“同源细胞间的粘附”可以形象化地认为是中医学“瘀血证候”的分子表述。GMP-140是人体血小板活化过程中形成的一种膜抗原,其含量能够代表体内血小板的活化程度[13]。而血小板的活化,进而对肿瘤细胞进行包埋和沉积被认为是形成癌栓的一个重要因素。血液中的肿瘤细胞,绝大多数因肿瘤细胞本身或宿主的免疫监控而在短期内死亡,只有肿瘤细胞或与血小板相互作用聚集成微小的栓簇,才能避免血液湍流的伤害以及逃避宿主免疫监控,而在继发脏器中着床,血小板GMP-140高表达可能是循环肿瘤细胞逃避化疗打击的重要因素。FIB本身即凝血因子Ⅰ,是血液高凝状态的重要实验室指标。所以,在理论上可以把E-cad、GMP-140、FIB设想成为恶性肿瘤“瘀血证候”实验室指标。本课题的临床观察结果发现,高凝血指标组应用活血组方后,GMP-140、FIB较治疗前明显下降,但在凝血指标正常的对照组加用活血组方,其凝血指标无显著的改变。但从肿瘤治疗的有效率来看,不论是否加用活血组方,各个治疗组间患者总有效率均无明显统计学差异。因此,我们认为课题设想的“瘀血证候”实验室指标尚不能作为活血化瘀药物应用的标准。我们分析对治疗效果的影响不大,可能与观察时间短,未能随访患者的长期预后有关,我们也考虑到“瘀血证候”实验室指标是否可以作为非小细胞肺癌患者较差预后的一个参考,这尚待进一步研究。
3.2“活血组方”对非小细胞肺癌患者的疗效
3.2.1“活血组方”对非小细胞肺癌缓解率无明显的近期获益本课题研究中所采用的“活血组方”是在研究组成员临床认识的基础上,参考山东中医药大学硕士研究生课题组方而成。该方药物组成简单,不仅从中药学角度主要由活血化瘀药物组成,而且从现代药理研究发现单药多有广谱抗肿瘤作用。但本课题研究结果统计学分析发现,含“活血组方”的对照组及“活血组方”治疗组肿瘤缓解率均不高于单纯化疗组,说明以RECIST标准作疗效评价时,“活血组方”在非小细胞肺癌患者的肿瘤缓解率上无明显帮助。该研究结果可能的原因是活血化瘀药物的抗肿瘤作用在较短时间内不会有明显的效果,这有别于化疗药物的立竿见影,但该组方对肿瘤患者的生活质量似乎有改善趋势,并且可改善“高凝血指标患者”的异常高凝指标。所以,肿瘤患者的远期生存率不仅与肿瘤实体的缩小有密切关系,与生活质量的关系也是下一步要着重研究的课题。
3.2.2“活血组方”能改善非小细胞肺癌患者高凝状态分析一个观察周期“活血组方”治疗前后“瘀血证候”实验室指标的变化发现,“活血组方”治疗后,高凝血指标组患者的E-cad无明显变化,但FIB、GMP-140均较前下降,有统计学意义(P<0.05)。有研究表明[14-15],肿瘤患者血液的高凝状态为肿瘤细胞的转移、继发器官定位附着以及逃避宿主免疫监控提供了条件。因此,监测FIB、GMP-140等凝血指标的水平不仅能提示机体“瘀血证候”的出现,而且与肿瘤发展转移密切相关。本研究发现,在应用活血组方后FIB、GMP-140明显下降,以此推断如果大样本长期观察,可能会出现“活血组方”通过改善非小细胞肺癌患者高凝状态从而最终延长患者的总生存率,但本课题因设计、经费等诸多原因未能在此方面作进一步的观察。
总之,本课题研究提示,E-cad、FIB、GMP-140尚不能作为临床指导活血化瘀药物应用的实验室指标;以RECIST标准来评价恶性肿瘤疗效时,“活血组方”在非小细胞肺癌患者中无预期的疗效;但“活血组方”可以改善非小细胞肺癌患者血液高凝状态。
[1]陈刚, 徐晓玉, 严鹏科, 等. 川芎嗪和丹参对小鼠Lewis肺癌生长的抑制作用与抑制血管生成的关系[J]. 中草药, 2004, 35(3) : 296-299.
[2]汤芷妮, 骆云鹏, 葛菲, 等. 活血化瘀抗肿瘤中草药作用机制的研究进展[J]. 中国药房, 2016, 27 (8) : 1146-1149.
[3]李燕淑, 赵鑫, 李麒, 等. 活血化瘀药物治疗恶性肿瘤作用概述[J]. 辽宁中医药大学学报, 2015, 17(5):252-254.
[4]孟华, 朱妙章, 郭军, 等. 中药当归、川芎、丹参提取液促血管生成作用的实验研究[J]. 中药材, 2006, 29(6):574-576.
[5]缪黎玮, 叶丽红. 肿瘤血瘀证和活血化瘀药对血管生成的作用[J]. 吉林中医药, 2015, 36(5) : 521-523.
[6]刘娟, 欧玉荣, 景桂英, 等. β-catenin 和 E-cadherin 在结直肠癌中的表达及其临床意义[J]. 中国组织化学与细胞化学杂志, 2013, 22(3):234-239.
[7]Foschini MP, Leonardi E, Eusebi LH, et al. Podoplanin and E-cadherin expression in preoperative incisional biopsies of oral squamous cell carcinoma is related to lymph node metastases[J]. Int J Surg Pathol, 2013, 21(2):133-141.
[8]Rakha EA, Teoh TK, Lee AH, et al. Further evidence that E-cadherin is not a tumour suppressor gene in invasive ductal carcinoma of the breast:animmunohistochemical study[J]. Histopathology, 2013, 62(5):695-701.
[9]Wang C, Jiang K, Kang X, et al. Tumor-derived secretory clusterin duces epithelial-mesenchymal transition and facilitates hepatocellular carcinoma metastasis[J]. Int J Biochem Cell Biol, 2012, 44(12):2308-2320.
[10]Myong HN. Loss of E-cadherin and Acquisition of Vimentin in Epithelial-Mesenchymal Transition are Noble Indicators of Uterine Cervix Cancer Progression[J]. Korean J Pathol, 2012, 46(4):341-348.
[11]Auvinen E, Carpen O, Korpela T, et al. Altered Expres-sion of ezrin, E-Cadherin and β-Catenin in Cervical Neoplasia[J]. Neoplasma, 2013, 60(1):56-61.
[12]Campbell K, Casanova J. A role for E-cadherin in ensuringcohesive migration of a heterogeneous population of non-epithelial cells[J]. Nat Commun, 2015, 6:7998.
[13]陈飞,徐运. 脑小血管病的发病机制和临床特点[J]. 国际脑血管病杂志, 2011, 19(8): 620-624.
[14]王小侠. 伴有远处转移的恶性肿瘤患者血液流变学研究[J]. 中国血液流变学杂志, 2002, 12(3) : 238-239.
[15]Carmeliet P, Jain RK. Angiogenesis in cancer andother diseases[J]. Nature, 2000, 407(6801): 249-257.
